四种冷冻保护剂深低温保存人小口径动脉的实验研究
蔡超操 陈世玖 王成 刘珑玲 曾御
(遵义医科大学第五附属(珠海) 医院烧伤整形手外科,广东 珠海 519000)
近年来,在外科手术中,使用血管移植材料移植重建血管变得越来越常见[1-3]。目前对精子、卵细胞、胚胎等组织细胞的冷冻保存技术研究较为成熟,但对血管组织的深低温保存多处于动物实验阶段,且实验对象主要为大动脉或静脉,比较不同冷冻保护剂深低温冷冻保存人小口径动脉的实验研究报道罕见。本研究以病人放弃的小口径动脉为研究对象,评估甘油,二甲基亚砜、丙二醇、乙二醇四种冷冻保护剂的冻存效果,为血管的深低温保存提供依据。报告如下。
1 材料与方法
1.1材料 (1)实验材料:本实验材料为2016年9月至2018年9月遵义医科大学附属第五(珠海)医院因外伤而行截肢术后遗弃的肢体,严格无菌操作,显微镜下剥离修剪小口径动脉,每一片段0.5cm,收集45个片段。(2)主要实验试剂:甘油:广东恒健;丙二醇:山东酷尔;乙二醇:山东酷尔;二甲基亚砜:Amresco;RPMI-1640培养液:HyClone;胎牛血清:浙江天杭;苏木素:博士德生物;HE染色试剂盒:博士德生物;即用型SABC-POD(小鼠/兔IgG)试剂盒:博士德生物;小鼠单克隆抗体[VG-1] to VEGFA (ab1316):Abcam。(3)主要仪器设备:液氮罐:河南天驰;高压蒸汽灭菌器:广州科鹏;生物组织包埋机:泰维科技;石蜡切片机(TB-718):湖北泰维;自动组织脱水机:leica biosystems;光学显微镜:重庆奥特。一般外科手术器械、显微外科器械、手外科手术显微镜:由遵义医科大学第五附属(珠海)医院手术室提供。
1.2实验方法
1.2.1取材来源及血管制备 血管来源于无传染病、血管疾病及恶性肿瘤患者因创伤而放弃的肢体,在无菌技术操作下切取小口径动脉,将血管片段立即浸泡于4℃0.2%肝素生理盐水中,并反复冲洗管腔,显微镜下见血管组织结构无明显破坏,剥净血管周围结缔组织,剪成长约0.5cm的血管片段,共收集45个片段。取材过程在6 h内完成,且尽量避免损伤血管内膜。
1.2.2实验分组 随机将45个血管片段分为9个组(8个实验组:30%丙二醇组、30%二甲基亚砜组、30%乙二醇组、30%甘油组、40%丙二醇组、40%二甲基亚砜组、40%乙二醇组、40%甘油组;1个对照组),每组5个血管片段。
1.2.3血管保护液配制 以胎牛血清、RPMI-1640培养液为基液,分别配制体积比为1:6:3、1:5:4的丙二醇、二甲基亚砜、乙二醇、甘油保护液。
1.2.4实验步骤 1.肝素盐水冲洗9组血管片段,分别先放入常温含有10%各冷冻保护剂、10%胎牛血清,80%RPMI-1640培养液中30 min,再放入4℃含有30%各冷冻保护剂的玻璃化溶液中20 min,最后将各组血管随机分别放入4℃含有40%各冷冻保护剂的玻璃化溶液内,所有标本冷平衡30 min。等渗平衡后将血管片段分别置入各不同浓度冷冻保护剂的玻璃化溶液的1ml冻存管内,4℃冻存 30 min后,移到﹣20℃冻存2 h再移到﹣80℃条件下过夜后投入到液氮罐中。2.快速复温:冻存管从液氮内取出后,直接放入37℃水浴至完全融化,取出标本放入常温0.5mol/L蔗糖溶液中,摇匀,洗脱10 min,去溶液,再加入0.25mol/L蔗糖溶液中,摇匀,洗脱10 min,去溶液,然后用Hanks液洗脱。3.玻片的制作:(1)将所取标本放入4%的多聚甲醛中固定12 h;(2)50%乙醇冲洗 30 min;(3)50%、70%、80%、90%乙醇脱水各 40 min,95%、100%乙醇脱水各两次,每次20 min;(4)TO透明液透明 20 min;(5)依次在软蜡和硬蜡中各浸2 h;(6)常规石蜡包埋。4.HE染色:(1)切片、展片、烤片;(2)组织切片常规脱蜡至水:TO透明液Ⅰ、TO透明液Ⅱ各5 min;100%无水乙醇Ⅰ、100%无水乙醇Ⅱ、95%乙醇Ⅰ、95%乙醇Ⅱ、90%乙醇、80%乙醇、70%乙醇依次各5 min,蒸馏水漂洗5 min×3次;(3)苏木精液染色5 min;(4)流水洗去苏木精液;(5)1%盐酸酒精1 s;(6)稍水洗;(7)促蓝液返蓝5 s;(8)流水冲洗15 s;(9)0.5%伊红液染色1 min;(10)蒸馏水稍洗1 min;(11)70%乙醇、80%乙醇、90%乙醇、95%乙醇Ⅱ、95%乙醇Ⅰ各10 s,100%无水乙醇Ⅱ、100%无水乙醇Ⅰ各5 min;(12)中性树胶封片后光镜观察;5.免疫组化染色:(1)切片、展片、烤片、脱蜡:60℃条件下烤片1 h,再行脱蜡水化处理:TO透明液Ⅰ、TO透明液Ⅱ各5 min;100%无水乙醇Ⅰ、100%无水乙醇Ⅱ、95%乙醇Ⅰ、95%乙醇Ⅱ、90%乙醇、80%乙醇、70%乙醇依次各5 min,PBS洗3 min×3次。(2)抗原修复:柠檬酸钠抗原修复液放入微波炉加热至沸腾,后将切片放入抗原修复液加热,高火5 min,中火7 min,自然冷却至室温后,PBS洗3 min×3次。(3)阻断内源性过氧化物酶:滴加3%H2O2覆盖组织,室温孵育10 min,PBS洗3 min×3次。(4)封闭:5%BSA封闭液湿盒孵育30 min,甩干,勿洗。(5)滴加一抗:用免疫组化笔在距离组织边缘2mm处画圈,滴加一抗100ul后(小鼠或者兔IgG抗体,浓度为1:100),置于4℃冰箱孵育过夜。第2日取出免疫组化湿盒,37 ℃室温环境下孵育45 min,PBS充分淋洗5 min×3次。(6)滴加生物素标记羊抗兔/鼠IgG,室温环境下孵育30 min,PBS充分淋洗5 min×3次。(7)滴加SABC,37℃孵育30 min,PBS充分淋洗5 min×3次。(8)DAB显色:在棕色小玻璃瓶将DAB-A、DAB-B、DAB-C、蒸馏水各一滴混匀成DAB显色工作液,现配现用。显微镜下查看切片显色情况,约3 min显色后,蒸馏水冲洗,停止显色。(9)切片复染返蓝:苏木素染液染色时间1 min,流动自来水持续振洗1 min至无色,1%盐酸酒精分化5 s,流动自来水持续振洗1 min,1%氨水返蓝10 s,流动自来水持续振洗1 min。(10)脱水:70%乙醇、80%乙醇、90%乙醇、95%乙醇、100%无水乙醇Ⅰ、100%无水乙醇Ⅱ、TO透明液各3 min;组织完全干燥后,使用中性树胶封片,然后显微镜下观察。(11)Image-Pro Plus6.0软件统计单位体积阳性染色区域的平均光密度值。
1.3统计学方法 使用SPSS 21.0统计学软件进行统计学分析,计量资料采用t检验,多组间数据用单因素方差分析(ANOVA),按α=0.05检验水准进行统计学分析。
2 结 果
2.1各组间HE染色结果:

图1 对照组(HE染色×100) 图2 30%乙二醇组(HE染色 ×100) 图3 40%乙二醇组(HE染色 ×100)

图4 30%丙二醇组(HE染色×100) 图5 40%丙二醇组(HE染色 ×100) 图6 30%甘油组(HE染色×100)

图7 40%甘油组(HE染色 ×100) 图8 30%二甲基亚砜组(HE染色×100 图9 40%二甲基亚砜组(HE染色×100)
2.2各组间VEGF免疫组化检测结果
2.2.1保护剂种类 如表1所示:在保护剂浓度为30%时,冷冻保护剂种类不同,所测得的小动脉VEGF平均光密度值也不相同。与对照组比较,甘油组小动脉VEGF平均光密度值显著升高,差异有统计学意义(P<0.05),二甲基亚砜组小动脉VEGF平均光密度值显著升高,差异有统计学意义(P<0.05),丙二醇组小动脉VEGF平均光密度值显著升高,差异有统计学意义(P<0.05),乙二醇组小动脉VEGF平均光密度值升高,差异无统计学意义(P﹥0.05);与乙二醇组比较,丙二醇组小动脉VEGF平均光密度值显著升高,差异有统计学意义(P<0.05),二甲基亚砜组小动脉VEGF平均光密度值显著升高,差异有统计学意义(P<0.05),甘油组小动脉VEGF平均光密度值显著升高,差异有统计学意义(P<0.05);与丙二醇组比较,甘油组小动脉VEGF平均光密度值显著升高,差异有统计学意义(P<0.05),二甲基亚砜组小动脉VEGF平均光密度值显著升高,差异有统计学意义(P<0.05);与甘油组相比较,二甲基亚砜组小动脉VEGF平均光密度值显著升高,差异有统计学意义(P<0.05)。

表1 30%浓度各组人小口径动脉VEGF的检测结果
如表2所示:在保护剂浓度为40%时,冷冻保护剂种类不同,所测得的小动脉VEGF平均光密度值也不相同。与对照组比较,甘油组小动脉VEGF平均光密度值显著升高,差异有统计学意义(P<0.05),二甲基亚砜组小动脉VEGF平均光密度值显著升高,差异有统计学意义(P<0.05),丙二醇组小动脉VEGF平均光密度值显著升高,差异有统计学意义(P<0.05),乙二醇组小动脉VEGF平均光密度值升高,差异无统计学意义(P﹥0.05);与乙二醇组比较,丙二醇组小动脉VEGF平均光密度值显著升高,差异有统计学意义(P<0.05),二甲基亚砜组小动脉VEGF平均光密度值显著升高,差异有统计学意义(P<0.05),甘油组小动脉VEGF平均光密度值显著升高,差异有统计学意义(P<0.05);与丙二醇组比较,甘油组小动脉VEGF平均光密度值显著升高,差异有统计学意义(P<0.05),二甲基亚砜组小动脉VEGF平均光密度值显著升高,差异有统计学意义(P<0.05);与甘油组相比较,二甲基亚砜组小动脉VEGF平均光密度值显著升高,差异有统计学意义(P<0.05)。

表2 40%浓度各组人小口径动脉VEGF的检测结果
2.2.2保护剂浓度 如表3所示,随着冷冻保护剂浓度地增加,丙二醇组小动脉VEGF平均光密度值显著升高,差异有统计学意义(P<0.05),二甲基亚砜组小动脉VEGF平均光密度值显著升高,差异有统计学意义(P<0.05),甘油组小口径动脉VEGF平均光密度值显著升高,差异有统计学意义(P<0.05);乙二醇组小动脉VEGF平均光密度值显著降低,差异有统计学意义(P<0.05)。

表3 不同浓度保护剂各组人小口径动脉VEGF平均 光密度值(×102)的检测结果
各组小动脉VEGF免疫组化结果图示:

图10 对照组(×200)图11 30%乙二醇组(×200) 图12 40%乙二醇组(×200)

图13 30%丙二醇组(×200) 图14 40%丙二醇组(×200) 图15 30%甘油组(×200)
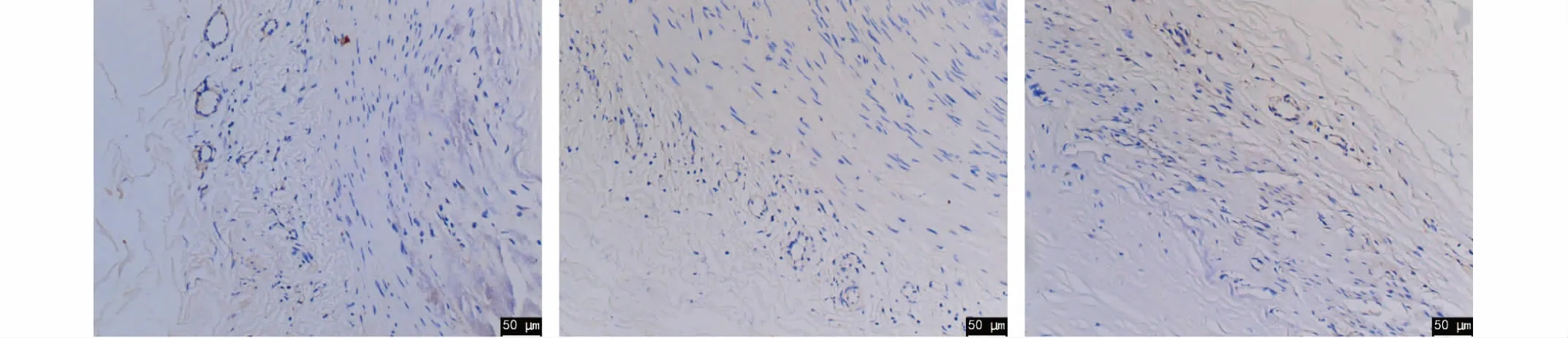
图16 40%甘油组(×200) 图17 30%二甲基亚砜组(×200) 图18 40%二甲基亚砜组(×200)
3 讨 论
冷冻保护剂对小动脉组织结构的影响表明这四种冷冻保护剂对人小口径动脉有一定程度地保护作用。其作用机制可能是通过与溶液中的水分子结合,发生水合作用,减轻“细胞内冰晶损伤”,从而保护细胞和组织;此外,渗透性保护剂还可以渗透入细胞,使细胞避免处于过冷状态,减少“溶质损伤”[4、5]。本研究中,二甲基亚砜组和甘油组可见血管损伤程度较轻,原有组织结构较完整,内皮细胞脱落较少,而丙二醇组表现为内皮细胞小片状脱失,内弹力膜有部分空隙,表明丙二醇对小动脉的冷冻保护效果较甘油、二甲基亚砜差;乙二醇组见内皮细胞大片脱失,内弹性膜部分断裂、缺失,平滑肌结构部分破坏,损伤较重,可见乙二醇的保护作用较二甲基亚砜、甘油、丙二醇差。
冷冻保护剂种类对小动脉血管内皮生长因子表达的影响:血管内皮生长因子(vascular endothelia growth factor,VEGF)是血管内皮细胞特异性的肝素结合生长因子(heparin-binding growth factor),是目前所有促血管生成因子中研究最多最清楚的一个[6],能促进内皮细胞芽生[7、8],诱导新生血管网络的形成与重构[9-12],在血管新生整个过程,发挥了不可取代的作用。本实验通过免疫组化检测VEGF的表达情况,评估血管的生物学功能。免疫组化检测人小动脉VEGF表达情况表明:与对照组比较,甘油组、二甲基亚砜组、丙二醇组三组小动脉VEGF平均光密度值显著升高,差异有统计学意义(P﹤0.05),表示甘油组、二甲基亚砜组、丙二醇组小动脉 VEGF表达明显增加,小动脉生物学功能较对照组好。与乙二醇组比较,丙二醇组、二甲基亚砜组、甘油组三组小动脉VEGF平均光密度值显著升高,差异有统计学意义(P﹤0.05),其中,二甲基亚砜组平均光密度值高于甘油组,差异有统计学意义(P﹤0.05),甘油组高于丙二醇组,差异有统计学意义(P﹤0.05),表明经二甲基亚砜冷冻保存人小动脉快速复温后生物学活性优于甘油,而甘油又优于丙二醇,丙二醇又优于乙二醇。与对照组比较,乙二醇组小动脉VEGF平均光密度值稍高,差异无统计学意义(P﹥0.05),表明在本次实验研究中,乙二醇对人小动脉的冷冻保护效果欠佳。虽然本实验研究表明乙二醇对小动脉的冷冻保存效果较差,但Choi Y H[13]等人研究表明乙二醇对其他的组织或器官保存效果较好,这可能与被保存组织或器官种类相关。
冷冻保护剂浓度和毒性的关系:理想的冷冻保护剂的保存效果随冷冻保护剂浓度的增加而增强,可以在冷却和解冻期间防止细胞损伤,但浓度增高时,毒性也会在增强[14、15]。冷冻保护剂的毒性包括特异性毒性和非特异性毒性,特异性毒性仅发生在高温或特定的细胞或器官中,主要包括:细胞膜毒性、氧化损害、渗透损伤、冷休克等;非特异性毒性可能是通过干扰水分子之间的氢键防止结冰而起到毒性作用[16、17]。毒性取决于多种因素,如冷冻保存时间、温度和浓度、保存组织细胞类型、冷冻保护剂加入及去除时间、降温及复温速率等因素[18-21],成功的深低温保存与上述因素密不可分[22]。在本实验中,当冷冻保护剂浓度不同时,通过免疫组化检测VEGF的表达情况也有不同。随着保护剂浓度的增加,丙二醇组、二甲基亚砜组、甘油组血管的VEGF平均光密度值显著升高,差异有统计学意义(P﹤0.05),表示血管的生物学活性增强,而40%乙二醇组血管VEGF平均光密度值明显低于30%乙二醇组,差异有统计学意义(P﹤0.05),表明乙二醇的浓度由30%上升至40%时,保护效果增强,但同时毒性亦增强,综合结果导致血管的生物学活性减弱。
综上所述,本研究进一步证实了冷冻保护剂在血管深低温保存过程中的保护作用,研究结果表明二甲基亚砜、甘油、丙二醇对人小动脉的深低温保存有保护作用,乙二醇的冷冻保护作用不明显,其中,40%体积浓度的二甲基亚砜对人小口径动脉的冷冻保护效果较甘油、丙二醇、乙二醇好。

