17β-雌二醇及补骨脂素对骨髓间充质细胞向成骨细胞分化的诱导作用
王振涛 刘金钊


摘要 目的:观察17β-雌二醇对骨髓间充质干细胞向成骨细胞分化的诱导作用。方法:将大鼠的骨髓间充质干细胞(BMSCs)暴露于不同浓度的17β-雌二醇、补骨脂素增殖和成骨分化培养基。通过茜素红(Alizarin Red)染色法观察细胞增殖;通过酶联免疫吸附试验法(ELISA)和实时聚合酶链反应(PCR)评估成骨标志物Ⅰ型胶原的分泌水平以及关键因子RUNX2的表达情况。结果:与对照组比较,17β-雌二醇补充剂促进BMSCs增殖。BMSCs增殖添加的17β-雌二醇的不同剂量(0、0.001、0.01、0.1 nmol/L),有效地改善了骨髓间充质干细胞分泌Ⅰ型胶原的水平,RUNX2的mRNA也被上调。17β-雌二醇干预后第5天,Ⅰ型胶原表达显著升高(P<0.05),在17β-雌二醇干预的第7天,RUNX2 mRNA及蛋白表达随17β-雌二醇水平的增加而升高(P<0.05)。结论:17β-雌二醇联合补骨脂素可以作为一种有效的调节剂,以提高骨髓再生中MSC的能力。
关键词 骨髓间充质干细胞;17β-雌二醇;补骨脂素;成骨细胞;成骨相关基因RUNX2;细胞分化;诱导作用;Ⅰ型胶原
Abstract Objective:To observe the inducing effects of 17β-estradiol on the differentiation of bone marrow mesenchymal stem cells into osteoblasts.Methods:BMSCs from rat bone marrow were exposed to different concentrations of 17 beta-estradiol(E2) and psoralen proliferation and osteogenic differentiation media.Cell proliferation was observed by Alizarin Red staining,and the secretion of collagen type I and the expression of key factor RUNX2 were evaluated by ELISA and real-time PCR.Results:17 β-estradiol supplements promoted the proliferation of BMSCs compared with the control group.The different doses of 17 β-estradiol(0,0.001,0.01,0.1 nmol/L) added to the proliferation of BMSCs effectively improved the level of type I collagen secreted by bone marrow mesenchymal stem cells,and the mRNA of RUNX2 was also up-regulated.On the 5th after β-estradiol intervention,the expression of type I collagen was significantly increased(P<0.05).On the 7th day of 17β-estradiol intervention,RUNX2 factor mRNA and protein expression increased with the increase of 17 β-estradiol concentration(P<0.05).Conclusion:17 beta-estradiol combined with psoralen can be used as an effective regulator to improve the ability of MSCs in bone marrow regeneration.
Keywords Bone marrow mesenchymal stem cells; 17 beta estradiol; Psoralen; Osteoblast; Osteogenic related gene RUNX2; Cell differentiation; Induction; Type I Collagen
中图分类号:R512.91文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.13.010
基于成体干细胞的骨组织工程现已成为临床治疗由创伤、肿瘤切除和先天性无效引起的骨骼缺损的有前景的替代方法。骨髓间充质干细胞(Bone Mesenchymal Stem Cells,BMSCs)被认为是这种方法的潜在细胞来源,因为它具有自我更新和多重分化的能力。然而,能够可分离的骨髓BMSCs的数量非常小,并且对于骨再生的临床应用是不充分的[1-3]。已经证明包括年龄、骨质疏松症和关节炎在内的各种病理生理因素可进一步降低细胞数量及其增殖和分化能力。最近有报道称,老年捐赠者骨髓中的BMSCs数量明显低于年轻捐赠者。老年捐赠者的BMSCs衰老百分比及其复制时间显著增加。虽然理论上BMSCs数量可以通过体外细胞培养扩增,但由于细胞衰老,操作会导致增殖和分化潜能显著降低。因此,BMSCs增殖和成骨分化的有效改善对于基于BMSCs的骨再生的临床应用是必需的。类固醇激素积极参与骨代谢并且在包括BMSCs的许多类型的细胞中具有多功能调节作用。例如,糖皮质激素在BMSCs的多重分化中起关键作用,并上调成骨、软骨形成和脂肪形成分化潜能。在骨质疏松症研究中,发现雌激素不仅可以预防骨吸收,还可以通过募集成骨细胞的祖细胞来增加骨形成[4-5]。最近的一项研究表明,补充17β-雌二醇可有效刺激人和小鼠BMSCs的增殖能力。17β-雌二醇还具有提高间充质干细胞(Mesenchymal Stem Cell,MSC)分化潜能的强大能力,包括成骨和成脂分化。17β-雌二醇通过雌激素受体作用调节细胞功能。最近的研究表明雌激素水平的变化是绝经后骨质疏松症的一个重要原因[6]。此外,其他研究发现自体骨髓间充质干细胞移植可以增强骨骼强度,改善骨质疏松症症状。“肾主骨生髓”理论与BMSCs成骨分化有关。《素问·阴阳应象大论》曰:“肾主骨髓,在体为骨。”《素问·宣明五气》曰:“肾生骨髓,其充在肾。”因此,本研究通过四唑类化合物[3-(4,5-dimethylthiazol-2-yl)-5(3-carboxymethoxyphenyl)-2-(4-sulfopheny)-2H-t etrazolium,MTS]測定法测量细胞增殖,研究17β-雌二醇和补骨脂素对大鼠BMSCs增殖和分化的影响及其对大鼠BMSCs分泌Ⅰ型胶原的影响。
1 材料与方法
1.1 材料
1.1.1 动物 选择清洁级3月龄SD大鼠12只,雌雄各半,购自解放军军事医学科学院动物中心,批号:20190302。许可证号:SCXK-(军)2020-003,动物实验伦理审批号:20200356,动物饲养条件:环境温度为22 ℃左右,湿度设置为40%~60%,光照周期为12 h,保持正常自由饮食。
1.1.2 药物 1%抗生素-抗真菌剂(青霉素+链霉素),医院自配,青霉素(瑞阳制药有限公司,批号:019005),链霉素(山东鲁抗医药股份有限公司,批号:018043),地塞米松(瑞阳制药有限公司,批号:020013),β-甘油磷酸(北京智杰方远科技有限公司,批号:019237)。
1.1.3 试剂与仪器 胎牛血清(上海素尔生物科技有限公司,货号:10437-028),17β-雌二醇(艾美捷科技有限公司,货号:10006315-10),补骨脂素(成都格利普生物科技有限公司,货号:66-97-7),TRIzol试剂(北京柏莱斯特科技公司,货号:LGTZ001),Dulbecco′s改良培养基(Dulbecco′s Modified Eagle Medium,LG-DMEM),培养基(武汉普诺赛生命科技公司,货号:PM150210C)。电泳仪(北京六一生物科技有限公司,型号:DYCZ-20H),聚合酶链反应(Polymerase Chain Reaction,PCR)儀(赛默飞世尔科技公司,美国,型号:NEW VeritiPro)。
1.2 方法
1.2.1 分组与模型制备 12只清洁级SD大鼠通过CO2吸入实施安乐死。无菌条件下取其来自胫骨和股骨的骨髓,用不含17β-雌二醇等类固醇的培养基冲洗骨髓腔以洗脱髓腔内细胞。以上所述培养基由不含酚红的α-MEM培养基、10%活性炭剥离的胎牛血清和1%抗生素-抗真菌剂(青霉素+链霉素)组成。将细胞以5×107个细胞/100 mm培养皿接种,并在37 ℃,5% CO2中与不含17β-雌二醇等类固醇的培养基一起温育。在第3天,通过培养基更换去除未附着的细胞来分离MSC。将MSC孵育至80%的浓度,然后以106个细胞/100 mm培养皿的密度进行传代培养。检测细胞CD44、CD90、CD105均呈阳性表达,而CD34、CD45呈阴性表达,鉴定为BMSCs。使用雄性和雌性大鼠的第一部分骨髓间充质干细胞(Passage-1 Bone Mesenchymal Stem Cells,Passage-1 BMSCs)研究17β-雌二醇对BMSCs增殖的功能。将1 000个传代的BMSCs细胞放入96孔板的每个孔中,分为4组,每组250个,分别暴露于补充不同剂量的无类固醇培养基(0.001、0.01、0.1 nmol/L)的17β-雌二醇和补骨脂素。分别记作对照组、0.1 nmol/L 17β-雌二醇和补骨脂素处理组、0.01 nmol/L17β-雌二醇和补骨脂素处理组及0.001 nmol/L 17β-雌二醇和补骨脂素处理组。
1.2.2 干预方法 对照组不进行药物干预处理,而对0.1 nmol/L 17β-雌二醇和补骨脂素处理组、0.01 nmol/L 17β-雌二醇和补骨脂素处理组及0.001 nmol/L 17β-雌二醇和补骨脂素处理组分别给予对应剂量的17β-雌二醇和补骨脂素处理,在第7天,使用茜素红S染色法(Alizarin Red Staining)观察细胞增殖,所有步骤均按照说明书严格操作。
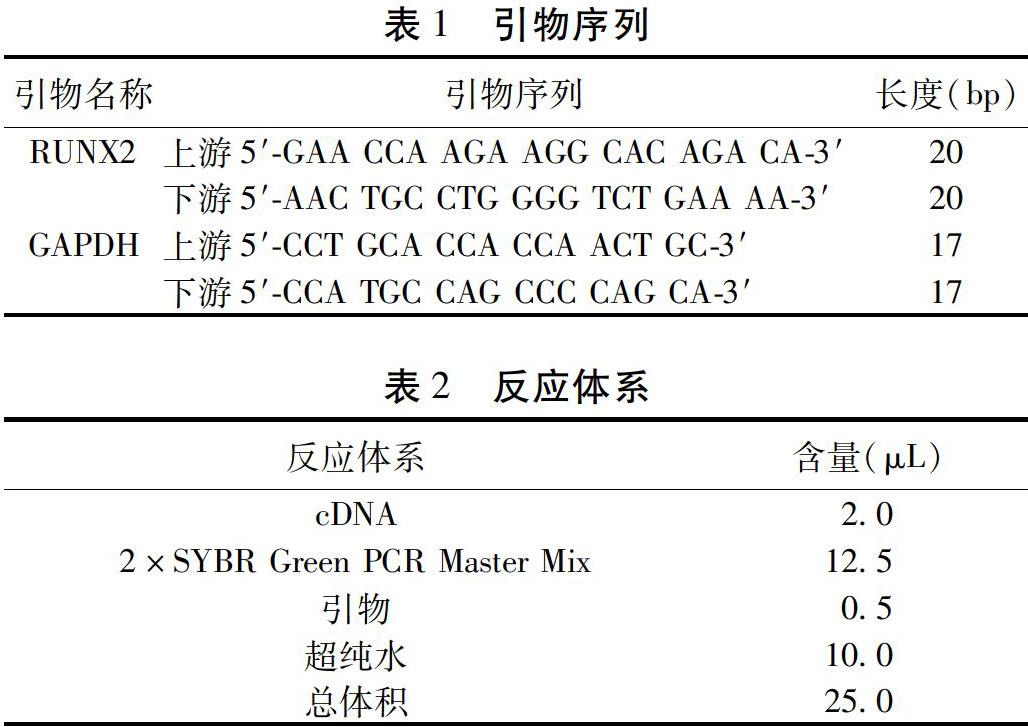
1.2.3 检测指标与方法 1)实时荧光定量聚合酶链反应(Real-time Polymerase Chain Reaction,RT-PCR)测定Runt相关转录因子(Runt-related Transcriptional Factor 2,RUNX2) mRNA表达:实时PCR用于量化细胞因子RUNX2的基因在诱导3、5、7 d后的表达情况。使用总RNA提取试剂(TRIzol)试剂从BMSCs提取总RNA,并使用纯化PCR产物法(QIAquick PCR Purication Kit)纯化。用DNAse I使用第一链cDNA合成试剂盒和随机六聚体引物逆转录反应得到cDNA。使用荧光定量PCR试剂盒(SYBR Green PCR Master Mix)进行定量实时PCR。选用甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate Dehydrogenase,GAPDH)作为内参。RUNX2、GAPDH基因引物序列见表1。反应体系见表2。反应参数:95 ℃ 35 s,35个循环(95 ℃ 35 s,55 ℃ 40 s,72 ℃ 35 s),72 ℃延伸10 min。计算Ct值,得到反应的扩增曲线,计算不同诱导天数BMSCs中细胞因子RUNX2 mRNA相对表达量,产物1.5%琼脂糖凝胶电泳分析。2)BMSCs细胞中Ⅰ型胶原的水平与RUNX2蛋白的测定:将传代-1雄性和雌性大鼠BMSCs以105个细胞/100 mm培养皿的密度接种。在70%的浓度下,将培养基更换为补充有不同浓度17β-雌二醇(0.001、0.01、0.1 nmol/L)的成骨分化培养基。成骨分化培养基由补充有100 nmol/L地塞米松,10 mmol/L β-甘油磷酸和0.05 mmol/L的Dulbecco改良培养基(LG-DMEM)组成。成骨诱导液培养3、5、7 d后,收集各组上清液,根据说明书,用酶联免疫吸附试验(Enzyme Linked Immunosorbent Assay,ELISA)试剂盒测量大鼠BMSCs分泌Ⅰ型胶原的水平。蛋白质印迹法(Western Blotting)检测RUNX2蛋白的表达。
1.3 统计学方法 采用SPSS 20.0统计软件对实验数据进行分析,用单因素方差分析进行样本间比较,测量结果以均数±标准差(±s)表示。各组间的两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 原代大鼠BMSCs的培养、诱导与形态观察 将大鼠BMSCs接种培养48 h后换液,可观察到单核细胞多以圆形形态生长,有的细胞呈长梭形,似成纤维细胞,胞质内颗粒较多。见图1A。使用含有0.001 nmol/L 17β-雌二醇的诱导后可见多个散在分布的、大小形态不均一的棕色钙化结节。见图1B。
2.2 17β-雌二醇和补骨脂素对大鼠BMSCs分泌Ⅰ型胶原的影响 与对照组比较,第3天时,17β-雌二醇和补骨脂素不同剂量处理组对大鼠BMSCs分泌Ⅰ型胶原影响的差异均无统计学意义;第5天时,Ⅰ型胶原分泌量较对照组显著提高,不同剂量17β-雌二醇和补骨脂素处理组较对照组均正相关(P<0.05);在第5天和第7天时,17β-雌二醇和补骨脂素对Ⅰ型胶原的分泌具有剂量依赖性。见表3。
2.3 17β-雌二醇和补骨脂素对大鼠BMSCs RUNX2因子蛋白表达的影响 诱导第7天时,RUNX2蛋白表达升高。见图2~3。
2.4 17β-雌二醇和补骨脂素对大鼠BMSCs RUNX2 mRNA表达的影响 BMSCs增殖添加的17β-雌二醇和补骨脂素的不同剂量(0、0.001、0.01、0.1 nmol/L),有效地改善了骨髓间充质干细胞分泌Ⅰ型胶原的水平,RUNX2的mRNA也被上调。17β-雌二醇干预后第5天,Ⅰ型胶原表达显著升高(P<0.05),干预第7天,RUNX2 mRNA及蛋白表达随17β-雌二醇剂量的增加而升高(P<0.05)。见图4~5。
3 讨论
限制骨髓MSC作为骨组织工程有希望的细胞来源的障碍是有限的细胞供应和降低的分化潜能。MSC增殖和分化的有效改善在确定基于MSC的骨再生的成功临床应用中起关键作用。最近已经证明类固醇可以增加MSC的增殖和分化,并延缓衰老[7-9]。本研究表明,17β-雌二醇促进MSC增殖和成骨分化。17β-雌二醇显著改善了成骨分化期间成骨生长因子的合成。这些数据有力地表明17β-雌二醇可能作为有效的调节剂起作用,以提高MSC再生骨髓的能力。此外,本研究首次证明了17β-雌二醇调节骨髓间充质干细胞的性别差异。类固醇的最佳剂量和改善MSC增殖和成骨潜力的相互作用,有效地根据MSC供体的性别而变化。17β-雌二醇受体,成骨标志物和细胞因子之间的关系也是性别依赖性的。这些结果为将来改善和优化MSC成功骨再生能力提供了重要信息;但是,该机制需要进一步研究。最近在成人干细胞研究文献中已经注意到干细胞的性别差异[10-14]。有研究发现从雌性小鼠分离的肌源性干细胞(Muscle-derived Stem Cells,MDSCs)比从雄性小鼠分离的MDSCs具有更高的骨骼肌再生效率[15]。从雄性小鼠分离的MDSCs具有比从雌性小鼠分离的MDSCs更强的成骨潜能和骨再生[16-17]。还发现从雄性分离的人脂肪来源的干细胞比從雌性分离的那些更具成骨性[18]。虽然这种机制很少被讨论,但其中一个可能的因素是17β-雌二醇受体的性别差异,这些受体在干细胞增殖和分化中起关键作用。
目前的研究表明,17β-雌二醇对MSC具有很强的促有丝分裂作用[19-20]。17β-雌二醇的作用是双相的,并且17β-雌二醇在高剂量下失去功能甚至抑制细胞增殖。发现17β-雌二醇对雌性大鼠MSC具有更多的促有丝分裂功能,而雌激素和地塞米松的组合对雄性大鼠MSC具有更多的促有丝分裂功能。低水平的雌激素和地塞米松对雄性大鼠MSC增殖具有协同作用。同样,在地塞米松存在下,雌二醇的补充有效地改善了MSC的成骨分化;然而,最大限度地上调成骨标志物的剂量具有性别差异。较低剂量的17β-雌二醇上调ALP峰值活性,这是雌性MSC成骨分化的早期标志,而不是雄性。然而,与雌性MSC比较,成熟的成骨细胞标志物骨钙素(Osteocalcin,OCN)的峰值出现在雄性MSC的17β-雌二醇剂量较低的情况下。在雄性和雌性中产生峰值OCN量的17β-雌二醇剂量与BMP-7表达的水平一致。后者与雄性和雌性大鼠MSC中的类固醇受体高度相关。因此,我们认为MSC在成骨分化期间与17β-雌二醇补充的性别差异可能是由类固醇受体的变化引起的。本研究中多种类固醇受体之间的关系也显示了雄性和雌性MSC之间的差异。这也表明类固醇受体的差异可能是成骨分化中性别二态性的原因。
类固醇激素在细胞和组织代谢中相互作用。糖皮质激素和雌激素已经被证明可以交互作用于它们的受体并调节骨髓细胞。据报道雌二醇(E2)在成骨分化期间增加雌激素受体α(Estrogen Receptor α,ERα),而在雌性小鼠MSC中不增加ERα[21]。在本研究中,我们发现17β-雌二醇补充剂不仅可以上调ERα,还可以上调雄性和雌性供体的MSC的糖皮质激素受体(Glucocorticoid Receptor,GR)和雄激素受体(Androgen Receptor,AR)。E2还上调雄性供体的MSC的ERα,而对雌性MSC的作用较少。ERα的变异与雄性和雌性MSC中的ER,GR和AR水平高度相关。ER与雄性MSC中的GR和AR相关,与雌性MSC中的GR无关。这表明雌激素受体β(Estrogen Receptor β,ERβ)可能在用E2补充剂处理的雄性和雌性MSC的成骨分化中起不同作用。
据报道,雌激素可通过上调成骨生长因子的数量来增加骨髓细胞的成骨分化,包括骨形成蛋白(Bone Morphogenetic Protein,BMP)-2,BMP-6和转化生长因子-β1(Transforming Growth Factor-beta 1,TGF-β1)[22]。本研究表明,17β-雌二醇补充剂可有效上调雄性和雌性MSC中TGF-β1的表达。上调的TGF-β1与MSC的碱性磷酸酶(Alkaline Phosphatase,ALP)高度相关。此外,首次探索E2在MSC的成骨分化过程中有效上调BMP-7的作用。BMP-7已被广泛认为是骨再生的成骨蛋白。BMP-7的功能包括骨形成和癌细胞增殖,是产生雌激素依赖的关键环节。在本研究中,BMP-7的mRNA被17β-雌二醇补充剂上调,并且在成骨分化期间与雄性和雌性大鼠MSC中的类固醇受体高度相关。这表明E2增加成骨分化的机制之一可能是通过上调BMP-7。骨碎补能有效地促进BMSCs增殖和骨向分化,上调TGF-β1、BMP-2的表达量可能是其作用机制之一,并由此影响其在骨髓中的增殖和分化,使干细胞具有迁移归巢的特性。虽然目前使用的成骨标志物包括ALP和OCN肯定会影响MSC的成骨潜能,但它们不是MSC骨形成能力的可靠预测因子。因此,需要在体外和体内定量测量MSC的骨形成,以进一步证实MSC的类固醇调节功能。
本研究初步揭示了成骨分化过程中成骨细胞和类固醇受体相关基因表达的相关性。然而,未来使用基因敲除技术和开展拮抗剂的研究对于进一步证明这一点是必要的。17β-雌二醇和补骨脂素具有促进MSC增殖和分化的作用,并且RUNX2参与了该调控过程。
参考文献
[1]黄庆雷,魏晓飞.间充质干细胞免疫调节的可塑性[J].中国科学:生命科学,2016,46(7):799-808.
[2]连宝涛,徐景利,郭震浪,等.葛根素注射液联合西药常规治疗心力衰竭疗效的Meta分析[J].中国实验方剂学杂志,2016,22(4):189-194.
[3]宋宝全.人间充质干细胞成脂分化调控机制的研究[D].北京:北京协和医学院,2016.
[4]何晓清.Wnt3a/5a信号在TLR4调控MSC向成骨细胞分化成熟中的作用及机制研究[D].重庆:第三军医大学,2016.
[5]刘关羽,何卫阳,朱鑫,等.氧化应激诱导自噬对骨髓间充质干细胞增殖与凋亡的影响[J].中国病理生理杂志,2015,31(12):2176-2182.
[6]刘晓光,肖卫华,赵淋淋,等.间充质干细胞移植治疗骨骼肌损伤的研究进展[J].中国康复医学杂志,2015,30(12):1313-1317.
[7]曾建春,曾意荣,樊粤光,等.淫羊藿甙诱导MSCs向成骨细胞分化过程中对Wnt信号通路的影响[J].广州中医药大学学报,2014,31(4):607-611,678.
[8]杨丽,朱晓峰,王攀攀,等.淫羊藿水提取物对大鼠骨髓间充质干细胞骨向分化的影响及其机制[J].中草药,2013,44(22):3182-3187.
[9]门通,朴善花,滕春波.Hippo信号通路转录效应因子TAZ/YAP对间充质干细胞分化的调控[J].遗传,2013,35(11):1283-1290.
[10]刘海全,秦佳佳,吴倩.淫羊藿对骨质疏松MSCs成脂分化PPARγ mRNA表达的影响[J].中药新药与临床药理,2013,24(4):382-385.
[11]武密山,赵素芝,任立中,等.川续断皂苷Ⅵ诱导大鼠骨髓间充质干细胞向成骨细胞方向分化的研究[J].中国药理学通报,2012,28(2):222-226.
[12]Deal C.Potential new drug targets for osteoporosis[J].Nat Clin Pract Rheumatol,2009,5(1):20-27.
[13]Lozo P,Krpan D,Krvavica A,et al.Bone histology in postmenopausal osteoporosis--variations in cellular activity[J].Acta Med Croatica,2004,58(1):5-11.
[14]Duque G.Bone and fat connection in aging bone[J].Curr Opin Rheumatol,2008,20(4):429-434.
[15]Tuli R,Tuli S,Nandi S,et al.Characterization of multipotential mesenchymal progenitor cells derived from human trabecular bone[J].Stem Cells,2003,21(6):681-693.
[16]Leskel HV,Olkku A,Lehtonen S,et al.Estrogen receptor alpha genotype confers interindividual variability of response to estrogen and testosterone in mesenchymal-stem-cell-derived osteoblasts[J].Bone,2006,39(5):1026-1034.
[17]Wang Z,Goh J,Das De S,et al.Efficacy of bone marrow-derived stem cells in strengthening osteoporotic bone in a rabbit model[J].Tissue Eng,2006,12(7):1753-1761.
[18]Sekiya I,Larson BL,Smith JR,et al.Expansion of human adult stem cells from bone marrow stroma:conditions that maximize the yields of early progenitors and evaluate their quality[J].Stem Cells,2002,20(6):530-541.
[19]Kadowaki A,Tsukazaki T,Hirata K,et al.Isolation and characterization of a mesenchymal cell line that differentiates into osteoblasts in response to BMP-2 from calvariae of GFP transgenic mice[J].Bone,2004,34(6):993-1003.
[20]Hong L,Sultana H,Paulius K,et al.Steroid regulation of proliferation and osteogenic differentiation of bone marrow stromal cells:a gender difference[J].J Steroid Biochem Mol Biol,2009,114(3-5):180-185.
[21]Mizuno M,Kuboki Y.Osteoblast-related gene expression of bone marrow cells during the osteoblastic differentiation induced by type I collagen[J].J Biochem,2001,129(1):133-138.
[22]Sammons J,Ahmed N,El-Sheemy M,et al.The role of BMP-6,IL-6,and BMP-4 in mesenchymal stem cell-dependent bone development:effects on osteoblastic differentiation induced by parathyroid hormone and vitamin D(3)[J].Stem Cells Dev,2004,13(3):273-280.
(2019-02-14收稿 責任编辑:王明)

