靶向药物皮肤不良事件患者报告结局评价工具的现状
宋丽君 马雪娇 吴晓月 蔡瑞娟 刘杰 林洪生
摘要 随着靶向药物在癌症治疗领域的应用日益广泛,相应的皮肤不良事件也越来越复杂多变,对患者的生命质量造成不良影响。不同的靶向药物因其作用靶点的不同,在皮肤毒性的表现形式、发生率和严重程度上也各不相同。为了对这类皮肤毒性进行更准确的评估并加以适当干预,已经开发了多种评估工具。现对目前国内已上市的多种靶向药物皮肤毒性特点进行了归纳总结,在此基础上对相关临床研究中使用的患者报告结局评价工具现状进行综述,重点介绍各种工具的基本特征、优势和不足,以期在临床研究及医疗实践过程中为肿瘤科医护人员选择适当的评估工具提供有价值的建议。
关键词 靶向药物;皮肤不良事件;患者报告结局;症状;量表;健康相关生命质量
Abstract With the increasing application of targeted drugs in the field of cancer therapy,the corresponding dermatologic adverse events are becoming more and more complex and changeable,causing adverse effects on patients′ quality of life.Different targeted drugs have different manifestations,incidence and severity of skin toxicity due to their different targets.In order to conduct a more accurate assessment of this type of skin toxicity and make appropriate interventions,multiple evaluation tools have been developed.This paper summarizes the dermatologic toxicity characteristics of a variety of targeted drugs currently on the market in China.On this basis,it summarizes the current status of patient report outcome evaluation tools used in related clinical studies,focusing on the basic characteristics of various tools,advantages and disadvantages,in order to provide valuable suggestions for oncology medical staff to choose appropriate evaluation tools in the clinical research and medical practice environment.
Keywords Targeted drugs; Dermatologic adverse events; Patient-reported outcome; Symptom; Scale; Health related quality of life
中圖分类号:R273文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.13.001
经过近20年的发展,抗癌治疗已经进入靶向治疗的时代。全球已开发出的多种靶向治疗药物,涉及50多个治疗靶点,27种癌症类型,目前中国已经上市的靶向药物(包括进口和国产)共涉及21种癌症,45种药物(截至发稿前)。靶向药物应用的日益广泛在改善肿瘤应答的同时也伴随着多种多样的皮肤不良事件(Dermatologic Adverse Events,dAEs)发生,症状负担以及伴随的症状干扰会严重影响患者的健康相关生命质量(Health Related Quality of Life,HRQoL)[1]。为了对dAEs进行准确的评估已经开发了一系列工具,以美国国家癌症研究所的不良事件通用术语标准(NCI-CTCAE)为代表的临床医生报告结局(Clinician-report Outcome,CRO)工具能提供可靠的临床数据,而患者报告结局(Patient-Reported Outcome,PRO)也已经被证实是一种有效的、可靠的、可行的和精准的评价方法[2-3],可与CRO互相补充用于评估dAEs。本综述基于不同靶点靶向药物特征性的dAEs临床表现,旨在对此领域相关文献中使用的PRO工具进行梳理总结,比较量表内容、量表结构、心理计量学特性和应答者负担等参数,为临床和科研环境下评估工具的选择提供合理建议。
1 靶向药物所致dAEs的症状特点
1.1 皮疹 皮疹是应用靶向药物最常见的皮肤毒性,皮疹表现常描述为痤疮样皮疹,通常在初次使用药物后7~10 d出现,在4~6周内达到最严重,并在停药后12~16周内缓解[4]。表皮生长因子受体(Epidermal Growth Factor Receptor,EGFR)抑制剂导致的皮疹在不同的临床试验中发生率范围是45%~100%[5],常见药物如酪氨酸激酶抑制剂(Tyrosine Kinase Inhibitors,TKIs)吉非替尼、厄洛替尼、埃克替尼等,而西妥昔单抗的皮疹发生率与严重程度高于TKIs[6]。由于不可逆的抑制和广泛的抑制作用,二代TKIs如阿法替尼,达可替尼等具有较一代TKIs更频繁和严重的dAEs发生[7],三代TKIs如奥希替尼的皮疹发生率已经大为降低。BRAF抑制剂如维莫非尼具有特征性的皮疹表现,呈毛周角化病样皮疹[8]。其余靶向药物,例如多激酶抑制剂(Multi-kinase Inhibitors,MKIs)如舒尼替尼、索拉菲尼[9],间变性淋巴瘤激酶(Anadegenerative Lymphoma Kinase,ALK)抑制剂如阿来替尼和克唑替尼[10]的皮疹发生率均较EGFR抑制剂低,而靶向人表皮生长因子受体-2(Human Epidermal Growth Factor Receptor 2,Her-2)的曲妥珠单抗导致皮疹发生率只有1%[11]。
1.2 干燥和瘙痒 干燥和瘙痒可能与皮疹重叠,属于大多数靶向药物常见的皮肤毒性,如EGFR抑制剂,MEK抑制剂等。干燥和瘙痒不但发生率高于皮疹,并且对HRQoL的影响也高于皮疹,按顺序为瘙痒(24.2%)、干燥症(18.9%)、皮肤灼热感(8.4%)和皮疹(6.3%)[12]。
1.3 手足皮膚反应 手足皮肤反应(Hand and Foot Skin Reaction,HFSR)典型影响手掌、脚底和任何摩擦增加的区域,患者可能会有麻木、刺痛等感觉异常[13],几周后发生的疼痛和角化过度病变会进一步限制日常生活活动。靶向血管内皮生长因子(Vascular Endothelial Growth Factor,VEGF)信号通路的血管生成抑制剂,尤其是MKIs如舒尼替尼、索拉菲尼、瑞戈非尼、安罗替尼等最常引起HFSR,一项汇总分析表明与之相关的所有级别HFSR发生率为35.0%[14]。
1.4 黏膜异常 口腔黏膜炎是雷帕霉素靶蛋白(Mammalian Target of Rapamycin,mTOR)抑制剂依维莫司最常见的剂量限制性毒性病变,出现疼痛、口干、味觉改变、口腔灼热感等症状,大部分发生在治疗的前8周内;≥3级毒性发生率为5%[15]。伊马替尼导致的口腔黏膜毒性相较EGFR抑制剂和mTOR抑制剂来说更具特异性,呈现类苔藓反应,伴有症状性溃疡、糜烂或萎缩性病变[16]。吡咯替尼是我国原研小分子靶向药,目前报道最多的不良反应是口腔溃疡[17]。尽管这种不良反应通常是自限性的,但病变引起的不适症状、进食困难等导致患者非常痛苦。除了口腔黏膜改变外,亦有干眼症的报道[18]。
1.5 其他dAEs 如指甲异常、毛发改变、光敏性、色素改变、皮肤继发肿瘤等。指甲改变主要是指甲沟炎、指尖开裂,以及指(趾)甲变脆、甲裂、甲板生长减缓等,伴有疼痛,发生于治疗2~4个月后,对患者日常生活活动影响较大。毛发异常表现为脱发、多毛、睫毛卷曲、毛发变脆、易断和变色等改变,脱发通常在EGFR抑制剂治疗开始后2~4个月出现,而在治疗1~2个月后可能会出现多毛症[19]。靶向药物诱导的光敏性特征在于紫外线诱导引起的红斑、灼热感,伴或不伴疼痛,并可见轻度至重度脱皮[8,20]。一些靶向药物能导致色素沉着过度或不足,如伊马替尼[21],舒尼替尼[22]等。据报道接受维莫非尼、曲美替尼治疗的患者会发展成继发性皮肤肿瘤和其他过度增殖性病变,例如鳞状细胞癌(Squamous Cell Carcinoma,SCC)和角化棘皮瘤(Keratinoacanthoma,KA)[8],继发性皮肤肿瘤具有低转移潜能,通常自发性消退,并且容易治愈。伊马替尼的使用常导致水肿,以眶周水肿尤其明显[23]。伊布替尼临床使用中也会观察到皮肤相关损伤如瘀点、青肿的发生,据报道发生率2%~27%[24]。我国自主研发的新一代BTK抑制剂泽布替尼不良反应显示有32.5%的青肿和13.0%的瘀点发生率[25]。
2 评估靶向治疗dAEs的PRO工具
2.1 特定于皮肤病学的工具(适用于所有皮肤疾病)
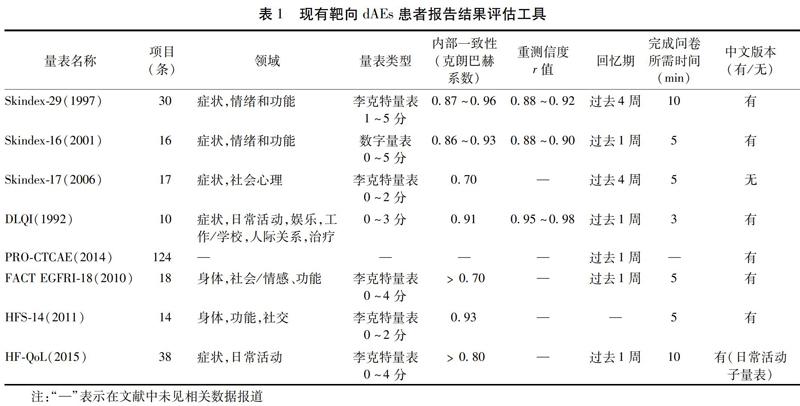
2.1.1 Skindex系列量表(Skindex-29,Skindex-16,Skindex-17) 在皮肤病学专用的HRQoL工具中,Skindex-29一度被认为是最佳工具[26]。该量表询问患者各项目描述状况所发生的频率。每个项目均按5项量表进行评分(从不、很少、有时、经常、总是)。Skindex-29是有效、可靠且响应迅速的量表[27]。Skindex-16由Skindex-29发展而来,具有2个新功能:1)更少的问题;2)测量由疾病引起的困扰大小,而不是发作频率。在临床中,Skindex-16简洁可行,具有高度的内部一致性,可解释性强,能够对皮肤疾病的临床变化做出响应[28]。国内学者已经对其进行了汉化并评估了信效度[29],中文版本同样具有较高的内部一致性(Cronbach′s α 0.86~0.96)。Skindex-17使用Rasch分析从Skindex-29衍生而来[30],以3点量表(“从不”“很少/有时”和“经常/总是”)给出答案。Skindex系列问卷均为皮肤病学通用HRQoL量表,并且已经在靶向治疗dAEs领域应用,以Skindex-16应用最多。Skindex-16和Skindex-17具备量表较短的实际优势,缺点在于它们未涵盖毛发改变、指甲病变及黏膜损伤等相关症状项目,会造成重要信息丢失。见表1。
2.1.2 皮肤病生命质量指数 皮肤病生命质量指数(Dermatology Life Quality Index,DLQI)是一个10项简短问卷,用于评估皮肤疾病对生命质量的影响[31]。中文版本经评估具有良好的心理计量学特性[32],按4分制评分(非常严重、严重、少许、无)[33]。DLQI是第一个,也是应用最广泛的皮肤病特异性HRQoL工具,但仍有局限性,它专注于患者在日常活动中的功能,不能完全捕捉情绪和心理健康,这表明,DLQI在皮肤病轻微的患者或主要影响情绪的症状(如瘙痒和脱发)中可能缺乏概念上的有效性。该量表提供不同的管理表格,包括插图版,家庭版和儿童版。见表1。
2.1.3 PRO不良事件通用术语标准 是不良事件通用术语标准(Common Terminology Criteria Adverse Events,CTCAE)的PRO版本,以直接从患者那里收集主观症状[34]。PRO-CTCAE是通用的评估工具,可以根据研究目的挑选适合的项目,我们梳理了有关靶向治疗导致dAEs的症状项,结果显示有10项(痤疮样皮疹、皮疹、皮肤干燥、皮肤瘙痒、脱发、HFSR、光敏感、皮肤色素沉着、荨麻疹和口腔黏膜炎)。该项目库中对指甲项目的描述更适合评估化学药物治疗导致的指甲损伤(指甲板或指甲基质病变),并不符合靶向药物所致指甲损伤的特点(甲沟炎和甲周化脓性肉芽肿)。此外,缺乏对结膜受损症状(如干眼症)评估的问题。PRO-CTCAE以评价症状性不良事件为主,并非HRQoL工具,因此欠缺对生命质量干扰的评估,另外,使用选定的症状性AE可以减轻患者负担,但也可能导致报告不完整[35]。见表1。
2.2 特定于某種皮肤病学的工具(特定于评估靶向药物dAEs)
2.2.1 癌症治疗功能评价-表皮生长因子受体抑制剂-18量表 癌症治疗功能评价-表皮生长因子受体抑制剂-18(FACT EGFRI-18)旨在评估EGFR抑制剂相关dAEs对HRQoL的影响[36]。问卷中17个问题围绕皮肤不良事件,只有一个问题针对黏膜不良事件(干眼症)。量表回应分数介于0~4之间,回应类别包括“一点也不”“一点”“有点”“相当多”和“非常多”。由于FACT EGFRI-18是针对EGFR抑制剂而开发,所以涵盖了头发、指甲和黏膜的相关评估项目,在荷兰FACT-EGFRI-18被确定为与靶向dAEs症状负担相关的生命质量的适当测量工具[37],但参与研究的患者多数反映并非所有想要报告的dAEs都包含在问卷中,例如,关于眼睛敏感,口干,皮肤和头皮的刺痛感和压痛感,其他口腔问题如牙齿敏感、口味变化,口腔灼热感等。FACT EGFRI-18仍然是一个比较新的工具,尚未得到充分验证。见表1。
2.2.2 手足综合征-14量表 如前所述,一些抗血管生成MKIs与HFSR相关。手足综合征-14(Hand Foot Syndrome-14,HFS-14)工具是一种简单易用的手足综合征特异性患者自我评估QoL量表[38]。14个项目侧重于评估患者功能受损程度,另外有2个单独的问题涉及评估症状负担:一个用于测量肢体受累(手、脚或二者皆有),另一个用于测量疼痛有无。该量表作为一个生命质量量表,并未评估其他HFSR常见症状负担,且没有设置明确的回忆期。见表1。
2.2.3 HFSR生命质量量表 尽管已经存在HFS-14工具,但其缺乏与病情相关的更广泛的症状负担评估;2015年,Anderson等[39]开发了HFSR生命质量量表(HF-QoL),HF-QoL工具包括20项的症状子量表和18项的日常活动子量表。症状子量表中根据“足”“手和手指”区分了不同病位,仔细询问了皮肤颜色、指甲变化、疼痛、肿胀、麻木、角化过度等HFSR症状体验,较HFS-14能够评估更广泛的症状负担;日常活动子量表包含4个子域(身体、自我护理、社交和心理),用于评估症状负担对QoL的影响程度。经测试,2个子量表均具有出色的心理测量特性,研究认为HF-QoL量表是评估HFSR的适合工具[39]。见表1。
3 结语
鉴于靶向药物所致dAEs影响抗癌治疗方案的实施并影响患者的生命质量,在临床中多采取预防性干预措施。现代医学常规多采用抗生素类、类固醇类药物,中医药根据辨证、辨病结合的优势在降低皮肤毒性方面发挥了独特的作用[40-41]。但最佳治疗方案的产生依赖于对疗效做出准确评估。实践证明PRO能够更好地反映患者的体验和感知,有利于改善dAEs的报告和治疗。要选择合适的PRO工具,应权衡工具的心理测量学特征、预期的研究目的、干预措施的作用特点等综合而定。
为满足临床研究评估方法的一致性,减少防治靶向药物dAEs临床研究的异质性,考虑到现有PRO工具未满足的临床和研究需求,可以开展如下探索性研究:1)研发适于各类靶向药物dAEs评估的通用量表,可以全面评估各类靶向药物皮肤毒性所致的共性症状负担和功能影响;2)不同靶点靶向药物特征性的症状性dAEs可作为特异性附加条目,在通用量表基础上形成适于评估某类靶向药物dAEs的专用量表;3)增加现有量表在应用中发现的未满足临床患者需求的重要条目。此外,结合中医整体观念和辨证论治的诊疗特点,一方面在局部皮肤表现评估的同时,注重全身系统症状的评估,另一方面可探索开发适合中医药疗效特点的集全身系统症状、局部皮肤症状、舌象等条目在内的复合评估工具,有助于探索靶向治疗阶段不同中医辨证分型的临床研究,推动中医药优势作用的科学评价。
参考文献
[1]Lacouture M,Sibaud V.Toxic Side Effects of Targeted Therapies and Immunotherapies Affecting the Skin,Oral Mucosa,Hair,and Nails[J].Am J Clin Dermatol,2018,19(1):31-39.
[2]Di Maio M,Basch E,Bryce J,et al.Patient-reported outcomes in the evaluation of toxicity of anticancer treatments[J].Nat Rev Clin Oncol,2016,13(5):319-325.
[3]Calvert M,Kyte D,Mercieca-Bebber R,et al.Guidelines for Inclusion of Patient-Reported Outcomes in Clinical Trial Protocols: The SPIRIT-PRO Extension[J].JAMA,2018,319(5):483-494.
[4]Beech J,Germetaki T,Judge M,et al.Management and grading of EGFR inhibitor-induced cutaneous toxicity[J].Future Oncol,2018,14(24):2531-2541.
[5]Agirgol S,aytemel C,Pilanci KN.Dermatological side effects of targeted antineoplastic therapies: a prospective study[J].Cutan Ocul Toxicol,2020,39(4):380-384.
[6]Cunningham D,Humblet Y,Siena S,et al.Cetuximab monotherapy and cetuximab plus irinotecan in irinotecan-refractory metastatic colorectal cancer[J].N Engl J Med,2004,351(4):337-345.
[7]Kim Y,Lee SH,Ahn JS,et al.Efficacy and Safety of Afatinib for EGFR-mutant Non-small Cell Lung Cancer,Compared with Gefitinib or Erlotinib[J].Cancer Res Treat,2019,51(2):502-509.
[8]Nowara E,Huszno J,Slomian G,et al.Skin toxicity in BRAF(V600) mutated metastatic cutaneous melanoma patients treated with vemurafenib[J].Postepy Dermatol Alergol,2016,33(1):52-56.
[9]Rosenbaum SE,Wu S,Newman MA,et al.Dermatological reactions to the multitargeted tyrosine kinase inhibitor sunitinib[J].Support Care Cancer,2008,16(6):557-566.
[10]Hida T,Nokihara H,Kondo M,et al.Alectinib versus crizotinib in patients with ALK-positive non-small-cell lung cancer(J-ALEX): an open-label,randomised phase 3 trial[J].Lancet,2017,390(10089):29-39.
[11]Sodergren SC,Copson E,White A,et al.Systematic Review of the Side Effects Associated With Anti-HER2-Targeted Therapies Used in the Treatment of Breast Cancer,on Behalf of the EORTC Quality of Life Group[J].Target Oncol,2016,11(3):277-292.
[12]Clabbers J,Boers-Doets CB,Gelderblom H,et al.Xerosis and pruritus as major EGFRI-associated adverse events[J].Support Care Cancer,2016,24(2):513-521.
[13]Lacouture ME,Wu S,Robert C,et al.Evolving strategies for the management of hand-foot skin reaction associated with the multitargeted kinase inhibitors sorafenib and sunitinib[J].Oncologist,2008,13(9):1001-1011.
[14]Ding F,Liu B,Wang Y.Risk of hand-foot skin reaction associated with vascular endothelial growth factor-tyrosine kinase inhibitors: A meta-analysis of 57 randomized controlled trials involving 24,956 patients[J].J Am Acad Dermatol,2020,83(3):788-796.
[15]Rugo HS,Hortobagyi GN,Yao J,et al.Meta-analysis of stomatitis in clinical studies of everolimus: incidence and relationship with efficacy[J].Ann Oncol,2016,27(3):519-525.
[16]Sibaud V,Boralevi F,Vigarios E,et al.[Oral toxicity of targeted anticancer therapies][J].Ann Dermatol Venereol,2014,141(5):354-363.
[17]Ma F,Li Q,Chen S,et al.Phase I Study and Biomarker Analysis of Pyrotinib,a Novel Irreversible Pan-ErbB Receptor Tyrosine Kinase Inhibitor,in Patients With Human Epidermal Growth Factor Receptor 2-Positive Metastatic Breast Cancer[J].J Clin Oncol,2017,35(27):3105-3112.
[18]Saint-Jean A,Reguart N,Eixarch A,et al.Ocular surface adverse events of systemic epidermal growth factor receptor inhibitors(EGFRi):A prospective trial[J].J Fr Ophtalmol,2018,41(10):955-962.
[19]Mitchell EP,Perez-Soler R,Van Cutsem E,et al.Clinical presentation and pathophysiology of EGFRI dermatologic toxicities[J].Oncology(Williston Park),2007,21(11):4-9.
[20]Lacouture ME,Maitland ML,Segaert S,et al.A proposed EGFR inhibitor dermatologic adverse event-specific grading scale from the MASCC skin toxicity study group[J].Support Care Cancer,2010,18(4):509-522.
[21]Di Tullio F,Mandel VD,Scotti R,et al.Imatinib-induced diffuse hyperpigmentation of the oral mucosa,the skin,and the nails in a patient affected by chronic myeloid leukemia: report of a case and review of the literature[J].Int J Dermatol,2018,57(7):784-790.
[22]Luo D,Chen H,Searles G,et al.Coordinated mRNA expression of c-Kit with tyrosinase and TRP-1 in melanin pigmentation of normal and malignant human melanocytes and transient activation of tyrosinase by Kit/SCF-R[J].Melanoma Res,1995,5(5):303-309.
[23]Desar IM,van Herpen CM,van Erp NP,et al.A successful approach to overcome imatinib-induced skin toxicity in a GIST patient[J].Anticancer Drugs,2016,27(6):576-579.
[24]Iberri DJ,Kwong BY,Stevens LA,et al.Ibrutinib-associated rash: a single-centre experience of clinicopathological features and management[J].Br J Haematol,2018,180(1):164-166.
[25]Trotman J,Opat S,Gottlieb D,et al.Zanubrutinib for the treatment of patients with Waldenstrm macroglobulinemia: 3 years of follow-up[J].Blood,2020,136(18):2027-2037.
[26]Both H,Essink-Bot ML,Busschbach J,et al.Critical review of generic and dermatology-specific health-related quality of life instruments[J].J Invest Dermatol,2007,127(12):2726-2739.
[27]Chren MM,Lasek RJ,Quinn LM,et al.Convergent and discriminant validity of a generic and a disease-specific instrument to measure quality of life in patients with skin disease[J].J Invest Dermatol,1997,108(1):103-107.
[28]Chren MM,Lasek RJ,Sahay AP,et al.Measurement properties of skindex-16: A brief quality-of-life measure for patients with skin diseases.[J].J CUTAN MED SURG,2001,5(2):105-110.
[29]He Z,Lu C,Chren MM,et al.Development and psychometric validation of the Chinese version of Skindex-29 and Skindex-16[J].Health Qual Life Outcomes,2014,12:190.
[30]Nijsten TE,Sampogna F,Chren MM,et al.Testing and reducing skindex-29 using Rasch analysis: Skindex-17[J].J Invest Dermatol,2006,126(6):1244-1250.
[31]Finlay AY,Khan GK.Dermatology Life Quality Index(DLQI)--a simple practical measure for routine clinical use[J].Clin Exp Dermatol,1994,19(3):210-216.
[32]He Z,Lu C,Basra MK,et al.Psychometric properties of the Chinese version of Dermatology Life Quality Index(DLQI) in 851 Chinese patients with psoriasis[J].J Eur Acad Dermatol Venereol,2013,27(1):109-115.
[33]Basra MK,Fenech R,Gatt RM,et al.The Dermatology Life Quality Index 1994-2007: a comprehensive review of validation data and clinical results[J].Br J Dermatol,2008,159(5):997-1035.
[34]Basch E,Reeve BB,Mitchell SA,et al.Development of the National Cancer Institute′s patient-reported outcomes version of the common terminology criteria for adverse events(PRO-CTCAE)[J].J Natl Cancer Inst,2014,106(9):1-11.
[35]Shepshelovich D,McDonald K,Spreafico A,et al.Feasibility Assessment of Using the Complete Patient-Reported Outcomes Version of the Common Terminology Criteria for Adverse Events(PRO-CTCAE) Item Library[J].Oncologist,2019,24(4):146-148.
[36]Wagner L,Lai SE,Aneja M,et al.Development of a functional assessment of side-effects to therapy(fast) questionnaire to assess dermatology-related quality of life in patients treated with egfr inhibitors(egfri):The fast-egfri[J].Nucleic Acids Res,2007,37(17):5838-5847.
[37]Boers-Doets CB,Gelderblom H,Lacouture ME,et al.Experiences with the FACT-EGFRI-18 instrument in EGFRI-associated mucocutaneous adverse events[J].Support Care Cancer,2013,21(7):1919-1926.
[38]Sibaud V,Dalenc F,Chevreau C,et al.HFS-14,a specific quality of life scale developed for patients suffering from hand-foot syndrome[J].Oncologist,2011,16(10):1469-1478.
[39]Anderson RT,Keating KN,Doll HA,et al.The Hand-Foot Skin Reaction and Quality of Life Questionnaire: An Assessment Tool for Oncology[J].Oncologist,2015,20(7):831-838.
[40]张小瑞,赵远红.非小细胞肺癌靶向药物相关皮肤毒性反应的中医辨治[J].中医杂志,2015,56(12):1065-1066.
[41]王学谦,张英,刘杰,等.自拟皮疹颗粒治疗EGFR-TKI相关皮疹的随机对照研究[J].世界中西医结合杂志,2016,11(12):1629-1632,1649.
(2021-04-23收稿 责任編辑:王明)

