酸枣仁蛋白组分的分离提取及亚基分析
张红印,韩荣欣,肖凤琴,王海东,严铭铭, ,赵大庆
1. 长春中医药大学(长春 130117);2. 吉林省中药保健食品科技创新中心(长春 130117)
中药酸枣仁始载于《神农本草经》,是中国传统常用中药,其来源为鼠李科植物酸枣Ziziphus jujubaMill. var.spinosa(Bunge)Hue x H. F. Chou的干燥成熟种子[1],收录于2002年颁发的《既是食品又是药品的物品名单》。迄今为止,在酸枣仁中鉴定出化合物150余种,包括萜类、生物碱、类黄酮、脂肪酸、挥发油、多糖等。药理试验研究表明,酸枣仁提取物和纯化的化合物都具有良好的生物活性,特别是镇静催眠的作用[2-3]。
作为种子类药材,酸枣仁含有丰富的天然蛋白质资源,蛋白含量占27%以上。酸枣仁蛋白含有18种常见氨基酸,人体必需氨基酸含量占总氨基酸的23.60%,其中色氨酸含量最丰富,非必需氨基酸中谷氨酸含量最高,占总氨基酸的30.95%,表明酸枣仁蛋白是一种开发潜力很高的优质蛋白[4-5]。对于酸枣仁组分蛋白的研究尚未报道,表明对于酸枣仁蛋白质资源并未充分利用,因此,验证和探讨酸枣仁蛋白质的结构组成,能够更有效合理利用酸枣仁资源,提高产业价值。
试验以酸枣仁脱脂粉为原料,以不同组分蛋白的提取率为考察指标,通过比较不同蛋白提取条件,确定各组分蛋白的最佳提取工艺,对所得的组分蛋白进行亚基组成分析,为酸枣仁药材在药食同源的应用提供依据。
1 材料与方法
1.1 试验材料
不同批次酸枣仁样品(长春中医药大学附属医院)。
1.2 试验试剂
考马斯亮蓝G-250、牛血清蛋白、甘油、十二烷基硫酸钠、巯基乙醇、溴酚蓝、丙烯酰胺、APS、Tris、氨基乙酸、低分子量蛋白质Marker(北京索莱宝科技有限公司);石油醚、无水乙醇、氯化钠、氢氧化钠、三氯乙酸、磷酸、尿素、甲醇等(均为分析级试剂)。
1.3 设备与仪器
Sigma微型离心机(德国Sigma有限公司);UV-1700紫外分光光度计[日本岛津(中国)有限公司];电子分析天平[梅特勒-托利多国际贸易(上海)有限公司];HH-6数显恒温水浴锅(金坛市佳美仪器有限公司);Mini-PROTEAN Tetra电泳仪(美国Bio-Rad公司);低温离心机(美国贝克曼库尔特有限公司);SCIENTZ-50F冷冻干燥机(宁波新芝冻干设备股份有限公司)。
1.4 脱脂酸枣仁粉制备
将酸枣仁进行粉碎,过四号筛,得酸枣仁粉。将所得酸枣仁粉按照料液比1∶5(g/mL)加入石油醚,在室温下搅拌12 h,以5000 r/min离心10 min,收集沉淀,重复操作1次,将所得沉淀置于通风橱内,待石油醚挥发干净后,将脱脂粉收集备用。
1.5 酸枣仁蛋白分级提取
采用Osborne分级分离方法[6]对酸枣仁蛋白进行分离。
1.5.1 清蛋白提取
取一定量脱脂酸枣仁粉,按照料液比1∶10(g/mL)加入蒸馏水,在25,35,45和55 ℃温度条件下分别搅拌1,2,3和4 h,以70000 r/min离心10 min,取上清液,透析,冷冻干燥。
1.5.2 球蛋白的提取
将清蛋白提取后的沉淀,按照料液比1∶10(g/mL),加入1%,2%,3%,4%,5%和6% NaCl溶液,分别搅拌1,2,3和4 h,离心后取上清液,即为球蛋白溶液,透析,冷冻干燥。
1.5.3 醇溶蛋白的提取
将球蛋白提取后的沉淀,按照料液比1∶10(g/mL),加入50%,60%,70%和80%乙醇溶液,分别搅拌1,2,3和4 h,离心后取上清液,即为醇溶蛋白溶液,透析,冷冻干燥。
1.5.4 谷蛋白的提取
将醇溶蛋白提取后的沉淀,按料液比1∶10(g/mL),加入0.01,0.05,0.10和0.15 mol/L的NaOH溶液,分别搅拌1,2,3和4 h,离心后取上清液,即为谷蛋白溶液,透析,冷冻干燥。
1.6 蛋白溶液浓度测定
采用考马斯亮蓝比色法[7]测定。
1.7 组分蛋白提取率及化学组成分析
1.7.1 各组分蛋白提取率计算
对最佳提取工艺下获得的酸枣仁组分蛋白进行蛋白定量测定,结果见表2。
1.7.2 各组分蛋白化学组成分析
对最佳提取工艺下获得的酸枣仁组分蛋白进行化学组成分析。水分的测定参照GB 5009.3—2016《食品中水分的测定》的直接干燥法;蛋白的测定参照GB 5009.5—2016《食品中蛋白质的测定》的凯氏定氮法;脂肪的测定参照GB/T 5009.6—2006《食品中脂肪的测定》的索式抽提法;灰分的测定参照GB 5009.4—2016《食品中灰分的测定》的质量法。
1.8 酸枣仁蛋白组分SDA-PAGE电泳
参考Laemmli[8]的方法。将冷冻干燥的组分蛋白粉与上样缓冲液,按1∶1的比例混合。将混合物置于沸水中加热3~5 min,待温度降至室温后,进行上样。浓缩胶浓度5%,分离胶浓度10%,样品上样量10 μL。恒压电泳,浓缩胶电压70 V,时间30 min,分离胶电压140 V,时间60 min。电泳结束后,采用考马斯亮蓝(R250)染色30 min,脱色后,Invitrogen iBright FL 1000(美国赛默飞世尔科学公司)扫描成像。
1.9 统计分析
所有试验都重复3次后取平均值,试验数据为平均值±标准差,采用Origin 9.0 软件作图。
2 结果与分析
2.1 酸枣仁蛋白脱脂工艺的考察
对不同批次酸枣仁药材进行粉碎后,对石油醚脱脂效率进行考察(表1),结果表明,酸枣仁药材脱脂效率稳定,但小于索氏提取法[9],由于操作简便、脱脂量大,以石油醚为脱脂溶剂可回收再利用,因此更适用于工业生产。

表1 不同批次酸枣仁粉石油醚脱脂效率考察
2.2 单因素考察结果
2.2.1 不同温度对酸枣仁清蛋白提取的影响
由图1可知,随着提取时间增加,清蛋白提取率逐渐增长,在45 ℃条件下提取率达到最大值。温度是影响蛋白质溶解度的主要物理因素之一,在一定温度范围内,蛋白质的溶解度随着温度增加而增大,其主要原因是温度能够使蛋白质空间结构发生改变,发生变性反应,蛋白质分子结构展开,分散性增加,有利于酸枣仁清蛋白质溶出,提高提取效率[10-12]。但在55 ℃条件下,酸枣仁清蛋白的提取率随提取时间增加呈下降趋势,表明提取温度过高会破坏蛋白的主要结构,会导致蛋白质变性沉淀。

图1 不同温度对酸枣仁清蛋白浓度的影响
2.2.2 不同NaCl溶液浓度对酸枣仁球蛋白提取的影响
由图2可知,在NaCl浓度1%~6%范围内,随着NaCL浓度增加,酸枣仁球蛋白随着时间增加提取率逐渐增大;NaCl浓度5%时,蛋白提取率最高。盐浓度继续增加到6%时,蛋白质提取率随着时间增长有所降低。原因主要是溶液中的盐离子会影响蛋白质分子之间的静电吸引和排斥相互作用,在低浓度盐溶液中,由于盐溶效应,离子强度增加,蛋白质分子与水分子之间的相互作用增强,蛋白质的溶解度会增加,但浓度达到一定水平时,带电蛋白质分子表面电荷逐渐减少,导致分子间排斥相互作用会随着溶液离子强度增加而降低[13-14]。
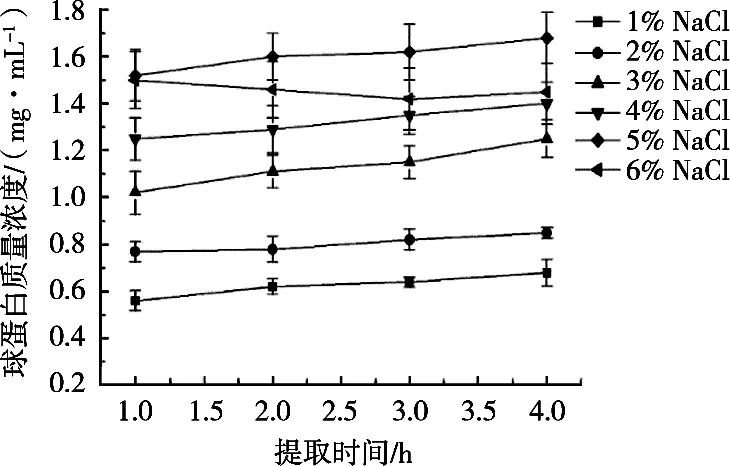
图2 不同NaCl溶液浓度对酸枣仁球蛋白浓度的影响
2.2.3 不同乙醇溶液体积分数对酸枣仁醇溶蛋白提取的影响
有机溶剂能够改变蛋白质的疏水作用、氢键和静电相互作用的稳定性,极易引起蛋白质变性沉淀,主要是由于有机溶剂能够降低水的介电常数,导致蛋白质之间的静电斥力降低。醇溶蛋白结构较为特殊,含有大量疏水性氨基酸和含硫氨基酸,使其具有独特的结构和功能特性,如良好的成膜性、弹性和疏水性等[15]。由图3可知,随着提取时间增加,醇溶蛋白质提取率多呈增大趋势。随着乙醇体积分数提高,醇溶蛋白提取率增加,乙醇体积分数70%时,醇溶蛋白提取率达到最大值,表明此时酸枣仁醇溶蛋白与醇溶液之间的相互作用到达稳定状态,乙醇溶液体积分数80%时,随着提取时间增加,蛋白发生变性导致沉淀,溶解度降低。
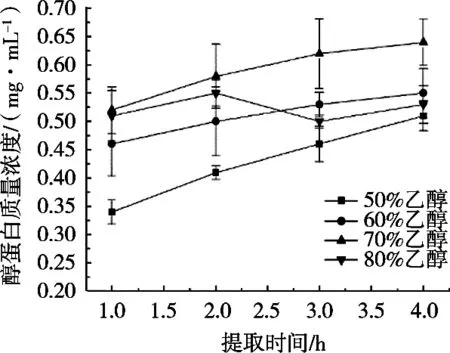
图3 不同乙醇溶液体积分数对酸枣仁醇溶蛋白浓度的影响
2.2.4 不同NaOH溶液浓度对谷蛋白提取的影响
由图4可知,随着NaOH浓度逐渐增加,谷蛋白提取率逐渐增加。NaOH浓度0.1 mol/L时,谷蛋白提取率达到最大值。在碱性环境下,随碱溶液浓度增高,蛋白空间结构会发生改变,二硫键发生断裂,导致疏水性降低,从而增加蛋白质溶解度。
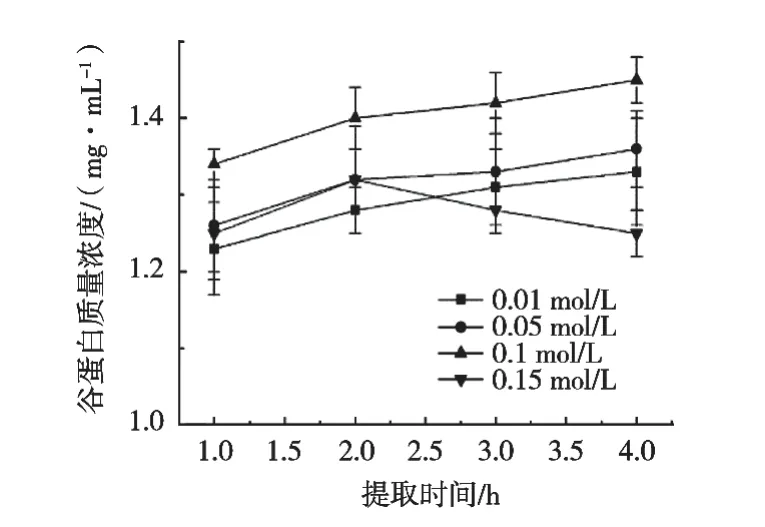
图4 不同NaOH溶液浓度对酸枣仁谷蛋白浓度的影响
2.3 组分蛋白提取率及化学组成分析
对酸枣仁脱脂粉及提取冻干后的蛋白粉末进行化学组成分析,结果如表2所示。酸枣仁脱脂粉中最主要的成分是蛋白质,达到55.17%。采用最佳提取工艺提取的组分蛋白,其蛋白提取率分别为清蛋白13.24%、球蛋白22.25%、醇溶蛋白1.35%、谷蛋白13.57%,且4种酸枣仁组分蛋白的蛋白质量分数均在80%以上,其中球蛋白质量分数最高,达到88.69%;酸枣仁蛋白的粗脂肪质量分数均低于2%,其中球蛋白的粗脂肪质量分数低至0.72%,说明该方法能较为有效地分离蛋白质和其他杂质;清蛋白、球蛋白、醇溶蛋白和谷蛋白的灰分分别为1.89%,1.21%,1.05%和1.45%,表明经过透析后,蛋白提取液中的盐离子能较大程度地被除去。化学组成分析结果表明四步分离法能对酸枣仁蛋白进行初步分离提纯,得到纯度较高的酸枣仁蛋白各组分。

表2 酸枣仁组分蛋白化学组成的比较 单位:%
2.4 酸枣仁蛋白组分电泳分析
由图5和图6可知,在不同温度条件下酸枣仁清蛋白亚基组成有较大区别。在45 ℃条件下,亚基条带较多,说明此条件下对清蛋白的各亚基组分均有较好的提取率。清蛋白的亚基分布在相对分子质量1~55 kDa。此外,添加β-巯基乙醇后,清蛋白的亚基条带增多,说明清蛋白含有二硫键。在不同盐浓度条件下,提取所得酸枣仁球蛋白在电泳图谱中均呈现相同的亚基条带,这说明盐浓度对球蛋白的提取率有较大影响,但对亚基组成的影响较小,相对分子质量主要分布在10~25 kDa。由于β-巯基乙醇添加前后,球蛋白亚基条带有较大变化,推测球蛋白中也含有二硫键。在质量分数5% NaCl溶液中,球蛋白提取率最高,出现的条带颜色深。图5中分布在相对分子质量35 kDa左右的球蛋白亚基,在还原剂的存在下,二硫键断裂,迁移率变大,大部分分布在14~25 kDa之间。在不同醇浓度条件下,未见醇溶蛋白条带,还原前后的电泳条带也未有变化,表明醇溶蛋白较少,或者醇溶蛋白未能进入分离胶中。酸枣仁谷蛋白亚基主要分布于15~55 kDa,碱浓度对酸枣仁谷蛋白亚基组成有较大影响,浓度0.1 mol/L时条带明显。图6中分布在相对分子质量25~55 kDa的谷蛋白亚基,在还原剂存在下,二硫键断裂,迁移率变大,大部分分布在15~25 kDa。通过比较图5与图6,谷蛋白在25~55 kDa的亚基可能是通过二硫键交联形成的。

图5 还原性酸枣仁组分蛋白SDS-PAGE结果
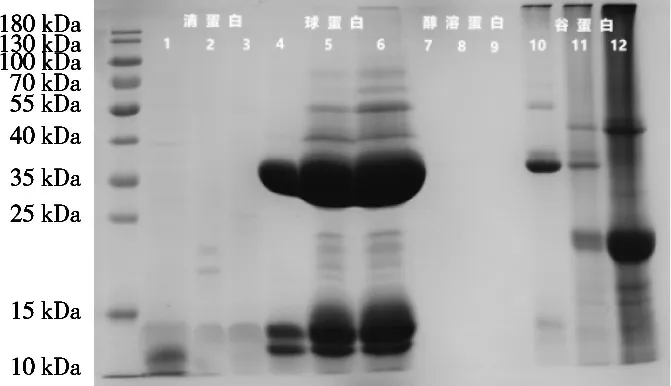
图6 非还原性酸枣仁组分蛋白SDS-PAGE结果
3 结论
基于Osborne分级提取法对酸枣仁组分蛋白进行分级提取,通过单因素考察对各提取影响因素进行优化,优化后确定各组分蛋白最佳提取工艺条件:清蛋白提取最佳温度为45 ℃,球蛋白提取最佳盐浓度为5%,醇溶蛋白提取的最佳醇浓度为70%,谷蛋白提取最佳碱浓度为0.1 mol/L;针对最佳工艺获得的组分蛋白,其蛋白提取率的大小为球蛋白>谷蛋白>清蛋白>醇溶蛋白,化学组成分析表明各组分蛋白质量分数均在80%以上,表明此提取方法是准确可行的。酸枣仁清蛋白和球蛋白的亚基主要分布在相对分子质量10~55 kDa,分布在25~55 kDa的清蛋白、球蛋白和谷蛋白亚基可能是通过二硫键作用形成的。酸枣仁醇溶蛋白可能是大分子蛋白,还原性与非还原性电泳未检测到其明显条带。此外,清蛋白包含酸枣仁蛋白中的大部分亚基,从营养学角度分析,其营养更为均衡。综上所述,不同提取条件对酸枣仁蛋白的提取率有较大影响,且在一定程度上影响蛋白亚基组成。

