花椒残渣中黄酮类成分的提取工艺及其抗氧化活性
额尔敦巴雅尔,扈宁轩,邓雅文,云雪艳,董同力嘎
内蒙古农业大学食品科学与工程学院(呼和浩特 010018)
花椒(Zanthoxylum bungeanum)原产于中国平原和海拔较高的山地[1],因含有丰富的挥发性物质而具有特殊香气。近年来,黄酮物质因具有广泛的药理作用而备受关注,以抗氧化活性尤为突出,并且在降低胆固醇、抑制炎症物质流出、抑制癌细胞产生方面具有突出功效[2]。花椒也由于较高的经济价值而不断扩大种植面积,但中国对花椒中黄酮物质的研究相对不足,对提取物的系统性研究也比较欠缺[3]。因此,从花椒黄酮提取物的提取工艺、纯化工艺、提取物定性分析及体外抗氧化活性4个方面展开,为该物质的环保工业化提取及体外活性研究提供参考依据,对中国花椒产品的开发利用具有重要意义。
1 材料与方法
1.1 材料与试剂
花椒残渣(洗净后烘干备用,四川汉源);芦丁(≥98%,上海顺勃有限公司);D101大孔吸附树脂(南开大学化工厂);无水乙醇、石油醚(30~60 ℃)、亚硝酸钠、硝酸铝、氢氧化钠(均为分析纯);乙腈、异丙醇、甲酸(均为质谱纯)。
1.2 仪器与设备
高效液相色谱仪Agilent 1100系列(美国Agilent公司);Agilent Poroshell 120 SBC18色谱柱(4.6 mm×150 mm,2.7 μm,美国Agilent公司);Waters Acquity UPLC液相色谱仪(美国Waters公司);Synapt G2-S Q-TOF质谱仪(配有Empower 3.0工作站和MassLynxV 4.1分析软件,美国Waters公司)。
1.3 溶剂法提取花椒渣中的黄酮
1.3.1 标准曲线的绘制
参考谢宗波等[4]的方法,配制0.1 mg/mL芦丁标准溶液,于20 mL比色管依次加入芦丁标准溶液、5%亚硝酸钠溶液、10%硝酸铝溶液和5%氢氧化钠溶液,用30%甲醇稀释至比色管刻度,分别配制为0,0.01,0.02,0.03,0.04和0.05 mg/mL的标准品,摇匀放置15 min后测定其在508 nm下吸光度。
1.3.2 单因素试验设计
将溶剂体积分数、提取温度、料液比和提取时间作为变量设置4个单因素试验,产物过滤后得到花椒渣黄酮粗提物,分别测得花椒渣黄酮得率作为评价指标。
4个单因素试验依次确定工艺参数。分别测定甲醇体积分数40%,50%,60%,70%和80%时的花椒渣黄酮得率。选择最佳体积分数甲醇作为萃取溶剂,分别测定提取温度15,25,35,45和55 ℃这5个温度下的花椒渣黄酮得率。保持上述溶剂浓度,选择最佳提取温度,分别测定料液比1∶4,1∶6,1∶8,1∶10和1∶12(g/mL)时的花椒渣黄酮得率。在试验得出的最佳条件下,分别测定提取静置时长2,3,4,5,6和7 h时的花椒渣黄酮得率,得出最优组合的工艺参数。
1.3.3 黄酮得率的测定
取3.0 mL粗提液置于10 mL比色管中,按1.3.1中提到的方法显色,以试剂空白作为对照测定其508 nm处吸光度,由标准芦丁曲线按式(1)计算出黄酮得率。

式中:C为样液的质量浓度,mg/mL;V为样液的体积,mL;W为花椒残渣质量,g。
1.3.4 黄酮纯度的测定
称取10.0 g干燥的花椒渣粉末,萃取后除去溶剂甲醇,旋转蒸发浓缩后用烘箱干燥得到黄酮粉末。用30%甲醇溶解20 mg花椒残渣黄酮粉末定容至400 mL,取6.0 mL该溶液移入20 mL比色管中,按照1.3.1的方法进行显色,以试剂空白作为对照测定其508 nm处的吸光度。由标准芦丁曲线计算提取液质量浓度C,并按式(2)计算花椒残渣黄酮纯度。

式中:C为提取液质量浓度,mg/mL;V为提取液体积,mL;W为黄酮粉末质量,mg。
1.4 花椒渣黄酮的定性分析
1.4.1 样品液的制备
取10~20 mg样品,以甲醇∶水∶甲酸比例1∶1∶0.5%的超声条件溶解,以12000 r/min 离心后,取上清液,经0.22 μm微孔滤膜过滤,即得样品液。
1.4.2 UPLC-Q-TOF-MS/MS分析条件
质谱条件:电喷雾电离(ESI)离子源,质量扫描范围是m/z50~1200,毛细管电压3 kV(负离子模式),样品锥电压40 V,提取锥电压4 V,源温110 ℃,脱溶剂气温度300 ℃,脱溶剂气流速度700 L/h,质量扫描范围m/z200~2000。
液相色谱分析条件:Agilent Poroshell 120 SBC18色谱柱(4.6 mm×150 mm,2.7 μm);流动相,A相为乙腈,B相为0.5%甲酸水溶液;梯度洗脱程序:0~35 min,60%~84% A,35~114 min,84%~100% A,114~120 min,100%~60% A;流速0.2 mL/min;柱温40 ℃;进样量10 μL。
1.5 体外活性评价
1.5.1 样品液的制备
花椒总黄酮粗提物的制备:粉碎花椒后准确称取2.0 g粉末,用石油醚脱脂处理1 h。以70%甲醇作为溶剂,料液比1∶8(g/mL),室温下浸提4 h,烘干得到粗提物粉末。
花椒总黄酮纯化样的制备:上述粗提物通过D101型的大孔树脂的纯化。纯化控制条件:样品液质量浓度1.0 mg/mL,pH 4.0,以70%甲醇作为洗脱剂,用量3 BV,放入烘干箱烘干得到纯化样粉末。
1.5.2 DPPH自由基清除能力测定
试验参考张宇思等[5]提到的方法并稍作改动。用甲醇将50 mg DPPH定容至250 mL容量瓶中,得到5×10-4mol/L DPPH溶液。以甲醇分别溶解花椒及花椒残渣总黄酮粗提物、精制花椒及精制花椒残渣总黄酮、BHT及VC,获得质量浓度0.01,0.02,0.04,0.08,0.12,0.16和0.20 mg/mL的7组溶液。在这7组溶液中分别加入1.0 mL 5×10-4mol/L DPPH,添加甲醇至5 mL。室温静置30 min后测定517 nm处的吸光度。根据式(3)计算样品的DPPH自由基清除率。
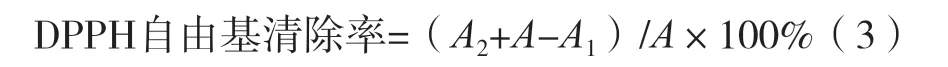
式中:A为不加样的DPPH溶液(2.0 mL DPPH+2.0 mL甲醇)的吸光度;A1为样品和DPPH混合后吸光度;A2为不加DPPH的样液(样品2.0 mL+2.0 mL甲醇)吸光度。
1.5.3 还原力的测定
试验参考Oyaizu[6]和Amarowicz等[7]的方法并稍作改动。以70%甲醇为溶剂,配成质量浓度0.20~0.50 mg/mL的样品液。各取3 mL样液于10支20 mL试管中,分别加入3 mL的0.01 g/mL铁氰化钾,混匀后在50 ℃水浴中保持30 min。加入3 mL 0.1 g/mL三氯乙酸,混合并以3000 r/min离心15 min。取3 mL上清液加入3 mL蒸馏水和1 mL 0.1 g/100 mL氯化铁,混合静置15 min后测700 nm处的吸光度,所有测定值取平均值3倍。
1.5.4 抑制脂质过氧化活性的测定
试验参考任红荣等[8]的方法。用30 mL 10 mmol/L PBS(pH 7.4)溶解200 mg卵磷脂,冰浴振荡混匀。取0.5 mL该液体,加入1.0 mL PBS(pH 7.4)、质量浓度样液1.0 mL,以及1 mL 2.5 mmol/L EDTA-Fe(Ⅱ),混匀后于37 ℃水浴反应45 min,加2.0 mL 0.28 g/mL三氯乙酸及1.0 mL 0.01 g/mL硫代巴比妥酸,摇匀静置5 min,100 ℃恒温水浴锅中加热10 min,冷却后测各样品在532 nm处的吸光度。每3个平行样计算1次平均值。按式(4)计算脂质过氧化抑制效率。

式中:A0为不含样品的吸光度;A1为含样品的吸光度。
1.5.5 测定总抗氧化能力
按照南京建城生物工程学院TAC测量试剂盒的说明进行试验。在37 ℃时,萃取液每分钟使反应体系中的吸光度增加0.01~1 TAC单位(IU),以IU/mL表示。测量花椒残渣总黄酮总抗氧化能力为IU/mg,并做3次重复以获所需数据平均数值,将抗坏血酸(VC)为阳性对照。
2 结果与分析
2.1 芦丁标准曲线
按照1.3.1中的方法,用最小二乘法得到关于芦丁质量浓度C和吸光度A的线性回归曲线图,由图1可以看出,标准品的质量浓度C在一定范围内与吸光度A呈现较好线性相关。

图1 芦丁标准曲线图
2.2 工艺参数的确定
2.2.1 甲醇溶液体积分数
由图2可以看出,甲醇溶液体积分数40%~80%时,花椒残渣的黄酮得率随着甲醇溶液体积分数增加而出现逐渐升高趋势,并在甲醇溶液体积分数70%时达到最大值。随着甲醇溶液体积分数继续增加,曲线缓慢下降,这是由于溶剂体积分数过高,导致蛋白质凝固变性,抑制提取过程。所以甲醇溶液体积分数选择70%。

图2 甲醇体积分数对花椒残渣黄酮得率的影响
2.2.2 提取温度
由图3看出,提取温度15~55 ℃时,提取黄酮类物质得率随着提取温度升高呈现先上升后缓慢下降趋势,可能是由于低温下体系的扩散系数比较小,影响提取效率;随着温度逐渐升高,黄酮可能存在一定氧化损失。提取温度25 ℃时所对应的黄酮得率最高,因此提取温度选择25 ℃。

图3 提取温度对花椒残渣黄酮得率的影响
2.2.3 料液比
由图4可以看出,料液比达到一定数值后,溶出物质的能力就达到饱和,曲线呈现一种趋于平衡状态。因此为避免溶剂浪费,提取料液比选择1∶8(g/mL)。

图4 料液比对于花椒残渣黄酮得率的影响
2.2.4 浸提时间
由图5可以看出,静置时间2~7 h时,黄酮得率随着提取时间增加在5 h达到最大值,而后开始下降。这是因为提取时间过长,提取液被氧化,以及放置时间过久而滋生细菌,其中的黄酮类物质被微生物分解和利用。因此,浸提时间选择5 h。

图5 浸提时间对于花椒残渣黄酮得率的影响
综上所述,温度为室温25 ℃时,溶剂法提取花椒残渣中黄酮最优工艺条件为甲醇体积分数70%,料液比1∶8(g/mL),浸提静置时间5 h。在此条件下,花椒残渣黄酮得率为7.65%,干燥后的粗黄酮粉纯度为23.4%。
2.3 花椒渣黄酮的定性分析
试验使用正离子模式,结合黄酮物质谱特征碎片(分别为m/z191,m/z289,m/z353,m/z431,m/z447和m/z463),并根据数据库筛查,对提取的黄酮样液中8种物质进行分析鉴定,见表1。花椒残渣黄酮总离子流色谱图见图6。
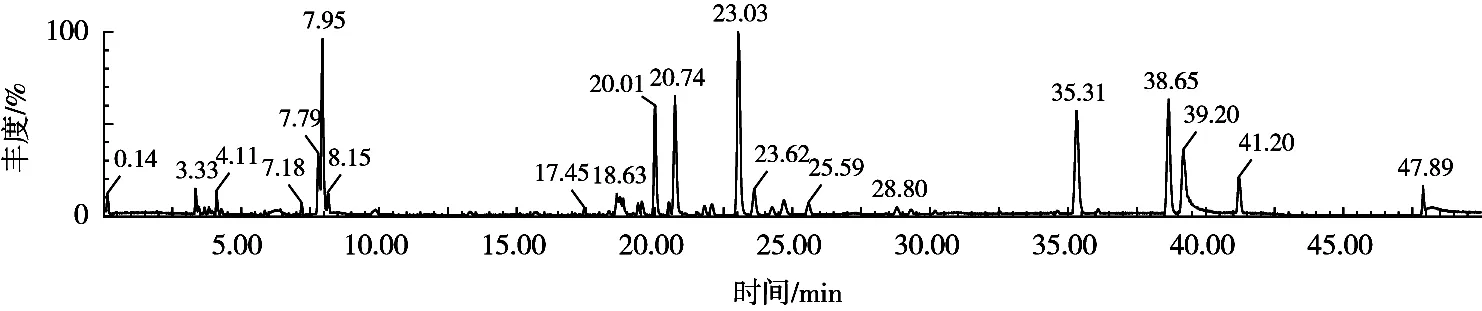
图6 花椒残渣黄酮总离子流色谱图
试验利用UPLC-Q-TOF-MS技术对纯化后的花椒残渣黄酮进行分析[8],纯化精制后的花椒残渣黄酮中主要含有8种物质,通过UV光谱定性后,质谱鉴定结果见表1。其中,山茶黄酮苷A、3’, 5, 7-三羟基-4’-甲氧基黄酮7芸香苷、Lethedioside A和山奈酚-3-芸香糖苷是首次在花椒残渣中发现的。

表1 花椒残渣黄酮的质谱分析结果
2.4 花椒渣黄酮的体外活性测定
2.4.1 DPPH自由基的清除能力
花椒残渣总黄酮对DPPH自由基的清除效果见图7。在质量浓度较低范围内曲线不断上升,清除率增长。VC质量浓度达到0.08 mg/mL后曲线上升缓慢,清除率基本保持不变。花椒残渣纯化样质量浓度0~0.20 mg/mL范围之内,各组清除能力随浓度增加而不断增强。花椒残渣总黄酮纯化样对DPPH自由基清除能力显著强于其他组。花椒残渣纯化样质量浓度0.20 mg/mL时清除率达89%,仅低于同质量浓度下清除率93.1%的VC。

图7 花椒残渣总黄酮的DPPH自由基清除能力
2.4.2 花椒渣总黄酮还原力的测定
一种物质潜在的抗氧化性能与还原能力有着较为密切的联系。由图8可知,在质量浓度0~0.40 mg/mL,各组还原能力均随着其浓度升高而增强,但幅度不同。花椒残渣总黄酮纯化样的还原力比BHT强,更高于其他提取物,但弱于VC。

图8 花椒残渣总黄酮的还原力
2.4.3 花椒渣总黄酮抗脂质过氧化的能力
由图9可知,花椒残渣纯化总黄酮对Fe2+诱导的卵磷脂脂质体外过氧化具有抑制作用;而花椒残渣未纯化总黄酮、花椒纯化总黄酮和花椒未纯化总黄酮的抑制率低于BHT,证明花椒残渣纯化总黄酮具有较强的抗脂质氧化能力。

图9 花椒残渣总黄酮抗脂质过氧化能力
2.4.4 花椒渣总黄酮的总抗氧化能力
从图10能看出4种提取样的总抗氧化能力均随其质量浓度增加而不断增强,这与抗坏血酸的抗氧化活性走向相同。
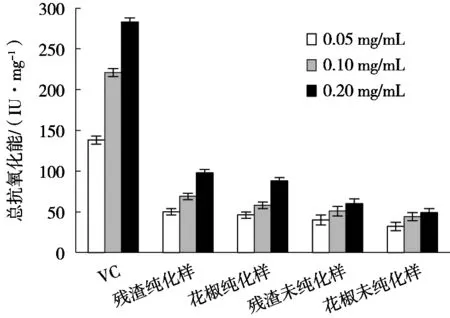
图10 花椒残渣总黄酮与VC的总抗氧化能力图
经过计算得出各组质量浓度0.10 mg/mL时的总抗氧化能力:残渣纯化样72.1 IU/mg,残渣未纯化样34.3 IU/mg,花椒纯化样65.4 IU/mg,花椒未纯化样31.4 U/mg,VC总抗氧化力强于各提取样。
经过体外抗氧化试验对花椒残渣总黄酮的DPPH自由基清除能力、还原力、抗脂质氧化能力和总抗氧化性能的研究,不难看出,残渣中的总黄酮在清除羟自由基和抑制脂质抗氧化的方面优于合成的传统抗氧化剂,可以确定该物质具有较强抗氧化活性。
3 结论
花椒残渣中的黄酮没有明显的毒副作用,具有作为天然抗氧化剂用于食品加工的潜力。通过4个单因素试验,确定溶剂法提取花椒残渣中黄酮的最佳温度为25 ℃、甲醇体积分数为70%,料液比为1∶8(g/mL)、浸提时间为5 h。在此条件下,花椒残渣总黄酮的得率达7.65%,花椒残渣总黄酮干燥后的纯度为23.4%。
采用UPLC-Q-TOF-MS技术对花椒残渣中的黄酮进行定性分析,共鉴定出8种化合物,其中山茶黄酮苷A、3’, 5, 7-三羟基-4’-甲氧基黄酮7芸香苷、Lethedioside A和山奈酚-3-芸香糖苷是首次在花椒残渣中发现的。试验结果可为开发花椒残渣中黄酮类全系列有效成分提供理论数据。
由体外试验得知,花椒残渣纯化总黄酮的DPPH自由基清除效果强于同质量浓度的抗氧化剂BHT,但略微弱于VC;其还原力弱于VC,但高于同质量浓度下BHT,其过氧化抑制率也高于BHT。此外,花椒残渣总黄酮纯化样的总抗氧化能力高于花椒总黄酮纯化样。

