内镜黏膜下挖出术对胃黏膜下肿瘤患者的临床价值分析
刘倩怡,刘智尚,李杰峰,黎嘉妍
中山市人民医院消化内科,广东中山 528400
胃黏膜下肿瘤主要包括脂肪瘤、间质瘤、神经源性肿瘤以及胃平滑肌瘤等,良性肿瘤居多,近年来,随着超声内镜、胃十二指肠镜等的普及,胃黏膜下肿瘤检出率也不断升高,患者预后理想。当前,黏膜下肿瘤切除手术包括内镜下手术、腹腔镜手术以及开腹手术等。传统的开腹性手术可以彻底摘除黏膜下肿瘤,具有较高的有效性及安全性,且对黏膜下肿瘤部位以及大小等没有要求,被广为应用,但是伴随手术技术的发展的逐步深入,不少学者发现,传统的开腹手术创口较大、术中容易损伤或切除正常的非病变组织,会导致胃部形态的改变及瘢痕形成,不利于患者的后续恢复,且当肿瘤部位靠近贲门或幽门部位,较大的手术切除范围,会导致贲门和幽门部位的切除,使得正常的胃部功能无法保留。同时,由于胃粘膜下肿瘤生长在胃的内部,腹腔镜下手术在视野暴露及手术指征方面具有较大的局限性。此次研究纳入胃黏膜下肿瘤患者76例,均自2018年3月—2019年8月于该院接受诊疗,探讨患者应用内镜下治疗的效果。现报道如下。
1 资料与方法
1.1 一般资料
方便抽取胃黏膜下肿瘤患者76例,将其随机分为两组,研究组(n=38)男23例,女15例;平均年龄(54.34±10.39)岁。参考组(n=38)男22例,女16例;平均年龄(55.01±10.23)岁。两组患者临床资料经对比,差异无统计学意义(P>0.05),具有可比性。纳入标准:经胃镜检查确诊;具备自主认知功能并自愿参与该研究,并通过医院伦理委员会的批准。排除标准:肿瘤局部浸润周围脏器者;肿瘤远处转移或者淋巴结转移者;有麻醉禁忌证或者手术切除禁忌证[1]。
1.2 方法
研究组患者实施内镜黏膜下挖出术,将内镜经口进入患者上消化道内并确定具体病变部位,应用Dual刀沿病灶周围对病变部位进行标记,将甘油果糖及靛胭脂混合液注入黏膜下,应用Dual刀炎标记点对病灶进行纵行切开或者环形切开,紧贴病灶周围对血管及组织进行剥离,防止瘤体包膜受损,且不能剥除过多组织,确保瘤体的完整性,根据患者实际及情况决定是否需要将表面黏膜切除以使黏膜下瘤体组织得到彻底显露。若出现血管暴露、搏动性血管或者创面渗血现象需要实施电凝止血,对创面进行荷包缝合或者钛夹缝合,将肿块取出后送病理检查[2]。
参考组患者实施内镜消化道全层切除术,对病变部位进行标记并行黏膜下注射,将黏膜切开并应用IT刀或者Dual刀对病灶周围血管及组织进行剥离,避免瘤体受损,同时还需要采用电凝联合钛夹止血以保证视野清晰。若瘤体与浆膜层紧贴或者瘤体向腔外生长需要切除浆膜层及固有肌层,然后将瘤体完整切除。应用钛夹封闭较小出血创面,应用钛夹以及尼龙绳缝合较大创面,将肿块取出后送病理检查[3]。
术后2~3 d不可进食,逐渐向流食及半流食过渡并为患者提供质子泵抑制剂以及抗生素,观察患者是否存在发热、腹胀、黑便等反应,若出现穿孔现象需要延迟进食[4]。
1.3 观察指标
1.3.1手术相关指标比较两组患者手术时间、抗生素应用时间、禁食时间以及术后住院时间。
1.3.2围手术期并发症发生情况比较两组患者术后7 d内穿孔、瘘管形成、出血等并发症情况及总发生率。
1.3.3术后随访情况对两组患者进行为期6个月的术后随访,术后4周要求患者返院复查胃镜,观察手术创面愈合情况,随后通过电话或返院复查的形式对患者进行随访,频率为每月1次,关注患者创面愈合、肿瘤的复发与转移等。
1.4 统计方法
采用SPSS 19.0统计学软件进行数据分析,计量资料的表达方式为(±s),采用t检验,计数资料的表达方式为[n(%)],采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者手术相关指标比较
与参考组患者相比,研究组手术时间、抗生素应用时间等相关指标均明显更短,差异有统计学意义(P<0.05)。见表1。
表1 两组患者手术相关指标比较(±s)

表1 两组患者手术相关指标比较(±s)
组别手术时间(min)抗生素应用时间(d)禁食时间(d)术后住院时间(d)研究组(n=38)参考组(n=38)t值P值65.42±10.28 77.82±10.35 5.240<0.05 2.15±0.89 3.36±0.90 5.893<0.05 3.79±0.32 4.84±0.28 15.220<0.05 6.45±1.34 8.57±1.32 6.948<0.05
2.2 两组患者围手术期并发症发生情况比较
研究组中,1例在术中发生穿孔、1例在术后1周内出现出血,主要表现为黑便、1例在术后1周内出现切口感染,并发症的总发生率为7.89%,低于参考组并发症总发生率为21.05%,差异有统计学意义(P<0.05)。见表2。
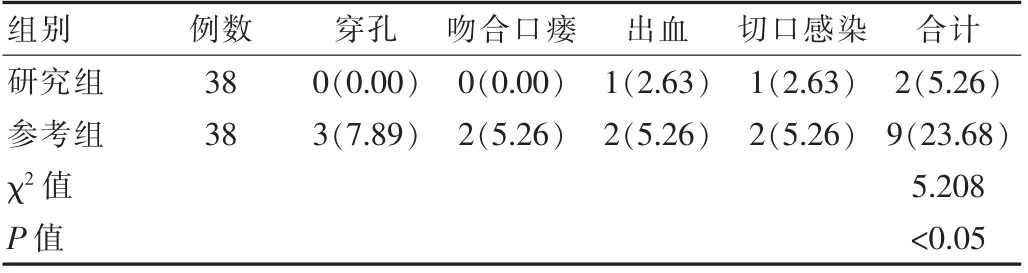
表2 两组患者围手术期并发症发生情况比较[n(%)]
2.3 两组术后随访情况
对两组患者进行为期6个月的术后随访工作,术后4周复查胃镜创口皆愈合良好,且未发现肿瘤复发及转移情况。
3 讨论
胃黏膜下肿瘤,多是间质瘤。间质瘤主要表现形式为边界清晰,呈局限性、膨胀性生长,偶尔也可见假包膜,瘤体呈结节状或分叶状,通常质地较均匀。若是体积较大,可并发出血、坏死,甚至引发大出血,患者发病后若得不到及时、有效的治疗会严重降低其生活质量,甚至对患者生命产生极大威胁。间质瘤属于间叶源性肿瘤,患者可通过胃镜检查发现,可向肝脏、腹部转移,患者应及时做病理检查、免疫组化明确诊断。因此,疾病发生的早期阶段需及时实施手术治疗,并根据疾病危险度,确定是否需要进行放、化疗及靶向治疗。在胃黏膜下层生长且被黏膜覆盖的肿瘤即为胃黏膜下肿瘤。消化道下黏膜肿瘤应尽早完全切除并送病理检查以便及早对肿瘤良恶性做出准确判断并可方便临床医生根据病理结果决定治疗方案。术后患者应调整合理的生活作息,忌食辛辣、刺激性食物,多休息,适当运动,增强自身抵抗力与免疫力。临床研究结果显示[5-7],胃黏膜肿瘤多数为良性肿瘤,一般表现为上消化道出血、上腹隐痛、不适等。切除的标本一定要送病理,做组织学检查,以免误将已恶变或本是恶性肿瘤不恰当的进行良性肿瘤处理。对于良性息肉,直径3 cm以下者,可在胃镜下电切;怀疑恶性者,应先多点活检;多发性息肉,大者可在胃镜下用圈套器电切,小息肉可采用氩离子凝固术(APC)、微波、电凝等分别灼除,并且应进行胃镜随访,腺瘤性息肉有恶变倾向,均应胃镜下切除。黏膜下肿瘤以大而无蒂居多,大多不能用圈套器切除,而需要外科手术,可在开腹或腹腔镜下行肿瘤摘除;对于直径较小者,则可在胃镜下切除;对于无症状良性肿瘤病人,可随访观察,出现症状方考虑手术。经内镜治疗消化道息肉的方法,包括高频电圈套切除、热活检钳摘除、氩气刀治疗、粘膜切除术或粘膜下剥离术等。最常用的是高频电热活检钳摘除及圈套器电凝电切术,直径不大于0.6 cm的息肉,用热活剪钳摘除最为方便。其他息肉一般都采用圈套器套切,内镜检查发现息肉后,经活检钳道送入圈套器,套住息肉蒂部或近根部,使用混合电凝切除息肉。如息肉蒂部粗大,可采用金属夹或尼龙线结扎后,高频电切除术。广基息肉可采用先在黏膜下注射适量生理盐水后切除的方法。大而广泛的息肉或腺瘤样病灶,尤其是侧向生长型肿瘤等,可选用内镜粘膜下剥离术。内镜粘膜下剥离术在治疗胃肠道早癌及癌前病变中具有一定效果,内镜粘膜下剥离术(ESD)是指在内镜下,使用高频电刀与专用器械,将胃肠道病灶(包括胃肠道早期肿瘤)与其下方正常的粘膜下层逐步剥离,以达到将病灶完整切除的目的。ESD由内镜下粘膜切除术发展而来的新技术,技术成熟,近年已逐渐成为治疗胃肠道早癌及癌前病变的有效方法,具有较高的临床价值,临床应将该方案作为研究重点并积极推广。
内镜切除能够准确定位较小的胃黏膜下肿瘤,可使胃正常组织切除量得到明显减少。内镜下黏膜下挖出术及内镜消化道全层切除术术中穿孔前将胃内气体及液体充分吸引干净,穿孔后可使送气得到明显减少,术后对穿孔进行严密缝合,有助于降低腹腔内感染风险,可同时保证手术疗效以及安全性。内镜黏膜下挖出术可将固有肌层深层肿瘤完整挖出,术中应用钛夹等进行细致止血操作,可降低穿孔以及出血率[8-9]。
该次研究中,与参考组患者相比,研究组手术时间、抗生素应用时间等相关指标均明显更短(P<0.05)。研究组穿孔等并发症总发生率为7.89%,参考组穿孔、瘘管形成等并发症总发生率为21.05%,研究组并发症发生率明显更低(P<0.05)这与范晓圆等[10]在相关研究中得出,患者给予内镜黏膜下挖出术后,临床并发症发生率为6.94%明显低于内镜下的常规治疗术,与本文所得结果相近,具有临床意义。
综上所述,胃黏膜下肿瘤患者采用内镜黏膜下挖出术疗效确切,经济、安全且能够缩短患者术后康复时间。

