微生物菌剂W55修复多菌灵污染土壤研究
陈 锐,门 欣,瞿 佳,孙晓宇,赵玲侠
(陕西省微生物研究所微生物菌种资源研究中心,陕西 西安 710043)
【研究意义】多菌灵是广泛使用的氨基甲酸甲酯类杀菌剂,残留农药会进入土壤或水体。已有研究表明,残留于土壤中的多菌灵可改变土壤酶活[1],影响土壤微生物菌群结构[2],降低土壤有机碳量[3],增加铵态氮及硝态氮量,改变土壤线虫、蚯蚓等无脊椎动物数量[4],引起脊柱动物氧化应激,引起免疫反应[5],产生生殖细胞毒性及神经细胞毒性[6-7]。针对环境中多菌灵存在的潜在危害,研究学者提出利用微生物的生命代谢活动,在污染区域使用微生物菌剂,使污染物得以被吸收或分解[8-9]。在污染土壤中使用生物修复法可加速污染物的降解,恢复自然环境,降低生态及农产品安全风险[10]。【前人研究进展】国内已有报道筛选获得各类降解微生物菌株,包括芽孢杆菌(Bacillussp.)、木霉(Trichodermasp.)、假单胞菌(Pseudomonassp.)、红球菌(Rhodococcussp.)、产碱菌属(Alcaligenessp.)、罗尔斯通氏菌(Ralstoniasp.)等,摇瓶中降解能力最高可达1 g/L,效率可达99%。朱凤晓等[11]报道红平红球菌在土壤室内盆栽试验中,降解多菌灵质量浓度为200 mg/L,降解率达95.2%。在已报道的土壤试验中所使用的功能菌株部分属于条件致病菌,部分菌株存在存活时间短、使用条件苛刻等问题,难以规模化应用与开发。【本研究切入点】本研究前期从107 株多菌灵耐受菌中筛选获得1 株可高效降解多菌灵的菌株WJD-55,经HPLC 验证其在沙氏液体培养基中(含多菌灵质量浓度500 mg/L),120 h 后可降解多菌灵67%,对照降解率3%,具有显著差异(T-test,P=0.02)前期试验文献号。经形态观察及ITS 测序,鉴定该菌为致密链格孢(Alternaria compacta),回接试验验证该菌不具致病性。该菌株可产生孢子,孢子在室温条件下存活时间久,易储存,便于制剂及规模化应用。【拟解决的关键问题】为验证多菌灵降解菌WJD-55 在棚室土壤中的应用效果,进行土壤农药残留、效能菌株定殖、土壤真菌菌群变化、土壤理化指标及作物生长的观测研究。
1 材料与方法
1.1 试验材料
供试菌株为多菌灵降解菌致密链格孢(Alternaria compacta)WJD-55,用无菌生理盐水制备WJD-55 菌株孢子液(104个/mL)。麸皮稻壳固体培养基(麸皮300 g,稻壳300 g,水300 mL,豆粕 1.12 g,葡萄糖5 g,大米粉2 g,植物油5 mL,115 ℃灭菌2 h)。
1.2 试验方法
1.2.1 菌剂W55 制备 麸皮稻壳固体培养基灭菌后平摊于浅盘内,上覆4 层无菌纱布,温度降至30 ℃以下进行接种;按照1%的接种量均匀接种,上覆4 层无菌纱布,28 ℃静置培养,8 d后孢子充分形成。取出培养物后低温(<40 ℃)烘干约72 h。在粉碎机中以间歇模式进行粉碎至约0.250 mm 大小。以粉碎物∶麸皮∶高岭土=1∶5∶4 混合,搅拌均匀,获得固体粉状菌剂W55,菌剂自封袋分装,在常温条件下保存。
1.2.2 试验设计 田间试验于2020 年4 月7 日至5 月27 日在陕西省西安植物园设施实验棚室内进行。划出4 块长5 m、宽4 m 试验地,设W55菌剂对照(菌剂W55 用量400 g/m2)、W55-CA修复(菌剂W55 用量400 g/m2,多菌灵50%可湿性粉剂0.9 kg,使土壤中多菌灵质量终浓度达到约50 mg/kg)、CA 对照(多菌灵50 %可湿性粉剂0.9 kg,使土壤中多菌灵质量终浓度达到约50 mg/kg)、空白对照(CK)4 个处理。依照设计施入多菌灵及菌剂,翻耕均匀,深度约25 cm。处理后6 d 栽种观测作物金鹏1 号番茄苗,14 株/行,6 行/垄,每个地块栽种84 株。日常棚室作物田间管理,每隔7~10 d 浇水1 次,栽后35 d 搭设棚架。
1.2.3 土样采集 从施用菌剂开始作为0 天,每隔10 d 采集土样1 次,至处理后50 d 共采样6 次。5 点采样法取土,取土深度5~20 cm 合并约1.5 kg作为1 份样,每块地采集土样3 份作为平行,取样总数为72 份。每次取样后立即分成2 份,第1份取10 g 左右,置于15 mL 无菌离心管,-80 ℃冷冻保存,供土壤微生物多样性测定;余下土壤为第2 份,4 ℃保存,供土壤理化指标及土壤中残留农药含量测定。
为观测多菌灵随灌溉水向土壤下层迁移的情况,处理后第10 天起取W55-CA 修复及CA 对照地块20~40、40~60 cm 深度土壤样本,每块地取3 次合并为1 份,每隔10 d 取样1 次,至处理后40 d 结束取样,进行土壤中残留农药含量测定。
1.3 测定指标及方法
1.3.1 土壤残留多菌灵检测(1)土壤中多菌灵的提取:取待测土样自然风干,称取50 g 于100 mL 具塞三角瓶中,加入50 mL 乙酸乙酯,振荡萃取30 min,保留上层萃取液。共萃取3 次,合并滤液,真空旋转蒸发仪蒸发至干,分次加入稀盐酸(1+11)溶解吸出至20 mL 容量瓶,稀盐酸(1+11)定容,待测。
(2)0.02 mol/L 磷酸钠缓冲液(pH=6.8)配制:取磷酸二氢钠1.38 g、磷酸氢二钠1.41 g 溶于900 mL 水中,用磷酸调pH 至6.8,定容至1 L。
(3)HPLC 检测:色谱柱依利特C18柱,粒径5 µm,流动相:磷酸钠缓冲液+乙腈(80∶20),流速:1 mL/min,检测波长:286 nm,进样量:10 µL,柱温:25 ℃,测定多菌灵的残留量[11]。
1.3.2 致密格链孢WJD-55 在土壤中的定殖 分别称取W55 对照、W55-CA 处理、CA 对照土壤样本5 g,加入45 mL 无菌生理盐水,梯度稀释,涂布于含100 mg/L多菌灵的沙氏固体培养平板上,28 ℃培养 48 h,观察平板上菌落的生长。挑取10个形态不同的真菌菌落至沙氏平板进行划线纯化(当平板上的真菌菌落合计不足10 个则选取全部菌落)。待单一菌落形成后取菌体进行液氮研磨,提取基因组。使用ITS1、ITS4 引物进行序列扩增并测序鉴定,统计致密格链孢被检出的次数。
1.3.3 土壤真菌多样性监测 将保存于-80 ℃的W55-CA 处理、CA 对照及CK 3 个地块处理后0、10、20、30、40 d 的土壤样本,委托联川生物公司(Omicstudio)通过土壤微生物ITS V3-4 区高通量测序分析土壤真菌多样性变化。
1.3.4 土壤理化指标监测 将W55 对照、W55-CA 修复处理、CA 对照、CK 处理的土壤样本送至中国科学研究院水土保持研究所测定土壤含水量、含盐量、pH、NPOC、全氮、硝态氮、铵态氮、微生物氮、全磷、速效磷、速效钾、土壤团粒等土壤理化指标。
1.3.5 作物生长监测 从番茄种下第2 天起开始测定番茄苗株高及叶片大小。随机选取5 株番茄苗测定株高,随机选中段分枝5 条测量第1 叶片大小,观测叶片是否有异常色斑等病变。每隔10 d 测定1 次,至50 d 结束。
2 结果与分析
2.1 致密链格孢WJD-55 对土壤多菌灵残留量的影响
通过乙酸乙酯萃取及HPLC 测定,结果如图1 所示,初始掺入土壤的多菌灵质量浓度约42 mg/kg。处理后10 d,W55-CA 修复处理多菌灵残留质量浓度为9.27 mg/kg、残留率22%,CA对照土壤多菌灵残留质量浓度为30.20 mg/kg、残留率71%,二者具有极显著差异(T-test,P=0.001);处理后20 d,W55-CA 修复处理多菌灵残留量为0,CA 对照多菌灵残留质量浓度为11.84 mg/kg,残留率28%;处理后30 d,CA 对照多菌灵残留质量浓度为2.15 mg/kg;处理后40 d,W55-CA修复处理及CA对照多菌灵残留量均为0。

图1 表层5~20 cm 土壤多菌灵残留率Fig.1 Residue rate of carbendazim in 5-20 cm soil
在田间日常管理中需要定期给作物充分的灌溉,为了解土壤中多菌灵是否随灌溉的水分向下迁移至更深层的土壤中,对20~40、40~60 cm 两个深度的土壤进行残留多菌灵的测定。结果(表1)显示,处理后10、20 d,CA 对照20~40、40~60 cm的土壤中均检出多菌灵残留,而W55-CA 修复处理均为0,表明土壤中的多菌灵会随灌溉水向下迁移,施用修复菌剂W55 后,可迅速降解土壤中的多菌灵,有效阻止其向更深层土壤迁移。
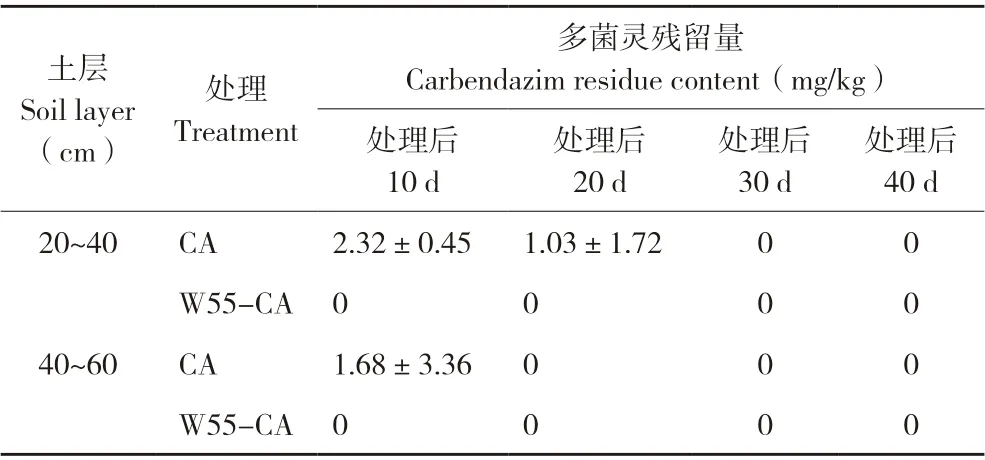
表1 深层20~40、40~60 cm 土壤中多菌灵的残留量Table 1 Residue content of carbendazim in 20-40 cm and 40-60 cm soil
2.2 致密链格孢WJD-55 在土壤中的定殖
降解菌能否在土壤中定殖决定了其在土壤中能否有效发挥作用。为观测WDJ-55 菌株在修复过程中在土壤中的定殖情况,尝试重新从土壤中分离培养可耐受多菌灵的真菌微生物,结果如图2 所示,W55-CA 修复处理的土壤真菌菌落较多,而W55 对照真菌菌落形成数量不稳定,CA 对照在处理后30、40、50 d 有较少菌落形成。

图2 致密格链孢WDJ-55 在土壤中的定殖Fig.2 Colonization of Alternaria compacta WDJ-55 in soil
挑取真菌菌落进行测序鉴定,结果如表2 所示,W55-CA 修复处理的土壤可持续检测出致密格链孢,而W55 对照随修复天数有所降低,CA对照则一直未检出。初步确定致密链格孢W55 可有效定殖于含多菌灵土壤而难以定殖于不含多菌灵土壤中。
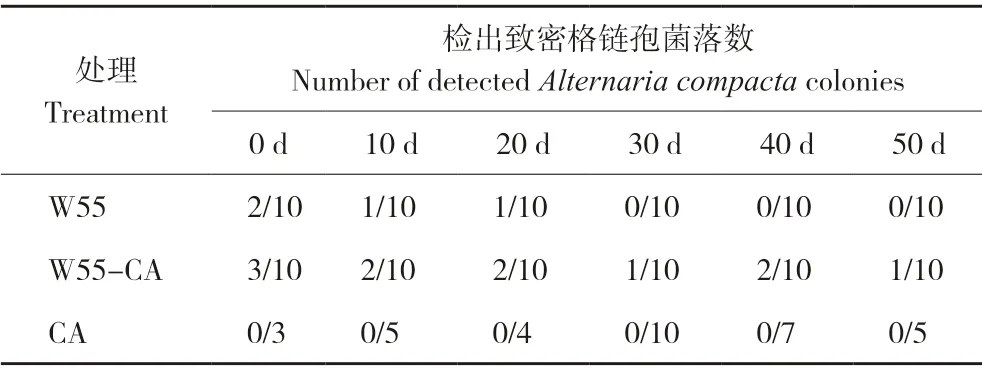
表2 致密格链孢测序检出情况Table 2 Detection of Alternaria compacta in by sequencing
在平板中已检测到一定数量的致密链格孢菌落生长,通过高通量测序分析可以更加准确地了解降解菌WJD-55 在土壤中的定殖情况。由图3可知,W55-CA 修复处理的土壤链格孢属优势菌群,CA 对照及CK 有小比例链格孢属、应属于土壤本源链格孢属,而CA 对照链格孢比例随天数降低,可见土壤本源链格孢属不耐受多菌灵,引入的菌剂WJD-55 在土壤中可以稳定定殖直至修复后期。

图3 格链孢属在土壤中的相对丰度Fig.3 Relative abundance of Alternaria sp.in soil at genus level
2.3 致密链格孢WJD-55 对土壤真菌多样性的影响
多菌灵作为一种微生物抑制剂,对土壤微生物多样性的影响已有很多文献报道,通过高通量测序对土壤真菌菌群的变化进行观测,土壤真菌微生物α-多样性如图4 所示,施用多菌灵土壤的Chao1、Otus、Shannon、Simpson 指数均比CK低,说明土壤真菌微生物丰富度及均一度都显著降低,随着W55-CA 修复天数的增加,W55-CA修复处理的土壤真菌微生物多样性比CA 对照恢复快,说明菌剂的加入有利于污染土壤真菌微生物多样性的恢复。

图4 土壤真菌微生物多样性指数Fig.4 Diversity index of fungal microorganism in soil
土壤真菌微生物菌群组成差异变化如图5 所示,CA 对照土壤真菌菌群多样性显著降低,无法分类的类群比例逐渐增加,至处理后40 d,土壤真菌接近80%的菌群成为无法分类类群,表明多菌灵对土壤微生物群落有显著的影响;而在加入多菌灵的土壤中施用菌剂,多菌灵对土壤真菌菌群的影响则显著降低。
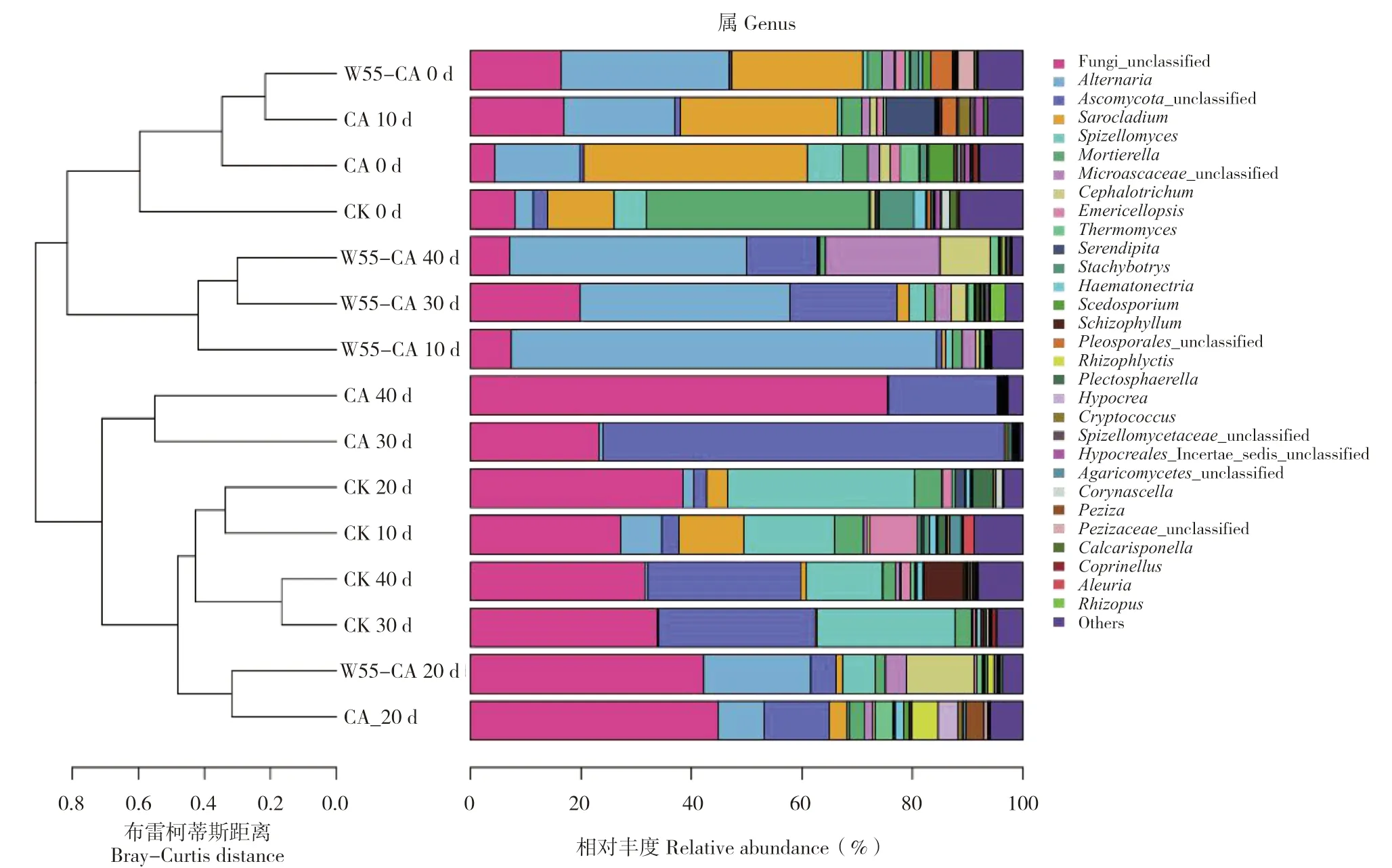
图5 属水平修复期土壤真菌群落聚类Fig.5 Fungi colony cluster of soil at genus level during remediation period
2.4 致密链格孢WJD-55 对土壤理化指标的影响
5~20 cm 土层土壤的基本理化性质如表3 所示,由于在菌剂使用过程中引入了麸皮等有机物质,W55 对照、W55-CA 修复处理土壤的有机质、N、P、K 水平比CA 对照和CK 高,分析认为这些指标的提高不是微生物菌株本身发挥的作用,而可能是菌剂中的辅料提供了部分影响,微生物WDJ-55 对土壤性质产生影响的可能性较低。

表3 土壤理化指标Table 3 Soil physical and chemical indexes

(续表3)
2.5 致密链格孢WJD-55 对作物生长的影响
由图6 可知,W55-CA 修复处理、W55 对照、CA 对照、CK 对番茄植株及叶片的生长均无显著差异,番茄叶片上未观察到有任何病变,后期挂果及产果过程中也未观察到显著差异,表明多菌灵及菌剂对作物生长无不良影响。
图6 菌剂W55 对作物生长的影响Fig.6 Effects of microbial agent W55 on crop growth
3 讨论
农药的广泛使用虽然减少了病害发生,保证农作物产量,但过度使用造成土壤残留对环境、生态安全及人类健康产生负面影响。农药施用后,未能及时自然降解的残留部分或被动植物吸收,或残留于土壤、大气、地表、地下水中[12]。近年来在土壤[13]、农产品[14]中广泛检出多菌灵残留,在我国地表、地下水中检出的地域也极为广泛,自北京、天津[15]直至太湖[16]、黄浦江流域[17]都有报道,且检出率几乎为100%。
研究表明,多菌灵是通过作用于真菌的β微管蛋白来发挥其杀菌作用,敏感性由β 微管蛋白对多菌灵的差异亲和力决定[18]。但β 微管蛋白广泛存在于所有真核生物,并且进化较为保守,因此多菌灵亦具有生殖毒性及神经毒性[19-20],通过阻滞植物细胞有丝分裂继而影响植物的正常生长[21],威胁自然生态中的鱼类、鼠类及昆虫的生存。对人类健康也会产生一定影响,通过降低G0/G1 期细胞的百分比诱导细胞凋亡[22],对肝细胞产生肝毒性损伤[23],慢性多菌灵暴露会引起肠道菌群失调和脂质代谢紊乱[24]。多菌灵残留对于农业土壤影响最为显著,它可以显著改变土壤细菌[25]及真菌的菌群结构[26]。本研究中,高通量测序结果显示微生物真菌的多样性受多菌灵的影响逐步降低,无法分类的比例显著增加。在修复菌剂的作用下,前期菌多样性有一定下降趋势,而后逐步得以恢复,但在处理后40 d 尚未达到对照水平,土壤具有抗性的真菌数量显著增加[27],耐药性病害真菌数量也显著增加[28-31],并且由于多菌灵的存在增强了病害真菌的毒性[32]。研究表明,通过宏基因组测序法对比温室和山区土壤样本,含有杀真菌剂的温室土壤比山区土壤具有更多样和丰富的抗杀菌剂基因,并且温室土壤中的抗性基因多集中于肠杆菌中[33]。本研究前期在多年设施棚室中也分离出大量的肠杆菌及其他条件致病菌。条件致病菌在土壤应用中会存在潜在安全问题,因此并不适合作为土壤残留农药微生物菌剂的出发菌株。
残留于环境中的多菌灵经过土壤本源微生物的作用亦会逐渐分解[34],外源引入可降解化学农药的微生物菌剂可以加速降低土壤中残留农药的水平,使土壤快速恢复健康水平,恢复土壤微生物的多样性,降低土壤微生物病原微生物数量及抗性基因,减少残留农药向水体及其他生物体内的迁移量。
目前报道具有多菌灵降解特性的微生物有芽孢杆菌[35]、苍白杆菌[36-37]、克雷伯氏菌、单胞菌[38]、金黄色葡萄球菌[39]、分枝杆菌[40]等。在土壤中验证其效果的微生物有枯草芽孢杆菌[35],该菌可加速土壤中多菌灵的降解;金黄色葡萄球菌[39]可在液体及土壤中将200 mg/L的多菌灵完全降解;木霉[41]可将土壤中100 mg/kg 多菌灵在6 d 内完全降解。但部分已报道的可降解多菌灵的微生物部分属于人条件致病菌,如金黄色葡萄球菌、克雷伯氏菌等,并不适合实际应用。本研究使用的效能菌株致密格链孢(A.compacta)属于丝状真菌,回接试验证实不具有致病性,产生的孢子可在室温条件下保存1 年以上,利于制剂及规模化应用,经土壤降解效果及安全性验证后,下一步将开展其降解机制及适用范围研究。
4 结论
本研究通过在多菌灵污染土壤中施用修复菌剂W55,初始多菌灵土壤含量约42 mg/L,使用菌剂0.1%处理后10 d,修复处理土壤多菌灵残留量为9.27 mg/kg、残留率22%,而对照土壤多菌灵残留量为30.20 mg/kg、残留率71%,具有极显著差异(T-test,P=0.001)。表明菌剂W55 可有效加速多菌灵在土壤中的降解。土壤微生物高通量测序结果显示降解菌WJD-55 可在多菌灵污染土壤中定殖,并可弥补多菌灵对土壤微生物多样性产生的负面影响;土壤理化指标显示菌剂的加入未对土壤物理化学性质带来显著影响;观测作物番茄生长未受到菌剂的任何影响。通过土壤残留多菌灵的测定,土壤真菌微生物多样性测序、土壤理化指标测定以及作物生长观测结果均表明,多菌灵降解菌WJD-55 可在土壤中稳定定殖并发挥降解多菌灵的作用,在番茄种植土壤中使用该菌剂安全有效。

