水稻种子TTC 染色及萌发特性研究
陈兵先,张 琪,戴彰言,高家东,张文虎,吴柔贤,宋松泉,刘 军
(广东省农业科学院农业生物基因研究中心/广东省农作物种质资源保存与利用重点实验室,广东 广州 510640)
【研究意义】水稻是我国最重要的粮食作物之一。随着我国农业种植模式的改变和人工成本的不断增加,直播稻越来越受青睐。然而,直播稻栽培因省去了浸种、育苗等常规流程,对于种子的活力有更高的要求。因此,在水稻直播前对种子活力及生活力进行评判有助于优选高活力种子,这对于确保田间萌发率和成苗率显得尤为重要。
【前人研究进展】种子活力是指在广泛的田间条件下,种子能够迅速、整齐地萌发并长成健壮幼苗的能力[1]。国际种子检验协会(International Seed Testing Association,ISTA)将电导率测定和加速老化试验作为农作物种子活力检测的推荐方法。这些方法虽然可靠性高,但试验周期较长。种子的生活力是指种子的潜在发芽能力或种胚所具有的生命力,是种子预期能够长成正常幼苗的潜在能力[2]。高活力的种子一定具有高的生活力,因此当生产上不能应用电导率测定和加速老化试验对种子活力进行判定时,往往将四唑(Triphenyltetrazolium Chloride,TTC)法检测种子生活力的结果作为评判种子活力的重要依据[3]。用于种子生活力检测的TTC 染色法具有便捷、快速、灵敏等优点[4],ISTA 和中国农作物检验规程建议将TTC 染色法列为种子活力测定的方法之一。然而,TTC 染色法具有不稳定、受制于种子类别和染色条件等特点,目前缺乏程序化、规范化的TTC 染色技术流程。因此,针对不同农作物种子的特征特性,开发一套适用于不同类别作物种子的TTC 染色技术对于种子生活力的检测具有重要意义。
【本研究切入点】以籼型常规水稻R988 为材料,针对当前种子生活力检测不规范、缺乏统一技术流程的现状,以及种业市场对于种子生活力检测的迫切需求,应用单因素试验和正交试验设计系统研究吸水时间、TTC 浓度、染色温度和染色时间对于种子生活力的影响;并通过萌发率和酶活性分析水稻种子萌发过程生理指标的变化。【拟解决的关键问题】探讨水稻种子TTC 染色方法中对生活力测定有显著影响的因素,并从各因素中筛选适用于水稻种子生活力检测的最佳水平,揭示水稻种子在吸水萌发过程中的特性。
1 材料与方法
1.1 试验材料
籼型常规水稻R988 于2020 年早造种植于广东省农业科学院白云试验基地。种子收获后置于广东省农作物种质资源库干燥间(温度15℃,湿度15%)保存备用。
1.2 试验方法
1.2.1 水稻种子TTC 染色 所用试剂为2,3,5-氯代三苯基四氮唑(购于广州鼎国生物技术有限公司),溶解液为pH7.0 磷酸缓冲液,配制成不同浓度的TTC 染色液。将经过净度分析后饱满的水稻种子去壳,于无菌水中预吸胀一定时间(100粒/重复),将预吸胀的种子捞出后用滤纸吸干表面水分,每100 粒种子加入30 mL TTC 染色液,在一定染色温度下染色一定时间。染色结束后将种子用清水冲洗3 次,终止反应。染色后的种子采用体视显微镜观察。
单因素试验:设置单因素试验研究种子吸水时间、TTC 浓度、染色温度和染色时间对种子生活力的影响。(1)种子吸水时间试验:采用浓度为1%TTC、染色温度30℃、染色时间1 h,种子吸水时间分别设置为0、3、6、9、12 h 对水稻种子进行染色;(2)TTC 浓度试验:采用吸水时间6 h、染色温度30℃、染色时间1 h,TTC 浓度分别设置为0.1%、0.2%、0.5%、1%和2%对水稻种子进行染色;(3)染色温度试验:采用吸水时间6 h、1% TTC、染色时间1 h,染色温度分别设置为20、25、30、35、40℃对水稻种子进行染色;(4)染色时间试验:采用吸水时间6 h、1%TTC、染色温度30℃,染色时间分别设置为0.5、0.75、1、1.5、2 h 对水稻种子进行染色。种子生活力按以下公式计算:

正交试验:在单因素试验结果基础上,选取种子吸水时间、TTC 浓度、染色温度和染色时间作为影响种子生活力测定准确性的主要因素,设计L9(34)正交试验(表1),进一步优化水稻种子TTC 染色检测方法。

表1 正交试验的因素和水平Table 1 Factors and levels of orthogonal test
1.2.2 水稻种子萌发特性分析(1)种子萌发率测定:将每100 粒水稻种子置于9 cm×9 cm发芽盒中萌发,盒内铺平两层滤纸,加入20 mL无菌水。将发芽盒置于植物培养箱中,设置温度为28℃、湿度为85%、光照强度为10 000 lx,光照和黑暗时长分别为16 h 和8 h。本试验分析不同水量、温度、光暗条件对水稻种子萌发的影响,只需改变某单一试验条件,其他萌发条件均保持不变。种子萌发的标准为胚根≥2 mm。计算种子萌发率。
(2)种子生理指标测定:取吸胀48 h 的水稻种子胚,4 次重复,每个重复100 粒。淀粉酶活性测定参照《作物种子生理学实验》[5]、可溶性糖含量测定参照《种子学实验指南》[6]的方法进行。
采用Microsoft office 软件和SPSS21 软件进行数据处理分析。
2 结果与分析
2.1 水稻种子TTC 染色的差异分析
采用去除颖壳的水稻整粒种子进行TTC 染色,结果(图1)只有种胚处被染色,而胚乳(包括糊粉层和淀粉型胚乳)均不能被染色。种胚被染色的种子主要分为5 种情况:整个胚染色较深、整个胚染色较浅、胚根被染色、胚芽被染色、盾片被染色。将种子沿种胚对称纵切后,结果发现前4 种状态下的种子其整个胚均能被较深程度地染色;而整粒未能被染色的种子以及仅盾片处被染色的种子,纵切半粒后的种胚也不能被染色。
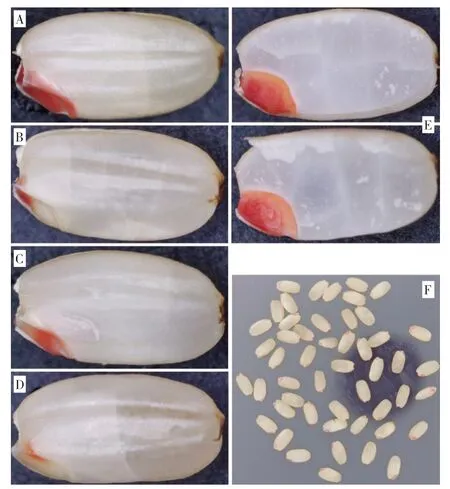
图1 水稻种子TTC 染色效果Fig.1 TTC staining effects of rice seeds
2.2 水稻种子TTC 染色单因素试验结果
由表2 可知,种子染色前的吸水时间对种子染色率有较大影响。种子吸水时间0 h,即干种子时,染色率仅为53%,吸水种子的染色率明显高于干种子的染色率,吸水3 h 以上的染色率均大于70%,吸水12 h 的染色率达到80%。
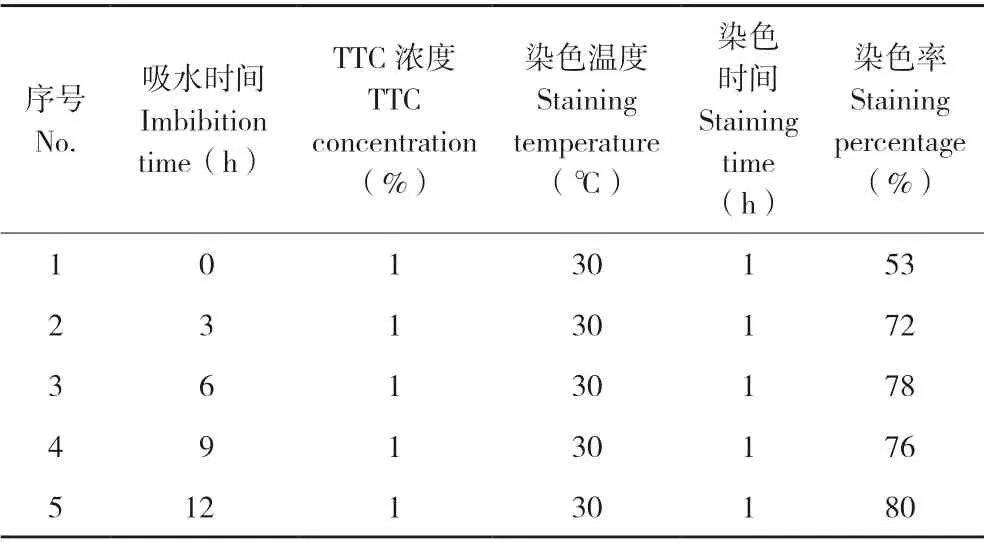
表2 胚染色率与种子吸水时间的关系Table 2 Relationship between staining rate of embryo and seed imbibition time
由表3 可知,TTC 浓度对于染色率也有较大影响,主要体现在高低浓度的差别上,当TTC浓度≤0.2%时染色率不足60%,但当TTC 浓度≥0.5%时染色率没有显著差异,均在80%以上。

表3 胚染色率与TTC 浓度的关系Table 3 Relationship between staining rate of embryo and TTC concentration
表4 结果表明,染色温度为20℃时,种子染色率仅为43%,随着染色温度的上升种子染色率也逐渐升高,但当温度高于30℃时染色率升高趋势趋缓。
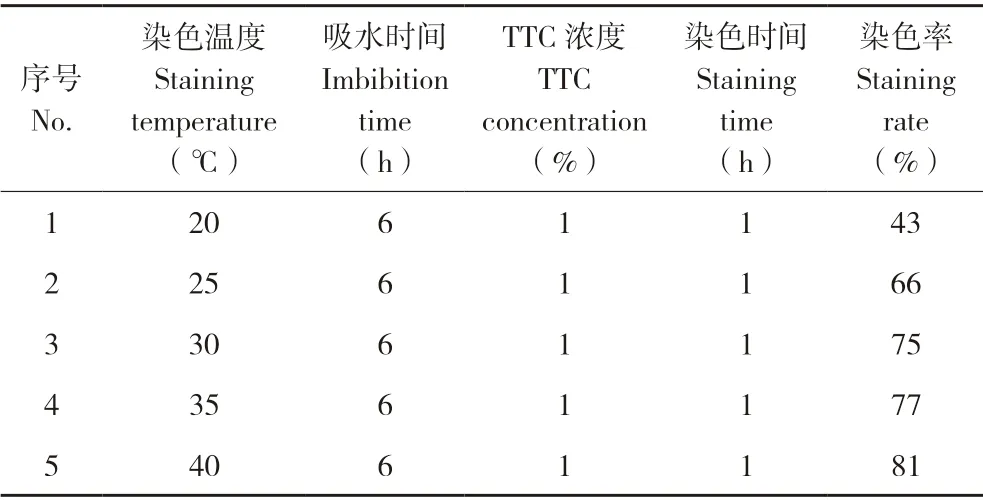
表4 胚染色率与染色温度的关系Table 4 Relationship between staining rate of embryo and staining temperature
表5 结果表明,种子染色时间可能对于染色率的影响更大,从染色0.5~2 h 这一过程中可见,染色率呈现直线上升的趋势。

表5 胚染色率与染色时间的关系Table 5 Relationship between staining rate of embryo and staining time
基于单因素试验结果,我们选用种子吸水时间、TTC 浓度、染色温度和染色时间作为正交试验设计因素,并从单因素的多个试验梯度中各选用3 个水平,以期筛选最佳的染色组合方案。
2.3 水稻种子TTC 染色正交试验结果
由表6 可知,在不同因素与水平组合处理下,水稻种子染色率(种子生活力)介于52%~95%之间,存在较大差异。其中以第4 组合试验即吸水时间6 h、0.5% TTC、染色温度30℃和染色时间2 h 条件下的种子生活力最高,种胚完全染色占72.5%,种胚染色较浅或仅胚根、胚芽染色占22.5%,总染色率高达95%,明显优于其他组合;而第1 组合试验即吸水时间3 h、0.5%TTC、染色温度25℃、染色时间0.5 h 条件下的种子生活力最低,能够完成染色的种子数仅为15%,大部分为不能染色和染色较浅的种子。对各试验组得到的染色率进行方差分析,结果表明,试验设定的4 个因素,吸水时间(A)和TTC 浓度(B)的P值分别为0.036 和0.024,说明吸水时间和TTC 浓度对种子染色结果有显著作用;而染色温度(C)和染色时间(D)的P值均小于0.01,达到极显著差异水平,表明这两个因素对于种子染色结果有更重要的作用。

表6 水稻种子TTC 染色正交试验结果Table 6 Results of orthogonal test for TTC staining of rice seeds
进一步对正交试验数据进行极差分析,结果表明,4 个因素的极差值分别为RA=2.9,RB=3.1,RC=17.5,RD=26.8。因此,4 个因素对于水稻种子生活力的影响依次为:染色时间(D)>染色温度(C)>TTC 浓度(B)>吸水时间(A)。可见在利用TTC 方法对水稻种子进行染色时,染色时间最为重要,而种子吸水时间影响最小。由于各因素所对应极差的最大值可代表最适合测定水稻种子生活力的条件,综合上述结果,则可以得出水稻种子染色的最佳条件为:吸水时间3 h、TTC 浓度1%、染色温度30℃、染色时间2 h。利用该最佳组合对同一批水稻种子染色,平均染色率为95.5%,稍高于正交试验中的最佳试验组合。
2.4 不同萌发条件下水稻种子萌发率变化
温度、水分、光照和氧气是决定种子萌发最重要的因素[7]。由图2 可见,水稻种子在35℃下萌发最快,25℃下萌发最慢,种子萌发4 d(96 h)的萌发率分别为82%和72%。不同温度条件并未对萌发7 d(168 h)的萌发率产生显著影响,25~35℃下的萌发率均超过90%。
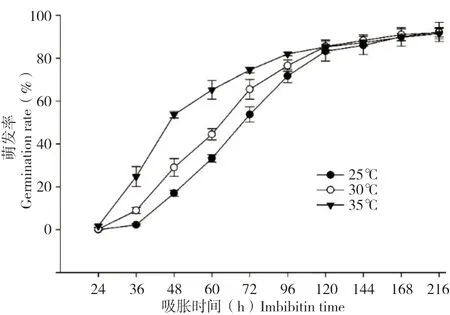
图2 水稻种子在不同温度下的萌发率Fig.2 Germination rate of rice seeds at different temperature
图3 结果表明,光照对于水稻种子萌发的影响在萌发48 h 前未产生显著影响,之后萌发过程被光促进,萌发率在暗条件下略有降低,表明光照条件可以加速水稻种子萌发。
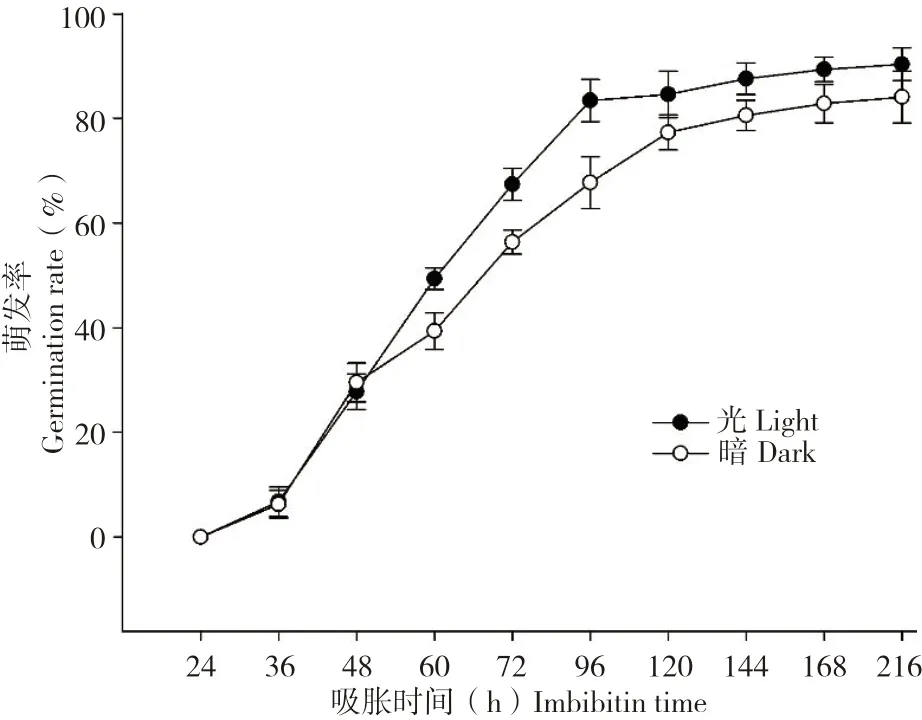
图3 水稻种子在光照和黑暗条件下的萌发率Fig.3 Germination rate of rice seeds under light or dark conditions
种子吸水是完成萌发最关键的先决条件,水量多少决定种子的萌发速率和质量,比如大豆种子萌发不需要太多水分,浸种次数越多反而萌发率降低[8]。研究表明,水稻种子随着水量的增加,萌发速率和萌发率逐渐升高(图4),这可能是由于水稻的水生特性所决定的。

图4 水稻种子在不同水量条件下的萌发率Fig.4 Germination rate of rice seeds imbibed in different water amounts
2.5 不同萌发条件下水稻种子淀粉酶活性和可溶性糖含量变化
水稻的淀粉酶是一类水解种子内淀粉,并参与赤霉素转运的重要水解酶,一向被认为与水稻种子萌发密切相关[9]。在不同温度下吸胀萌发时,α-淀粉酶的活性随着温度上升逐渐升高,β-淀粉酶活性在25℃和30℃时无显著差异,相比之下,35℃萌发温度却显著提高了β-淀粉酶在种子胚中的活性(图5)。与黑暗环境下萌发的种子相比,光照显著提高了水稻种子胚中α-淀粉酶和β-淀粉酶的活性(图6)。在10、20 mL 水中吸胀的水稻种子,α-淀粉酶和β-淀粉酶的活性没有明显变化,然而随着水量的逐渐增加,两种淀粉酶的活性也逐渐升高(图7)。不同吸胀条件下,淀粉酶活性的变化趋势与水稻种子萌发率的变化几乎一致,表明α-淀粉酶和β-淀粉酶是参与水稻种子萌发的关键水解酶。
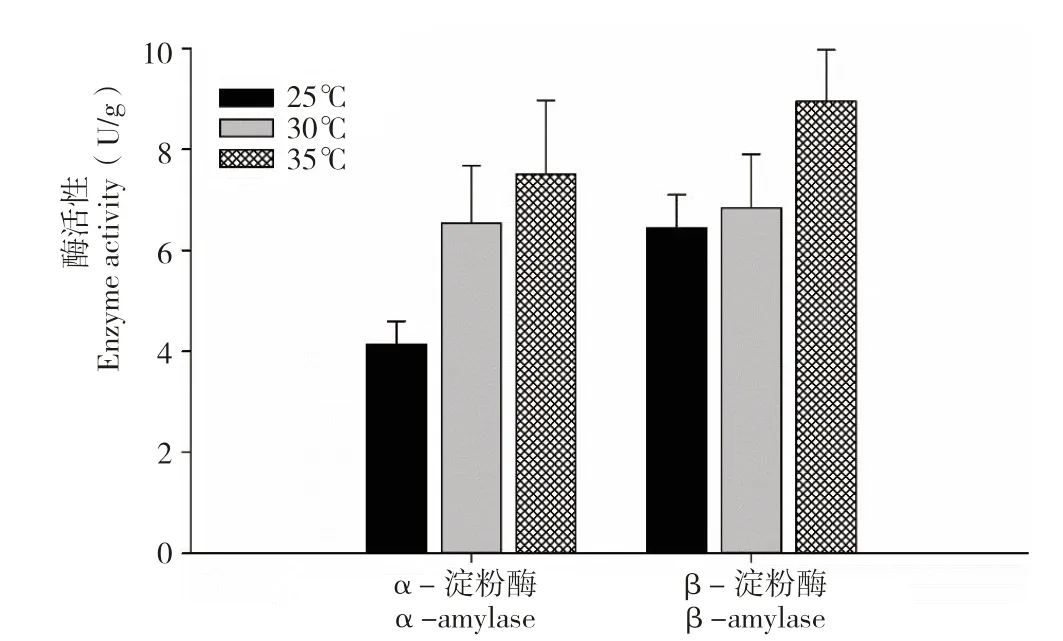
图5 水稻种子在不同温度下萌发48 h 的胚中淀粉酶活性Fig.5 Amylase activity in embryos of rice seeds germinated at different temperature for 48 h

图6 水稻种子在不同光照环境下萌发48 h 的胚中淀粉酶活性Fig.6 Amylase activity in embryos of rice seeds germinated under light and dark conditions for 48 h

图7 水稻种子在不同水量下吸胀48 h 的胚中淀粉酶活性Fig.7 Amylase activity in embryos of rice seeds imbibed in different water amounts for 48 hours
种子中可溶性糖通常被认为可为种子萌发和幼苗生长提供能量,因此在种子萌发和幼苗建成阶段可溶性糖呈现逐渐上升的趋势[10]。研究表明,可溶性糖含量在光照条件下较高;种子萌发水量的增加以及萌发温度的升高均能显著增加可溶性糖在种子胚中的含量(图8)。这一结果与淀粉酶在种胚内的变化以及萌发率的结果一致。
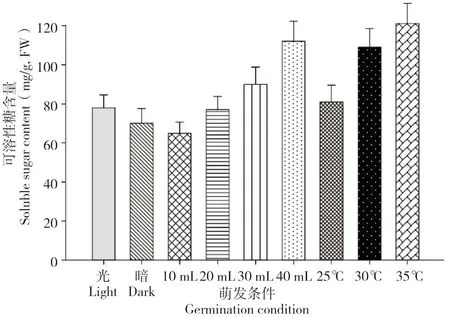
图8 水稻种子在不同萌发条件下的可溶性糖含量Fig.8 Soluble sugar contents of rice seeds under different germination conditions
3 讨论
应用TTC 染色检测种子生活力对于快速检验植物种子的质量具有重要的指导意义[2,11]。因此,国际种子检验规程以及我国农作物种子检验规程均将其作为检测种子生活力及种子活力的重要参考[4,12]。本研究将去壳的水稻种子浸于TTC 溶液中染色时,有部分种子的胚可以被染成深红色,但也有部分种子的胚染色较浅或只有胚芽或胚根被染色,它们均被认为是具有生活力的种子,因为将其种胚纵切后发现,它们的胚也能够完全被染色,这可能是由于TTC 染液不容易被部分种子胚吸收或种子生活力较低所致。然而萌发试验结果表明,胚完全染色和部分染色的种子均具有较高的萌发率。因此,我们将染色程度为整个胚染色较深、整个胚染色较浅、胚根被染色、胚芽被染色的种子归为具有生活力的种子;而种胚完全不能被染色或仅有盾片部分被染色的种子,被认为是丧失生活力的种子,它们也无法完成萌发。需要注意的是,TTC 染色也具有一定的局限性,该方法只能区分具有生活力的种子和无生活力的种子,却无法区分休眠种子和破眠种子[4,13]。本试验所使用的水稻种子是在完全打破休眠后投入使用的,因此种子生活力百分率与萌发率几乎一致。对于有休眠特性的种子,建议将TTC 染色与种子萌发率检测的结果作为参考使用。
正交试验设计常被广泛应用于种子TTC 染色的最佳因素和水平筛选和优化上[14-16]。水稻种子染色正交试验的极差分析和方差分析结果表明,种子吸水时间、TTC 浓度、染色温度和染色时间4 个因素均能显著影响水稻种子染色效果。其中染色温度和染色时间对于染色效果的影响达到极显著水平,表明这两个因素是决定水稻种子TTC 染色效果最关键的因素。这一结果与应用TTC 溶液染色油桐[17]和南京椴[18]种子的生活力检测结果相似,即染色温度和染色时间对于种子染色更为重要。
一些禾谷类作物的种子在萌发过程中,淀粉酶的活性逐渐升高,植物激素脱落酸和赤霉素分别抑制和促进种子萌发也是通过影响α-淀粉酶的活性来实现的[9,19-21]。本研究进一步丰富了前人的研究结果。比如随着加水量增加、温度升高,淀粉酶的活性和种子萌发均呈现逐渐上升的趋势。可溶性糖作为淀粉酶水解淀粉的产物,其含量变化与前两者的变化趋势也一致,表明水稻种子在逐渐萌发过程中由于淀粉酶逐渐升高,导致可溶性糖含量也逐渐升高,从而为种子萌发和幼苗建成提供能量和营养[22-23]。
4 结论
对于水稻种子而言,TTC 染色是一种可靠、便捷的种子生活力检测方法,按照对水稻种子染色的影响程度,依次为染色时间、染色温度、TTC 浓度和吸水时间。TTC 染色水稻种子的最佳条件为:染色时间2 h,染色温度30℃,TTC 浓度1%,吸水时间3 h。采用该条件对试验中同批次水稻种子染色,平均染色率为95.5%。在不同吸胀条件下,α-淀粉酶、β-淀粉酶活性和可溶性糖含量的变化与种子萌发率的变化呈现相同趋势,或可作为预测和评价种子活力或萌发能力的重要生理指标。

