CT引导下氩氦刀冷冻消融术辅助治疗原发性肝癌对肿瘤组织血流变化的影响
1.河南大学附属南阳南石医院肿瘤内科(河南 南阳 473000)
2.河南大学附属南阳南石医院介入科(河南 南阳 473000)
翟焕阁1,* 肖正红1 杨双林2
原发性肝癌(primary hepatic cancer,PHC)为临床常见恶性肿瘤,70%左右患者就诊时病情已演变为中晚期,治疗难度大,预后普遍较差[1]。肝动脉化疗栓塞术(transcatheter hepatic arterial chemoembolization,TACE)是治疗中晚期PHC首选手段,可在短期内杀灭肿瘤细胞、栓塞肿瘤血管,然而也存在一定不足之处,如栓塞不充分,残余肿瘤细胞多,且残留细胞可分泌血管内皮生长因子(VEGF)、细胞间黏附分子-1(ICAM-1)、基质金属蛋白酶-13(MMP-13)等细胞因子,导致肿瘤复发转移,进而降低治疗效果[2-3]。CT引导下氩氦刀冷冻消融术为近年来用于临床的技术,可通过理化效应破坏肝癌细胞及其供血血管,实现杀灭肿瘤细胞的目的[4]。目前,关于两者联合治疗研究多集中于疗效、生存率、复发率等指标分析,较少报道对PHC患者癌细胞恶性生物学行为的影响,鉴于此,本研究分析TACE联合CT引导下氩氦刀冷冻消融术对PHC患者血清VEGF、MMP-13、ICAM-1水平及其临床价值。
1 资料与方法
1.1 研究对象经我院伦理委员会审核批准,按照治疗方案将我院84例PHC患者(2017年5月至2019年4月)分为观察组与对照组,每组42例。两组性别、年龄、肿瘤直径、肿瘤位置、肝功能Child-Pugh分级、肿瘤数量、肝癌家族史、受教育程度等资料均衡可比(P>0.05),见表1。
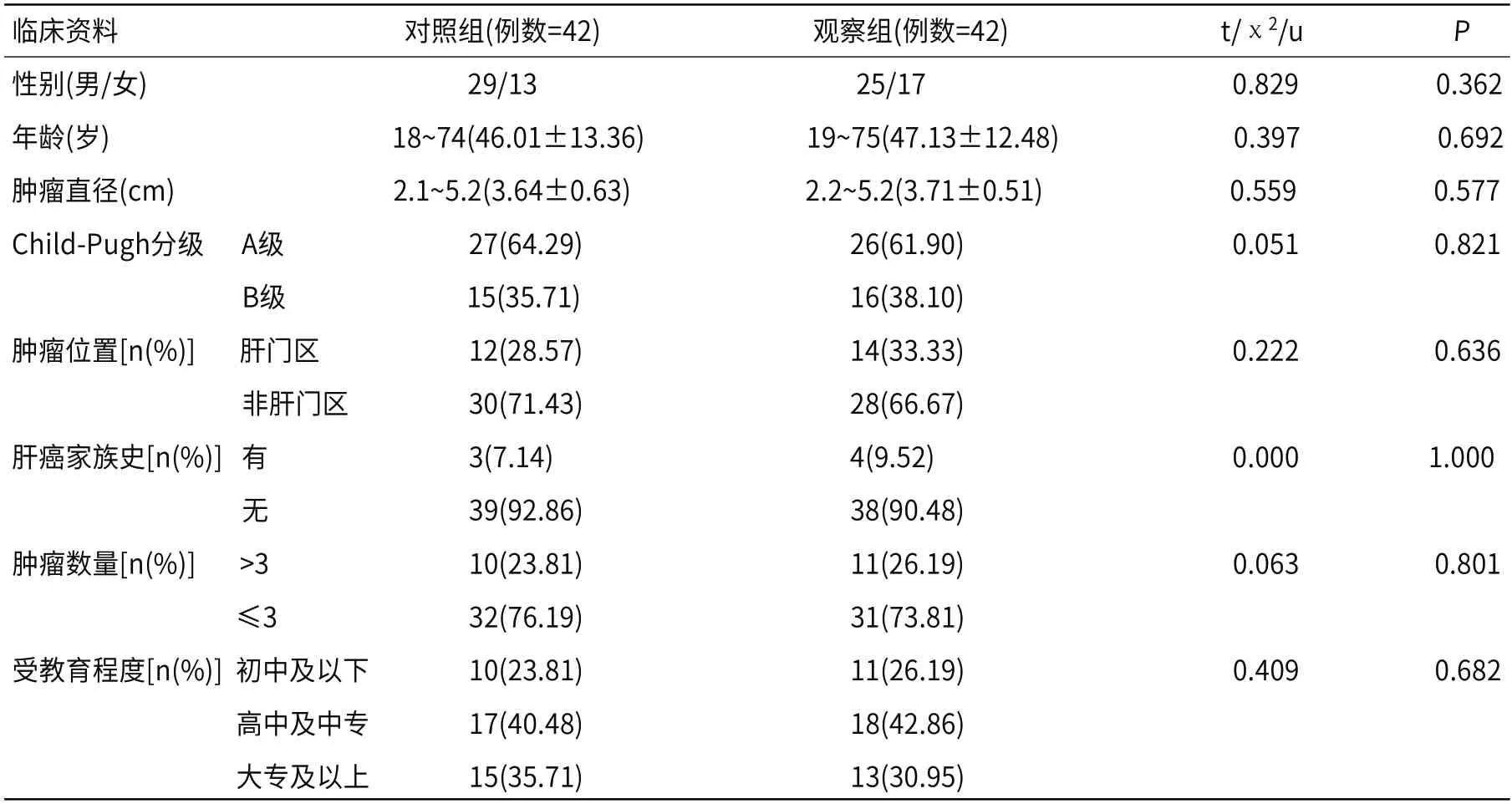
表1 两组临床资料比较
纳入标准:(1)符合PHC诊断标准[5];(2)细胞学检查证实PHC;(3)预计生存期限≥3个月;(4)年龄≥18岁;(5)体力状况良好,卡氏(Karnofsky,KPS)评分≥70分;(6)患者及家属知晓并签订同意书。排除标准:(1)本研究治疗禁忌证者;(2)全身急慢性感染者;(3)其他恶性肿瘤者;(4)术前1周接受放化疗或分子靶向治疗者;(5)妊娠或哺乳期女性;(6)严重躯体疾病者;(7)肝功能Child-Pugh分级C级者;(8)近3个月伴有消化道大出血或接受外科手术者;(9)凝血功能异常者。
1.2 方法
1.2.1 观察组 行CT引导下氩氦刀冷冻消融术+肝动脉化疗栓塞术(TACE),TACE操作步骤:采取Seldinger穿刺法穿刺右侧股动脉,将导管插入肝动脉行动脉造影,确定肿瘤位置、血供情况,将微导管插入肿瘤供血动脉,注入碘化油乳剂(100~150mg奥沙利铂+10~20mg多柔比星+10~20mL超液化碘油),栓塞肿瘤血管,血供丰富者加用350~560μm明胶海绵颗粒栓塞,根据肿瘤控制情况行2~4次TACE,术后2~4周行CT引导下氩氦刀冷冻消融术,根据肝脏CT检查结果确定进针点、进针深度及角度,做好标记,应用美国Endocare公司生产氩氦超导手术系统及插入式冷刀,规格依次为1.4、2、5mm,根据肿瘤大小选取相应型号冷刀,利多卡因(浓度为2%)局麻,自穿刺点作一切口,长度约3mm,细针刺入病灶靶点,CT扫描视野下,确定位置满意后,启动低温手术系统,冷冻15min,最低温度-150℃,氦气复温5min,最高温度40℃,上述操作重复2次,持续CT扫描,必要时调整冷刀角度及位置。术毕退刀,腹带加压包扎,并给予止血、护肝、抗感染、营养支持等常规操作。
1.2.2 对照组 行TACE,操作步骤同观察组。术后4周进行效果评估。
1.2.3 检测方法 于清晨抽取3ml空腹肘静脉血,放入离心机,以3000r/min转速离心10min,取上层清液,保存于-20℃冰箱内。以酶联免疫吸附法(ELISA)检测血清VEGF、MMP-13、缺氧诱导因子-α(HIF-1α)、ICAM-1。上海通蔚科技有限公司提供所用试剂、试剂盒,参照试剂盒说明书操作。
1.3 疗效评价[6]参照实体瘤疗效评价标准,取增强CT下可准确、重复测量病灶,以其动脉期强化时区域为目标病灶。完全缓解(CR):目标病灶动脉期增强显影消失;部分缓解(PR):目标病灶动脉期增强显影直径总和缩小30%以上;疾病稳定(SD):目标病灶动脉期增强显影直径总和缩小不足30%;疾病进展(PD):目标病灶动脉期增强显影直径总和增大20%以上。总有效率=(CR+PR)/总例数×100%。疾病控制率=(CR+SD+PR)/总例数×100%。
1.4 观察指标(1)两组术前及术后4周肝动脉灌注量(HAP)、总肝脏灌注量(TLP)、肝灌注指数(HPI)。检测方法:应用Philips Brilliance极速256层螺旋CT扫描机,仰卧位,叮嘱患者尽量平静小幅度呼吸,先行常规肝脏平扫,明确灌注扫描范围,1~2h后行CT灌注扫描,经肘正中静脉静脉团注50mL离子型对比剂优维显,速度为5mL/s,扫描条件:管电流100mAs,管电压120kV,重建间隔5mm,重建层厚5mm,矩阵512×512,探测器排列128mm×0.625mm,总扫描次数15次,延迟5s扫描,间隔3.8s,扫描范围110.8~120.8mm。将所获图像传输至Philips EBW 4.5.1工作站肝灌注软件,取感兴趣区(ROI),软件自动生成灌注参数伪彩图、时间-密度曲线(TDC),得到HAP、TLP、HPI。(2)两组术前及术后术后4周血清HIF-1α、VEGF水平。(3)两组术前及术后术后4周血清MMP-13、ICAM-1水平。(4)两组肿瘤学疗效。(5)两组生存质量改善情况。选用KPS评分[7]评估,包含改善(术后增加≥10分)、稳定(术后增加<10分)、降低(术后降低≥10分)等3个等级。
1.5 统计学方法通过SPSS 25.0处理,计量资料以()表示,行t检验,计数资料以n(%)表示,行χ2检验,P<0.05表明差异有统计学意义。
2 结 果
2.1 典型病例分析术前、术中及术后CT灌注成像表现:女,49岁,PHC;CT引导下氩氦刀冷冻消融术CT灌注成像表现,见图1~3。
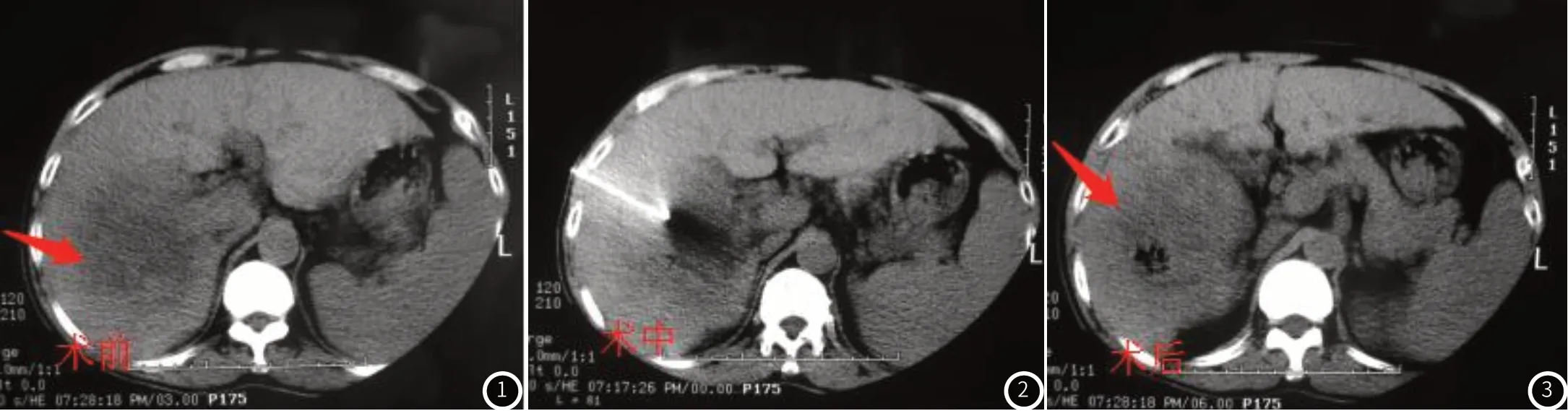
图1~3 术前、术中及术后CT灌注成像
2.2 肿瘤学疗效术后4周,观察组疾病控制率高于对照组(P<0.05),两组治疗总有效率比较,差异无统计学意义(P>0.05)。见表2。
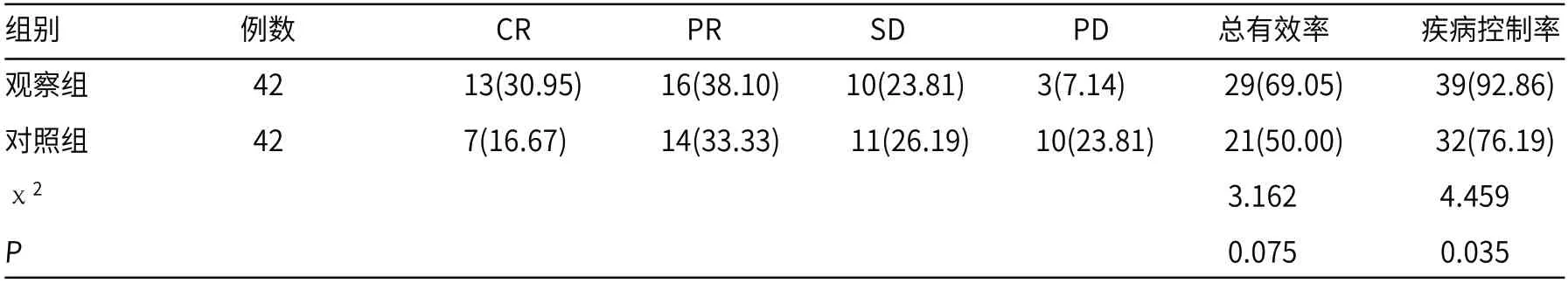
表2 两组治疗总有效率、疾病控制率比较[n(%)]
2.3 CT灌注参数术前两组HAP、TLP、HPI参数比较无显著差异(P>0.05);术后4周均较术前降低,且观察组低于对照组(P<0.05)。见表3。
表3 两组肿瘤组织CT灌注参数比较()
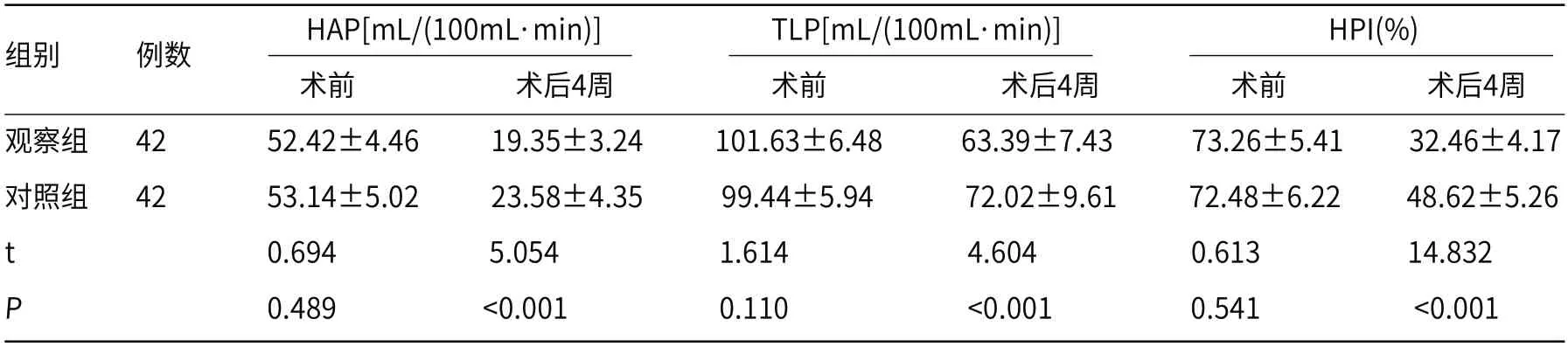
表3 两组肿瘤组织CT灌注参数比较()
2.4 血管新生相关指标术前两组血清HIF-1α、VEGF水平比较无显著差异(P>0.05);术后4周较术前降低,且观察组低于对照组(P<0.05)。见表4。
表4 两组血清HIF-1α、VEGF水平比较()
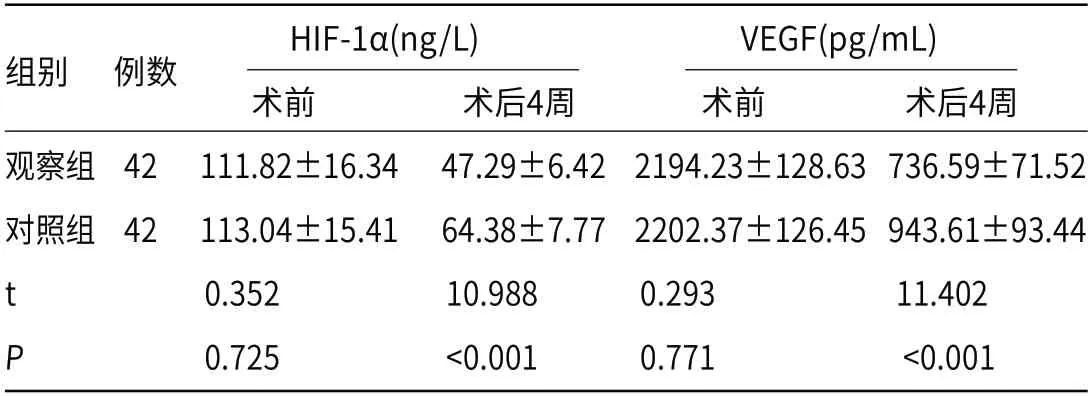
表4 两组血清HIF-1α、VEGF水平比较()
2.5 肿瘤侵袭相关指标术前两组血清MMP-13、ICAM-1水平比较无显著差异(P>0.05);术后4周较术前降低,且观察组低于对照组(P<0.05)。见表5。
表5 两组血清MMP-13、ICAM-1水平比较(,ng/mL)
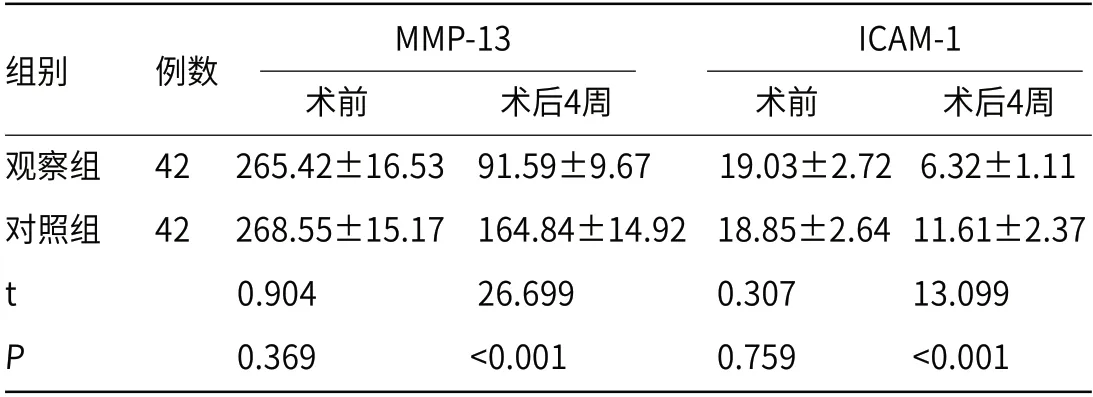
表5 两组血清MMP-13、ICAM-1水平比较(,ng/mL)
2.6 生存质量术后4周,观察组生存质量改善率高于对照组(P<0.05)。见表6。
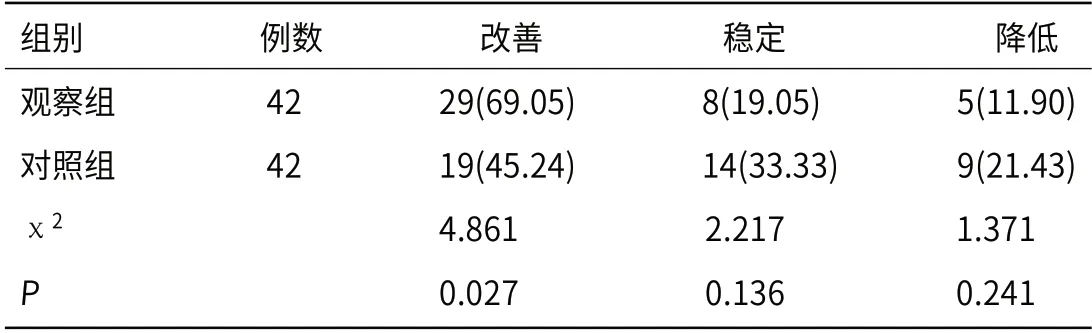
表6 两组生存质量改善情况比较[n(%)]
3 讨 论
正常肝脏组织中,25%供血来自肝动脉,75%供血来自门静脉,而PHC中90%供血来自肝动脉,故阻断肝动脉供血,可促使肝癌病灶缺血性坏死,且对正常肝组织血液灌注影响较小[8]。基于上述血供差异,临床主张以TACE治疗为主,通过局部化疗、栓塞,使肿瘤细胞缺血缺氧坏死,从而起到杀灭肿瘤细胞的目的。临床实践发现,因栓塞剂流失,导致肿瘤病灶坏死率低,而残留肿瘤病灶具有较强侵袭及增殖能力,易导致病情反复发作[9]。同时反复多次TACE治疗可加重患者肝功能损伤,影响治疗效果及预后。
CT引导下氩氦刀冷冻消融术的出现能有效弥补单纯TACE治疗不足,强化整体治疗效果,其主要机制包含细胞内冰晶形成及冰晶机械性损伤[10]。当温度为-15℃时,细胞内开始形成冰晶,当温度降至-40℃甚至-100℃时,细胞内外快速形成冰晶,使肿瘤细胞破裂及细胞内蛋白质理化变性,最终导致肿瘤细胞凋亡。血管损伤是CT引导下氩氦刀冷冻消融术杀伤肿瘤细胞又一重要机制,冰晶形成可阻碍冷冻靶区血液循环,损伤血管内皮细胞,复温解冻后,血管内皮细胞剥落,增加毛细血管通透性,形成血栓,完全封闭微小血管,从而促使肿瘤组织缺血坏死[11-12]。数字减影血管造影(DSA)是PHC血供评价“金标准”,但其属于侵入性检查,加以其费用昂贵,不适用于常规随访。随功能性成像特别是CT灌注成像技术完善与改进,将形态与功能相结合,为临床分析肝脏微循环改变提供新途径。研究表明,HAP、TLP、HPI等CT灌注参数能直接反映局部组织血供状态及其血流动力学改变[13]。鉴于此,本研究将上述CT灌注参数作为观察指标,给予TACE联合CT引导下氩氦刀冷冻消融术,结果显示,术后4周观察组HAP、TLP、HPI参数低于对照组(P<0.05),说明TACE联合CT引导下氩氦刀冷冻消融术治疗后,能更加彻底阻断肿瘤细胞血供,减少新生血管生成,抑制肿瘤侵袭与转移。
文献报道,肿瘤组织灌注状态与新生血管生成密切相关,相对高灌注提示肿瘤内部血管生成旺盛[14]。VEGF为高度特异性促血管内皮生长因子,可直接参与肿瘤血管生成。缺氧条件下,HIF-1α可与低氧反应因子发生反应,诱导VEGF生成,刺激血管内皮细胞增生,形成新生血管,导致肿瘤细胞扩散、转移[15]。刘亮等[16]研究报道,TACE治疗后,PHC患者血中VEGF、HIF-1α水平呈降低趋势。但有研究指出,TACE治疗期间,VEGF、HIF-1α等细胞因子极易出现活化,进而形成新生血管,致使肿瘤复发、转移[17]。在此背景下,本研究给予42例PHC患者TACE联合CT引导下氩氦刀冷冻消融术,并以单纯TACE治疗作为对照,结果显示,术后4周观察组血清HIF-1α、VEGF水平低于对照组(P<0.05),可能机制为CT引导下氩氦刀冷冻消融术能增加肿瘤细胞膜通透性,提高肿瘤细胞对化疗药物吸收,强化肿瘤细胞杀灭作用,进而抑制细胞因子表达及肿瘤血管新生能力,降低血清HIF-1α、VEGF水平。
基质金属蛋白酶(MMP)家族由多种锌离子依赖性酶组成,亚型众多,如基质金属蛋白酶9(MMP-9)、MMP-13,可通过降解细胞外基质成分,促使肿瘤生长、转移。ICAM-1主要作用机制为促使异源细胞间相互黏附,实现不同细胞间相互效应,促使肿瘤转移[18]。张先俊等[19]研究显示,PHC患者血中ICAM-1呈高表达,且与肝细胞损伤程度、肝纤维化密切相关。张鹏[20]研究报道,ICAM-1、MMP-13在PHC患者中含量较高,经TACE联合氩氦刀冷冻消融术治疗后,呈显著降低趋势。本研究结果显示,术后4周观察组血清MMP-13、ICAM-1水平低于对照组(P<0.05),与上述研究结果相符,说明联合应用可降低PHC患者血清MMP-13、ICAM-1水平。探究原因发现,TACE治疗可减少肿瘤血供,闭塞多处小血管,提高氩氦刀冷冻区域冷冻效应,彻底杀灭肿瘤细胞,降低其侵袭转移能力,进而降低血中MMP-13、ICAM-1水平[21]。在此基础上,本研究对两组肿瘤学疗效、生活质量进行统计分析,结果发现,术后4周,观察组疾病控制率、生活质量改善率高于对照组(P<0.05),说明TACE联合CT引导下氩氦刀冷冻消融术有助于提高PHC患者疾病控制率,改善生活质量。但本研究仍存在一定不足,如未统计远期疗效、样本量少,尚需临床扩大样本量,增加随访时间,进行深入研究。
综上可知,CT引导下氩氦刀冷冻消融术辅助治疗PHC患者,有助于降低CT灌注参数,提高疾病控制率,改善生活质量,机制可能与下调血中MMP-13、HIF-1α、VEGF、ICAM-1水平有关。

