DCE-MRI定量分析评估消癌平联合新辅助化疗治疗乳腺癌临床疗效及近期预后
1.武汉市东西湖区人民医院普通外科(湖北 武汉 430040)
2.武汉市第一医院消化内科(湖北 武汉 430022)
3.湖北省肿瘤医院微创介入科(湖北 武汉 430079)
盛 盼1 杨 林2 汪 婷3,*
乳腺癌是发生在乳腺上皮组织的恶性肿瘤,是目前发病率最高的女性恶性肿瘤[1]。临床上常对乳腺癌患者给予化疗药物治疗,化疗药物可破坏已生成的肿瘤血管,抑制新生血管的形成,有效缩小病灶。近年来常采用CT评价化疗疗效,但灵敏度偏低,无法对治疗结果做出准确判断[2]。动态增强核磁共振(dynamic contrast enhanced magnetic resonance imaging,DCE-MRI)能反映肿瘤内部微血管的血流动力学改变,其对乳腺癌的化疗反应性评估与组织病理学结果一致性较高,并且其可通过观察肿瘤体积的改变来判断治疗疗效[3]。本研究采用DCE-MRI定量分析消癌平联合新辅助化疗治疗乳腺癌的临床疗效,并分析其对乳腺癌患者预后的预测价值,旨在为乳腺癌的治疗提供参考依据。
1 资料与方法
1.1 临床资料选取2016年3月至2017年3月在我院治疗的乳腺癌患者93例,均为女性,年龄30~72岁,平均年龄(51.03±10.28)岁;肿瘤部位:左侧30例,右侧36例,双侧27例;组织学分级[4]:G1级41例、G2级28例、G3级24例。
纳入标准:符合《中国抗癌协会乳腺癌诊治指南与规范(2013版)》关于乳腺癌的诊断标准[5];经我院伦理委员会审核通过,患者知情同意且签署同意书;病理学检查结果为乳腺癌;均给予消癌平联合新辅助化疗治疗。排除标准:严重心肝肾功能异常者;本研究开始前已接受过化疗治疗者;不能耐受化疗治疗者;对本研究药物过敏者;其他原发性肿瘤患者;既往有乳腺癌手术史者。
1.2 方法1)DCE-MRI检测:所有患者治疗前及治疗3个疗程后,均采用超导MR扫描仪行DCE-MRI检查,于患者肘静脉处注射扎双胺对比剂0.2mmoL/kg,扫描时间为7min,扫描25个时相,将获得的图像导入软件产生伪彩图,并计算定量分析参数:容量转移常数(Ktrans)、速率常数(Kep)、血管外细胞外间隙容积比(Ve)。2)治疗方法:消癌平注射液(南京圣和药业有限公司,批号:国药准字Z20025868)60mL,加入250mL 5%葡萄糖注射液(山东科伦药业有限公司,批号:国药准字H37022922)中,静脉滴注,1次/d;于每个疗程第1天,给予多西他赛(浙江万马药业有限公司,批号:国药准字H20052318)75mg/m2、多柔比星注射液(浙江海正药业股份有限公司,批号:国药准字H20041318)50mg/m2、环磷酰胺(山西普德药业股份有限公司,批号:国药准字H20093032)500mg/m2,静脉滴注。
1.3 观察指标1)治疗3个疗程后,根据实体瘤疗效评价标准将患者分为治疗有效、无效两组[6],比较两组治疗前及治疗后Ktrans、Kep、Ve值。实体瘤疗效评价标准如下:比较治疗前及治疗3个疗程后肿瘤最长径变化情况,有效:化疗后肿瘤体积缩小>30%;无效:肿瘤体积缩小≤30%或出现新病灶。2)分析乳腺癌患者Ktrans、Kep、Ve值间的相关性及其与治疗疗效的相关性。3)治疗结束后,采用电话随访的方式对患者生存情况进行随访,随访时间为治疗后1个月、3个月、6个月、1年,2年,比较生存者和死亡组治疗2个疗程后的Ktrans、Kep、Ve值。4)采用ROC曲线分析Ktrans、Kep、Ve值对预后的预测价值,并计算曲线下面积(area under curve,AUC)。
1.4 统计学方法研究所得数据均用SPSS 17.0软件处理,计数资料采用χ2检验比较组间差异;计量资料用t检验比较组间差异;采用Spearman检验分析乳腺癌患者Ktrans、Kep、Ve值与治疗疗效的相关性;采用Pearson检验分析Ktrans、Kep、Ve值间的相关性;采用ROC曲线分析预测价值。P<0.05为差异具有统计学意义。
2 结 果
2.1 有效组、无效组治疗前及治疗后Ktrans、Kep、Ve值比较治疗3个疗程后,根据实体瘤疗效评价标准将患者分为有效组(n=61)、无效组(n=32)。两组治疗后Ktrans、Kep值低于治疗前,且有效组低于无效组(P<0.05);两组治疗前后Ve值对比无明显差异(P>0.05),见表1、图1。
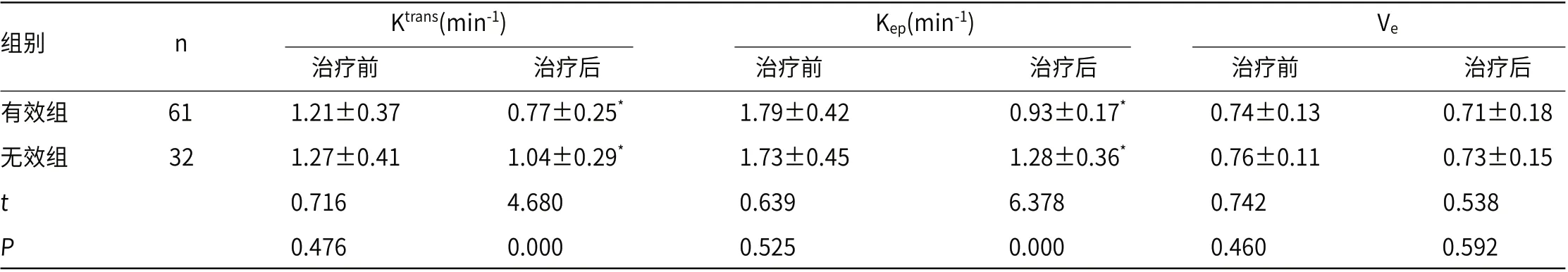
表1 有效组、无效组治疗前及治疗后Ktrans、Kep、Ve 值比较
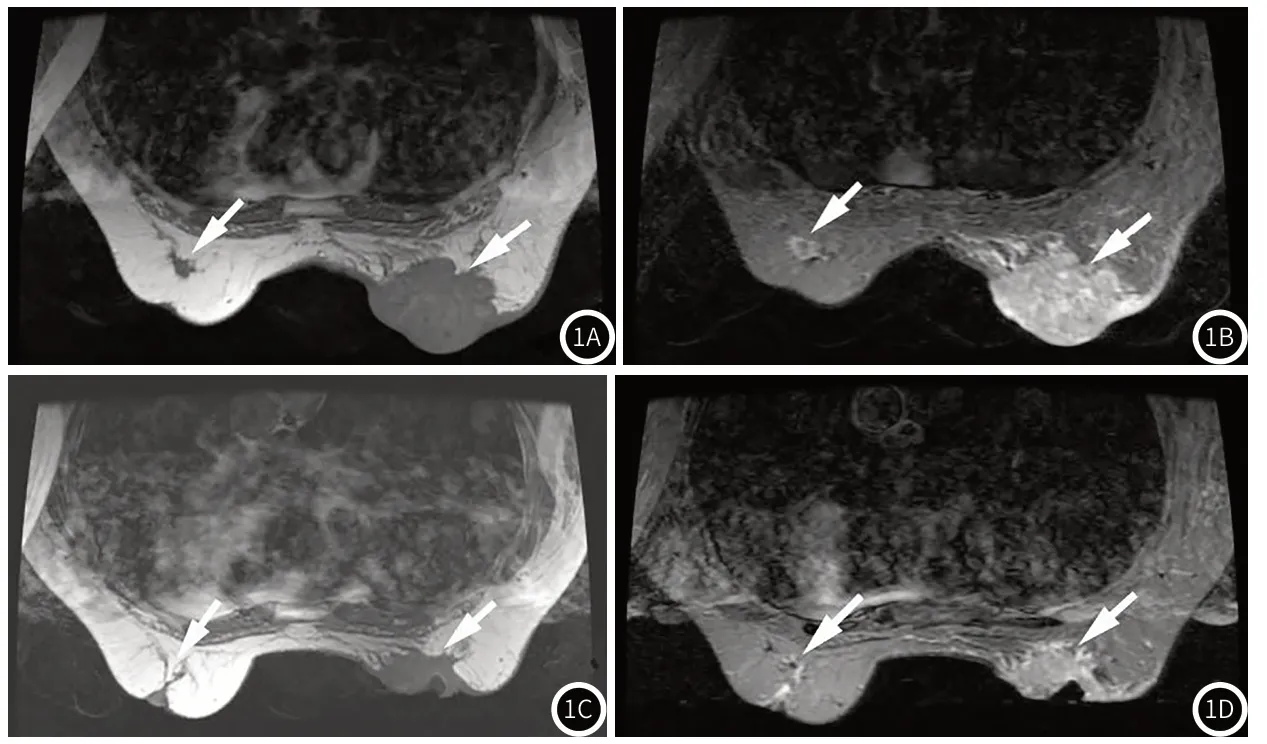
图1 病例:女,56岁,双侧乳房肿块,图1A~图1B为治疗前,肿块明显,病灶呈不均匀强化;图1C~1D为治疗后,可见双侧乳房瘤体变化明显,体积均有缩小,病灶内部强化减少。
2.2 乳腺癌患者Ktrans、Kep、Ve值间的相关性分析乳腺癌患者Ktrans与Kep值呈正相关(P<0.05),Ktrans、Kep值均与Ve值无相关性(P>0.05),见表2。
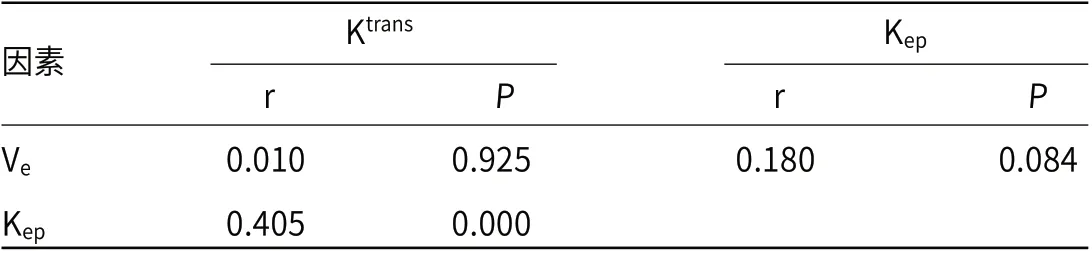
表2 乳腺癌患者Ktrans、Kep、Ve 值间的相关性分析
2.3 Ktrans、Kep、Ve值与治疗疗效的相关性分析Ktrans、Kep值与治疗疗效呈负相关(P<0.05),Ve值与治疗疗效无相关性(P>0.05),见表3。
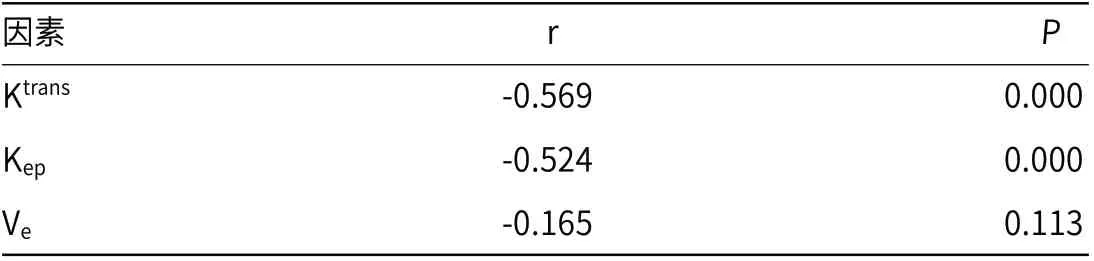
表3 Ktrans、Kep、Ve 值与治疗疗效的相关性分析
2.4 生存组和死亡组Ktrans、Kep、Ve值比较随访2年后,93例患者中共死亡15例,生存率为83.87%。生存组Ktrans、Kep值低于死亡组(P<0.05);两组Ve值对比无明显差异(P>0.05),见表4。
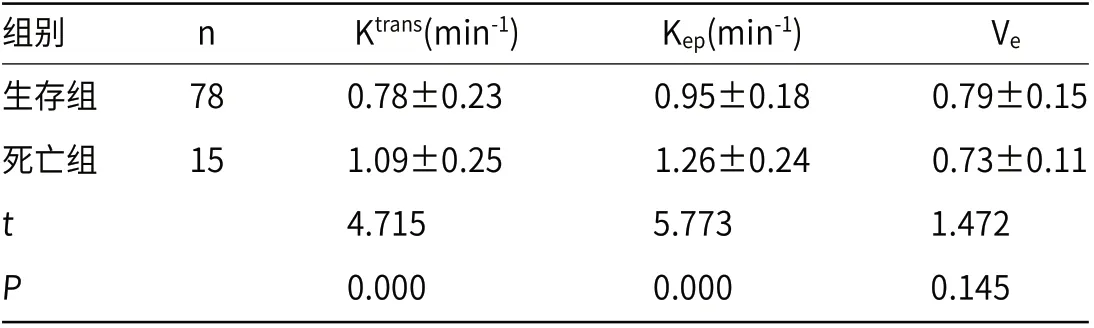
表4 生存者和死亡组Ktrans、Kep、Ve 值比较
2.5 Ktrans、Kep、Ve值对预后的预测价值分析经ROC曲线分析得,Ktrans、Kep值预测乳腺癌预后的AUC>Ve值(P<0.05),Ve的AUC与0.5无明显差异(P>0.05),见表5。
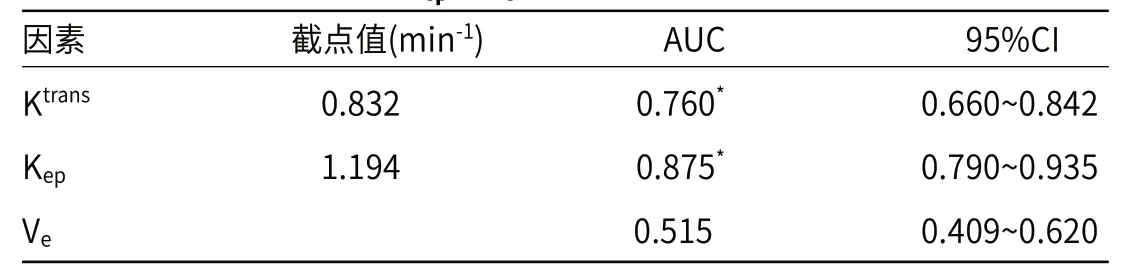
表5 Ktrans、Kep、Ve 值对预后的预测价值分析
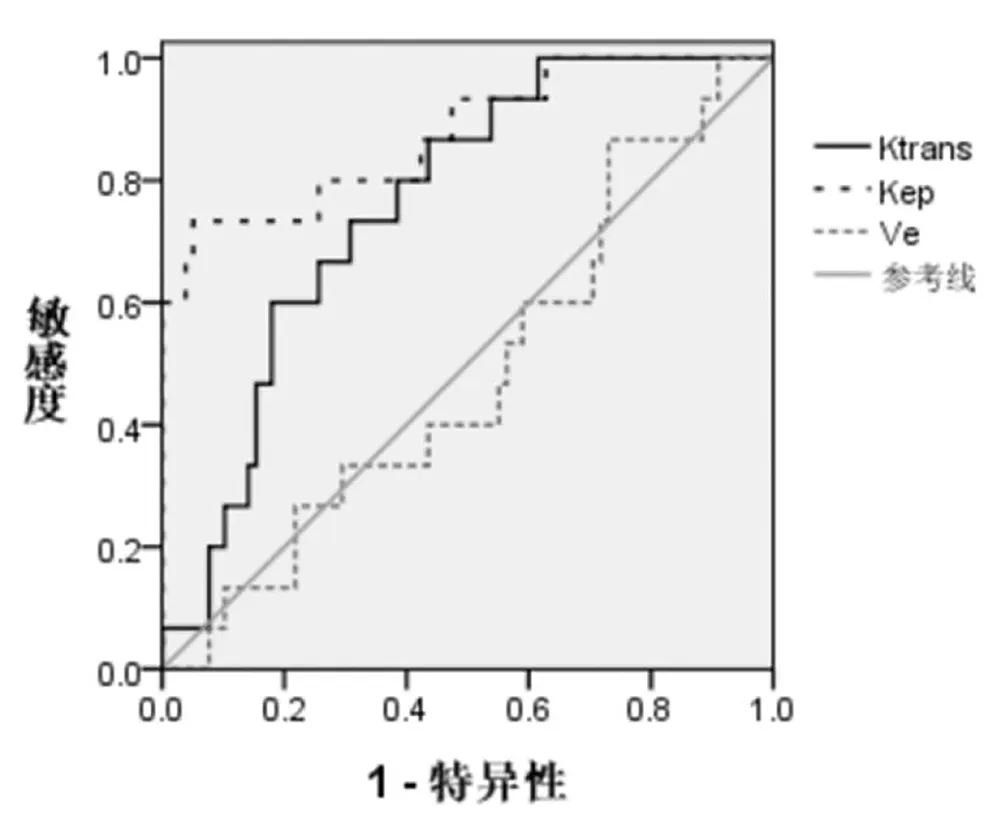
图2 Ktrans、Kep、Ve值预测预后的ROC曲线
3 讨 论
乳腺癌病灶的生长与浸润往往与癌组织血供密切相关,新辅助化疗药物可阻断乳腺癌病灶的血供以起到抑制肿瘤细胞生长的作用,消癌平与联合化疗时可抑制肿瘤细胞增殖,促进肿瘤细胞凋亡。Ktrans值是指造影剂从血管内扩散到血管外的速度;Kep值是指组织间造影剂经扩散重新回到血管内的速度[7-8]。在采用化疗药物进行治疗时,会减少肿瘤组织血流灌注及新生血管形成,降低细胞氧含量,从而起到破坏肿瘤细胞的作用。因化疗药物可抑制血管形成,降低血流速度,影响造影剂在病灶局部的聚集和渗出,从而导致Ktrans、Kep值降低[9]。本研究发现,有效组Ktrans、Kep值低于无效组(P<0.05),说明乳腺癌患者化疗有效者Ktrans、Kep值低于无效者,这提示可通过检测乳腺癌患者Ktrans、Kep值来评估治疗疗效。而患者化疗前后Ve值对比无明显差异,与杨秦等[10]的研究结果相同,说明患者在进行化疗前后Ve值无明显变化,这可能是因为肿瘤周围组织在治疗后出现组织水肿导致Ve值无明显变化。本研究经Pearson检验分析得,乳腺癌患者Ktrans与Kep值呈正相关,说明乳腺癌患者Ktrans值随着Kep值的升高而升高,这可能是因为Ktrans、Kep值能够反映肿瘤组织的血管分布及通透性、肿瘤组织强化特点,均与肿瘤组织血管形成有关。
DCE-MRI定量动态增强检查可以通过药代动力学模型,计算出具有生理学意义的定量增强参数,对乳腺癌病灶内的微血管灌注以及渗透情况的监测更加准确,并且其可通过对肿瘤组织血管内皮渗透性和血流增加的进行评估,来判断化疗后病灶肿瘤大小,从而可评估治疗疗效。阮立为等[11]指出,乳腺癌患者化疗后DCE-MRI定量参数Ktrans、Kep值与化疗疗效有关。本研究经Spearman检验分析得,Ktrans、Kep值与治疗疗效呈负相关(P<0.05),说明乳腺癌患者Ktrans与Kep值随着治疗疗效的升高而降低,这表示可通过检测乳腺癌患者治疗后Ktrans、Kep值来评估治疗疗效。Ve值是指血管外细胞间隙容积比,当患者进行化疗药物治疗时,血流灌注减少,肿瘤细胞被裂解,血管外细胞间隙增大,但因患者常在治疗后出现组织水肿的现象,从而可能会影响Ve值的变化。本研究发现,Ve值与治疗疗效无相关性(P>0.05),这说明无法通过检测乳腺癌患者治疗后Ve值来评估治疗疗效,与费莹等[12]、马焕等[13]的研究结果相同。
张绪良等[14]、熊发奎等[15]指出,乳腺癌患者化疗后2年生存者Ktrans、Kep值低于死亡者。本研究中,生存组Ktrans、Kep值低于死亡组(P<0.05),两组Ve值对比无明显差异(P>0.05),说明乳腺癌患者化疗后2年生存者Ktrans、Kep值低于死亡者,与上述研究结果相同,这表示Ktrans、Kep值与预后有关。李璞宸等[16]研究指出,乳腺癌DCE-MRI定量参数与预后因子相关,Ktrans、Kep值越高的肿瘤患者,肿瘤组织级别越高,预后越差。Ktrans、Kep值反映肿瘤血管分化和渗透性,参数值越大,血管分化程度越差、血管渗透性越高,血流灌注升高,恶性程度更大,预后越差。本研究经ROC曲线分析得,Ktrans、Kep值预测乳腺癌预后的AUC为0.760、0.875,说明Ktrans、Kep值对乳腺癌患者的预后具有较高的预测价值,这表示可通过检测患者化疗后等Ktrans、Kep值来预测患者的预后。另外,在进行化疗治疗后,乳腺癌患者的护理干预极为重要,将直接影响到患者的化疗疗效及预后,因此应根据患者的自身情况进行针对性的护理,从而可对预后起到良好的促进作用。
综上所述,DCE-MRI定量分析可通过提供肿瘤的生物学特征来预测消癌平联合新辅助化疗治疗乳腺癌的临床疗效,并且Ktrans、Kep对乳腺癌患者的预后具有较高的预测价值,可为乳腺癌的治疗提供临床依据。

