基于增强CT不同影像组学模型术前预测食管鳞状细胞癌分化的应用
蚌埠医学院第一附属医院放射科/蚌埠医学院影像学院(安徽 蚌埠 233000)
王瑞瑞 李 陆 丁晓云 石士奎*
食管癌是最常见的消化系统恶性肿瘤之一,全球发病率居第七位,死亡率居第六位[1]。在中国发病高危地区,食管鳞状细胞癌占所有食管癌病例的90%以上[2]。研究表明食管癌的病理分化与食管癌的生物学行为、临床肿瘤分期、治疗预后等密切相关[3-4]。影像组学高通量地提取病灶病理生理、生物学信息,利用机器学习建模等方法来量化肿瘤内在异质性,已应用于肿瘤良恶性鉴别、肿瘤分级、分期及治疗反映预测等[5-6]。基于此,本研究探讨增强CT不同影像组学模型预测食管鳞癌分化程度可行性及应用价值。
1 资料与方法
1.1 研究对象回顾性分析在2018年1月到2020年10月蚌埠医学院第一附属医院接受根治性手术治疗的食管癌患者的资料。纳入标准:经病理结果证实为食管鳞癌;在手术切除前不到两周进行增强CT检查。术前1周内进行血常规检查。排除标准:术前进行新辅助化疗或放疗;肿瘤因体积太小而显示不佳;临床资料不完整。收集病例数172例,男136例,女36例。依据病理结果,将患者分为两组:(1)分化良好组:高分化、中高分化、中分化;(2)分化不良组:中低分化、低分化。分化不良组58例,男45例,女13例;年龄56~88岁,平均年龄 (66.03±8.33)岁。分化良好组114例,男91例,女23例;年龄41~83岁,平均年龄(68.50±7.26)岁。两组患者年龄及性别差异均无统计学意义(P>0.05)。
1.2 临床资料收集患者临床资料,包括年龄、性别、肿瘤部位、术前血小板/淋巴细胞(the platelet to lymphocyte ratio,PLR)、中性粒细胞/淋巴细胞(the neutrophil to lymphocyte ratio,NLR)、淋巴细胞/单核细胞(the lymphocyte to monocyte ratio,LMR)指标。
1.3 扫描技术与图像获取使用GE 64排螺旋CT扫描仪检查,进行平扫、动脉期及静脉期增强扫描,扫描范围自环状软骨水平至贲门处。检查前禁食、禁水6h以上。扫描参数:管电流350mA,管电压120kV,层厚5mm,层间隔5mm。用高压注射器经肘静脉注射碘对比剂碘海醇,用量60~100mL,于造影剂注射后20、40s后分别采集动脉期、静脉期CT增强图像,扫描获得的CT图像上传至影像归档和通信系统,以 DICOM格式导出。
1.4 图像分割与特征提取将符合标准患者的图像导入医准-达尔文科研平台,手动勾画感兴趣区域(Region of Interest,ROI),画时选取病灶最大径进行勾画,避开液化坏死区域,见图1。将纳入的172例患者按3∶1随机分成训练集(129例)和测试集(43例)。通过上述软件提取其影像组学特征,为了提取更多的特征运用5个滤波器将部分原始图像变换成小波图像。
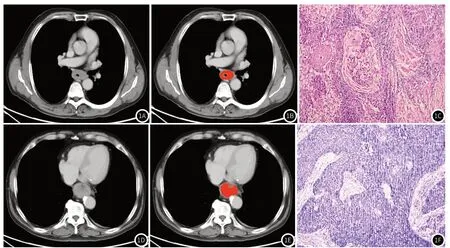
图1 图1A为中段食管癌患者静脉期CT图像,图1B为勾画肿瘤原发灶ROI区域,图1C为肿瘤病理图片(高分化食管鳞癌),图1D为下段食管静脉期CT图像,图1E为勾画肿瘤原发灶ROI区域,图1F为肿瘤病理图片(低分化食管鳞癌)。
1.5 特征筛选与模型构建为了避免减低计算速度,首先对提取出的特征采取最小、最大值归一化法把每一维度特征线性归一到(0,1)之间,归一化后的特征数据对训练影响甚微,不会影响预测的准确性,再进行最优特征筛选(Select K Best),去除低性能特征。在该步骤中,根据经验设置K为15%,并选择了f_calssif函数,即利用方差分析F检验统计量来选择按F值排序的前15%特征,最后采用最小绝对收缩和选择算子(the least absolute shrinkage and selection operator method,LASSO)进一步降维,减低维度和防止模型复杂性,得到最有价值的组学特征。将降维得到的特征分别选取支持向量机(support vector machine,SVM)、随机森林(random forest,RF)、Logistic回归模型,基于静脉期增强CT图像分别建立支持向量机、随机森林、Logistic回归三种模型。以5倍交叉验证训练选择食管鳞癌病理分化的性能最好预测模型。
1.6 统计学分析采用SPSS 25.0软件进行统计分析,检验临床定量数据(年龄、PLR、NLR和LMR)是否服从正态分布。满足正态分布计量资料采用()表示,非正态分布的计量资料采用M(P25,P75)表示,两组间比较采用t检验或Wilcoxon秩和检验。分类变量(性别、肿瘤位置)采用χ2检验比较。绘制三种模型训练集和测试集ROC曲线,分别计算其灵敏度、特异度和AUC,评价食管鳞癌分化程度的效能。
2 结 果
2.1 临床特征比较测试集与训练集临床特征差异均无统计学意义(P>0.05,见表1) 。
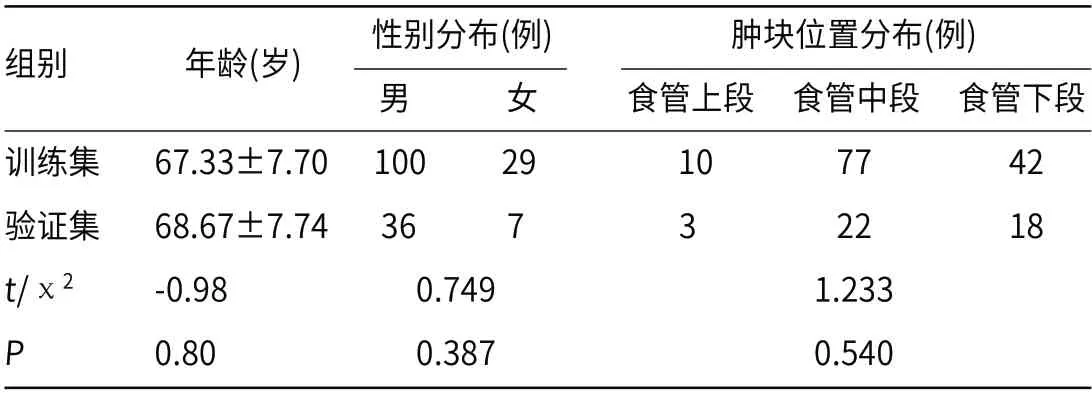
表1 测试集与训练集临床特征
2.2 不同分化程度患者血常规炎性指标比较不同分化程度的食管鳞癌患者的PLR、NLR和LMR指标差异均无统计学意义(P>0.05,见表2)。
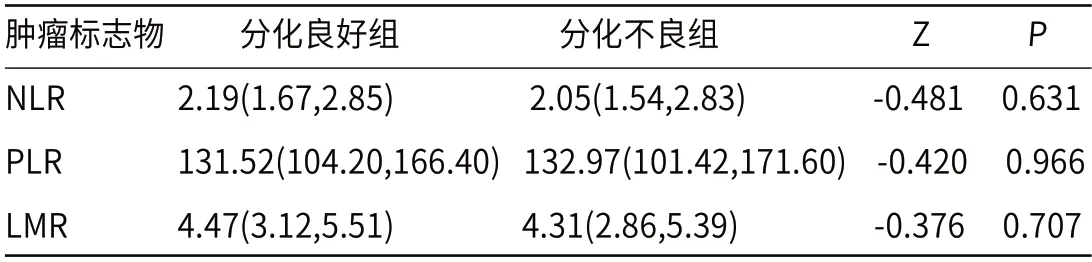
表2 两组不同分化程度食管鳞癌炎性指标比较[M(P25,P75)]
2.3 筛选组学特征和模型的诊断效能共提取939个组学特征。使用Select K Best算法对939个特征进行筛选,筛选出141个特征,最后使用LASSO算法筛选降维出8个最有价值的组学特征,见图2。支持向量机、随机森林、Logistic回归模型ROC曲线结果,见图3。在对不同影像组学模型进行训练与交叉验证后,分别得到三种影像组学训练集、测试集的灵敏度、特异度与AUC,具体数值,见表3。
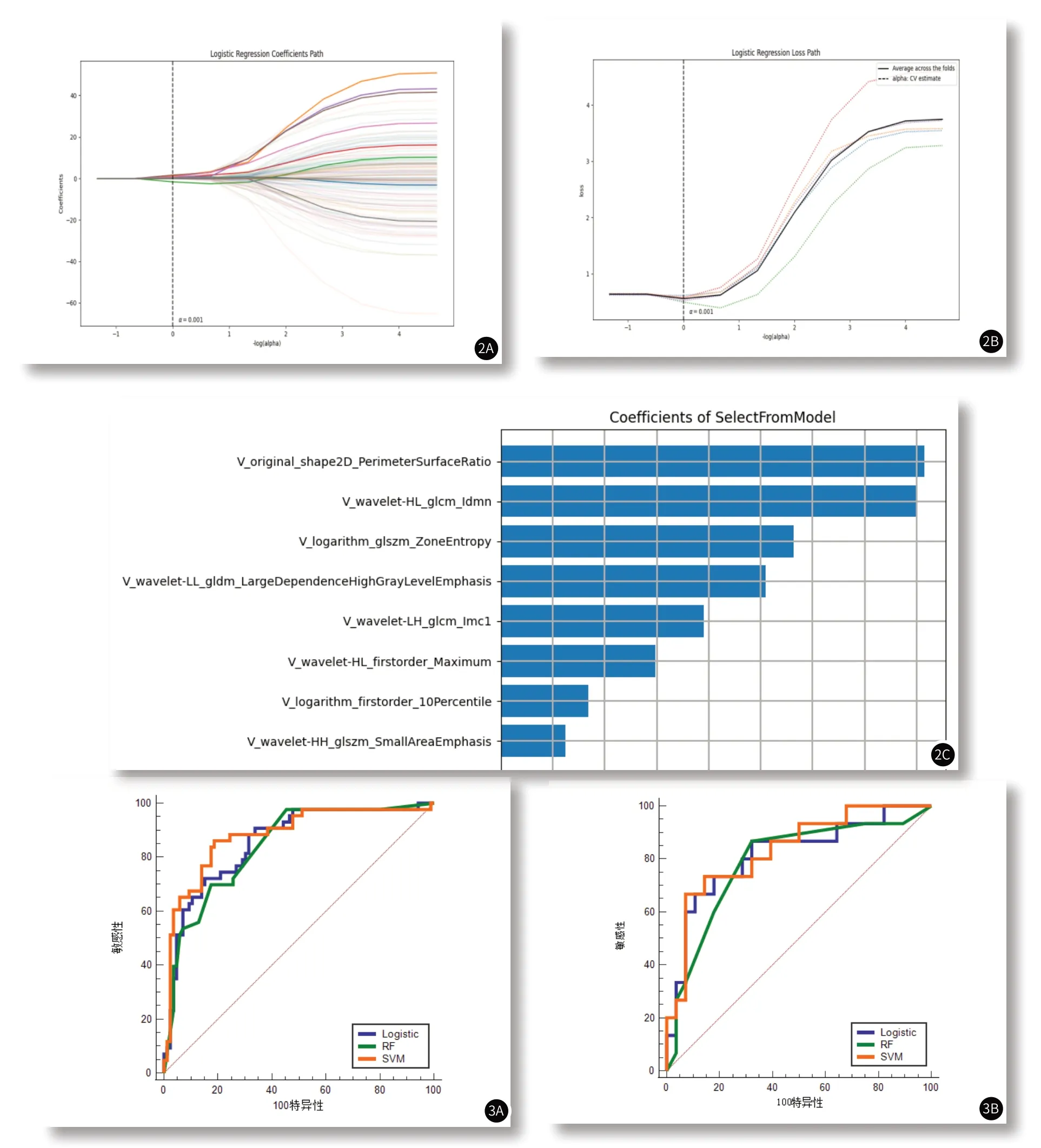
图2 图2A~图2C为LASSO逻辑回归特征选择的应用。图2A~图2B为5折交叉验证确定最优化处选取的log(alpha)值变量解析路径;图2C为静脉期LASSO,降维后8个与alpha值相对应最佳的特征。图3 SVM、RF、Logistic回归模型预测食管鳞癌ROC曲线。图3A~图3B:基于训练集(图3A)和测试集(图3B)组学模型。
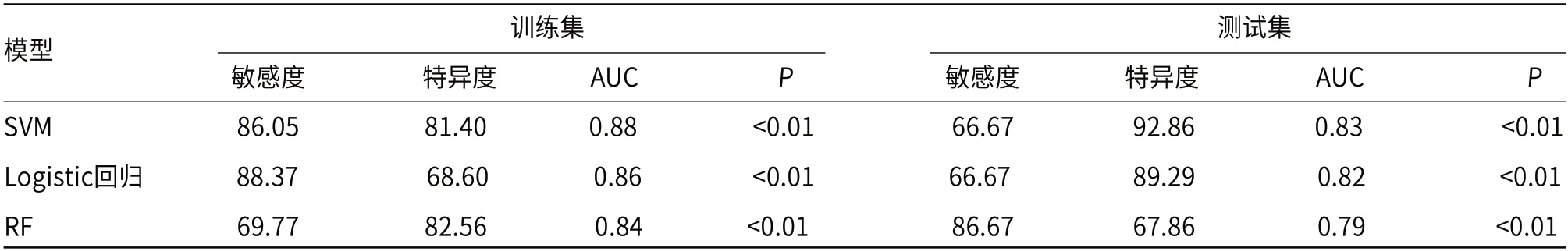
表3 SVM、RF、Logistic回归模型分别预测食管鳞癌分化程度ROC曲线结果
3 讨 论
食管癌是我国高发的恶性肿瘤之一,死亡率也较高[7]。目前临床上对食管癌治疗以外科手术为主,在最新八版的TNM分期标准中,新增加了食管癌分化程度的分期标准,术前评估其分化程度可以为临床治疗提供依据。与传统影像学利用宝石能谱CT、双源CT等[8-9]方法对食管癌分化程度进行研究相比,影像组学是一种非侵袭性、可反复使用的及时捕捉和反映潜在肿瘤内细胞密度、血管生成和坏死面积的差异(即肿瘤异质性)的一种检测手段。
目前,影像组学在食管癌临床应用主要体现在临床分期、放化疗疗效评估和预后分析[10]。本研究利用影像组学基于增强CT术前预测食管鳞癌病理分化,分别建立了SVM、RF、Logistic回归模型,三种模型AUC均大于0.7,提示都具有一定的诊断效能,证实了影像组学术前预测食管鳞癌分化可行性及价值,这与Wang等[11]的研究结果一致。本研究结果中SVM、RF、Logistic回归模型训练集和测试集AUC分别为0.88和0.83、0.84和0.79、0.86和0.82,三种模型都表现良好的诊断效能,可能是因为本研究主要针对静脉期CT图像进行特征提取筛选,静脉期反映更多功能障碍的新生血管,功能障碍新生血管的密度和通透性更高,使得较多对比剂滞留于肿瘤细胞间质间隙,病灶强化更丰富,较全面地凸显肿瘤的异质性与生物学特性,Chen等[12]也证实了这一点。此外,本研究结果显示,在同一增强CT图像上,不同机器模型诊断效能不同,其中SVM模型诊断效果表现最佳。SVM是常用于分类和回归的相关机器学习方法,尤其在维数大于样本数量的情况下表现出良好的性能,在较少训练样本情况下,可获得与大量训练样本几乎相同的准确度和精度[13-14]。例如,Yao等[15]通过构建支持向量机模型对肝内胆管癌分化程度和淋巴结状态进行预测,AUC分别达到0.89、0.90。Fan等[16]利用支持向量机模型区分胶质母细胞瘤和间变性少突胶质细胞瘤,其AUC超过了0.90。
在筛选8个影像组学特征,可分为四类:第一类形态学特征1个;第二类一阶统计量特征1个;第三类纹理特征1个:捕捉图像体素的空间相关性;第四类小波变换特征5个:从小波变换后的图像中计算出一阶和二阶特征。这些特征除形态学特征外都是医师视觉上不可察觉的客观的量化肿瘤的相关信息,通常反映肿瘤内在复杂的微循环与微环境病理生理信息。Deng等[17]研究发现肾癌的异质性与分级相关,粗滤波的高熵与高级别肾癌有关,熵与肿瘤细胞内部新生血管、缺氧等生物学行为密切相关,它是反映异质性的一个定量度量,熵越大,肿瘤异质性越高。这可能是本研究筛选特征中熵比重不低的原因。然而,本研究中一些影像组学特征的生物学意义仍未知,需今后进一步研究其潜在的意义。
此外,本研究尝试寻找不同分化组食管鳞癌患者术前PLR、NLR和LMR指标的相关性。这些指标来自血常规检查,具有易获取、患者创伤小、廉价等优点。一些学者认为PLR、NLR和LMR指标可能是食管癌等恶性肿瘤不良预后密切相关因子[18-19]。而在本研究中发现术前血常规炎性指标对于诊断不同分化程度食管鳞癌差异均无统计学意义,其原因可能是本研究样本量少或者是对血常规炎性指标的价值过于高估。
本研究存在的不足:(1)本研究为回顾性研究,只有接受根治性手术的病例被纳入研究对象,因此,可能存在选择偏倚;(2)纳入的病例数量存在一定局限性,今后进一步扩大相关病例收集并进行多中心研究;(3)本研究ROI分割采用静脉期CT图像轴位病灶最大层面进行二维分割,丢失了部分肿瘤信息。
综上,基于增强CT影像组学模型可以术前预测食管鳞状细胞癌病理分化,不同影像组学模型的诊断效能有一定影响,今后临床中可采用更适合影像组学模型,为临床医师提供参考。

