基于适配体变构的抗生素快速检测方法研究进展
董菡,胡书宜,袁雨霞,杜戎,郭芷妮,郭亚辉,姚卫蓉,钱和
(江南大学食品学院,食品科学与技术国家重点实验室,江苏无锡 214122)
抗生素是一类由微生物产生的具有抗病原体或其它活性的物质,可以干扰其它生物细胞的发育功能,抑制细菌的繁殖和代谢,从而达到杀菌的目的。抗生素滥用不仅会对水体和土壤等造成环境污染,还会提高抗性基因的频率,残留的抗生素会通过食物链的富集作用传递到人体[1],破坏人体的正常菌群,降低人体的免疫能力,对人体健康造成严重危害。适配体是一种对目标物有特异性识别作用、并可成为独特的二级结构或三级结构的单链DNA或RNA序列,它可利用体外指数富集配体系统进化技术制作。适配体可以通过其特定的三维结构与靶标高特异性、高亲和力地结合。传统的免疫学检测方法基于抗原抗体结合,制备周期长且成本高;仪器分析方法依赖于大型仪器设备,操作复杂且受空间限制。适配体作为新型的分子识别元件,具有热稳定性好、可长期保存、无免疫原性、活性均一、变性后可复性、无需实验动物等优点[2],是抗生素残留快速检测的良好途径。
适配体在抗生素残留检测中应用十分广泛,利用核酸适配体和目标抗生素特异性的识别作用,通过荧光/比色信号强度的变化实现对目标抗生素定量检测[3]。根据信号基团和适配体的作用方式,可分为标记型适配体和免标记型适配体。
标记型适配体是对适配体DNA的一端或两端标记信号分子(通常为有机小分子荧光染料、荧光纳米材料、纳米金等)。靶标与适配体结合后,适配体结构发生变化,影响了信号分子之间的相互作用或信号分子与基底的相互作用,从而产生光学信号。例如,通过贵金属纳米颗粒的等离子体效应和催化底物显色实现检测信号的输出[4],检测结果肉眼可见,且可实时检测。
免标记适配体是将信号分子通过非共价的形式结合到特定的DNA结构上,因为信号分子的结合对适配体结构具有依赖性,使得适配体只有在与靶标物质结合、形成特定的DNA结构后,荧光/比色信号才会变化。相较于标记型适配体,免标记型适配体在构筑中无需耗时的探针标记和纯化步骤,成本低廉,易于设计和操作,且降低了适配体传感器制备的批间差异[3],避免了信号标记甚至有害放射性物质的结合和纯化[5]。免标记适配体是目前适配体检测技术的热点研究方向之一。
1 标记型适配体
标记型适配体需在DNA上标记信号分子,当适配体与待测物质结合后,影响信号分子之间或信号分子与基底的相互作用,导致光信号产生变化。常用方法有比色法和荧光法两类。
1.1 比色法
在众多分析检测方法中,比色法以其肉眼可见的检测结果、无需复杂设备且易于实现即时检测等优点而受到广泛关注。目前,基于比色适配体传感器检测抗生素主要通过贵金属纳米颗粒的等离子体效应和催化底物显色实现检测信号的输出。
因为硫基团与金有较强的共价结合力,故常用的比色法适配体多利用巯基对适配体或其互补链进行修饰,通过共价偶联的方式固定到纳米金表面(如图1)[6]。适配体探针上的核苷酸序列分别与靶物质配对,即可在金粒子上连接多条寡核苷酸链,当金探针按序与靶DNA连接后,即能有序地形成网状结构,而纳米金颗粒将因此而发生颜色变化。刘丽红等[7]设计了基于适配体比色法的霉菌毒素快速灵敏检测试纸条,其中试纸条结合垫上固定的通过巯基连接的胶体金标记适配体(Aptamer 1)探针,层析膜检测线是通过链霉亲和素固定的Aptamer 1识别序列的互补序列DNA 1,质控线是通过链霉亲和素固定的Aptamer 1非识别序列的互补序列DNA 2。结果显示,该适配体试纸条可成功检测霉菌毒素含量,检出限为0.1 μg/mL。该类抗生素检测的适配体试纸条解决了免疫层析试纸条在抗体制备时价格高昂、不易保存、制备周期长等问题,在抗生素快速检测领域具有广泛的应用前景。

图1 纳米金在DNA 识别与检测中的变色过程
1.2 荧光法
构建标记型荧光适配体传感器需对传感器探针进行荧光标记。TAN等[8]利用氧化石墨烯(GO)的水溶性、优异的荧光猝灭能力和易于合成等优点,设计了一种基于GO水凝胶的荧光法测定氧四环素。该实验将GO片、腺苷和荧光素标记的适配体物理混合在一起制备GO水凝胶,其中腺苷和适配体作为交联剂来连接GO片,形成三维宏观结构。在最佳条件下,开发的荧光生物传感器具有25~1 000 μg/L的线性范围,检测限低至25 μg/L。但相较于荧光纳米材料,荧光染料存在抗光漂白性差的缺点,其荧光性能易受外界因素影响。
量子点(QDs)又称为半导体纳米颗粒,是由II~VI族或III~V族元素组成的新型荧光纳米材料,是目前常用的新型荧光标记物[9]。具有易于制备和修饰的性质及良好的信号放大作用等优点。Alibolandi等[10]建立了基于碲化镉量子点标记的适配体(CdTe QDs-Apt)和GO的氯霉素检测传感器。适配体与氯霉素发生特异性结合,能量从QDs-Apt转移到GO,有效地淬灭了CdTe QDs-Apt的荧光,通过回收淬灭荧光可以检测出氯霉素。结果表明,向250 μg/mL GO溶液中添加CdTe QDs-Apt可得到较高的荧光猝灭效率,产生超过90%的荧光猝灭。使用0.1~10 nmol/L系列浓度氯霉素溶液的适配体传感器,检测限和定量限分别为98、987 pmol/L。
Shim等[11]开发了基于黄曲霉毒素(AFB1)的核酸适配体半试纸条,实现了对AFB1的半定量检测。其思路是AFB1适配体用生物素标记,在检测线处固定的是链霉亲和素,用来与生物素结合,控制线处固定的是抗Cy-5荧光染料的抗体,最后利用荧光进行检测。采用竞争法,在生物素修饰的适配体、靶标AFB1、Cy-5标记的适配体互补序列探针混合物溶液中插入试纸条,适配体互补序列探针、靶标AFB1两者与适配体发生竞争反应,随着溶液的渗移,在检测线处结合的有生物素标记的适配体与靶标复合物,还有生物素标记的适配体与Cy-5标记的互补序列复合物,检测线处荧光强度与靶标的含量呈负相关,检测原理如图2所示。这种试纸条利用荧光强度来确定AFB1的检出限为0.1 ng/mL,在玉米样品溶液中的检出限为0.3 ng/g。

图2 荧光染料标记适配体检测黄曲霉毒素原理图
2 免标记型适配体
免标记型适配体不需要化学键合信号分子[12],免去了染料和材料的结合和纯化,且易于设计、操作简便,与标记型适配体相比价格低廉,是理想的抗生素快检途径。
2.1 比色法
纳米粒子由于具有极强的吸附力和较好的生物相容性而被广泛应用于适配体生物传感器的构建。其中金纳米粒子(AuNPs)是迄今研究和使用最多的金属纳米粒子之一。AuNPs溶液也称胶体金溶液,是一种带负电的胶体溶液,在静电斥力作用下具有良好的稳定性。但在高盐溶液中,AuNPs的稳定性会遭到破坏而发生聚集,该过程中溶液也会由酒红色逐渐加深至蓝色或灰色,从而被广泛用于建立基于AuNPs的比色分析法(原理如图3所示)[13]。该方法利用灵敏的颜色变化来检测靶分子,具有可视化、简便快捷、灵敏度高等优点。
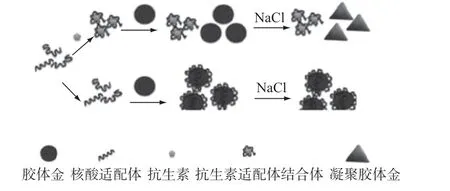
图3 基于适配体和纳米金的比色法检测原理
Zhou等[14]提出了一种测定氧氟沙星(OFL)水溶液中抗生素含量的比色法,它是基于适配体和AuNPs结合原理。在没有OFL的情况下,AuNPs被适配体包裹,即使在高NaCl浓度下也能保持分散。胶体分散AuNPs的溶液保持红色,并在520 nm处出现吸收峰。在OFL存在的情况下,它将与适配体结合,然后从AuNPs中释放适配体。因此,AuNPs会在盐溶液中聚集,使颜色逐渐变蓝,在650 nm处出现新的吸收峰。此方法在OFL浓度为20~400 nmol/L的范围内具有线性响应,检出限为3.4 nmol/L。
2.2 荧光法
非标记型荧光适配体中使用的荧光染料原理与标记型不同。非标记荧光适配体是将荧光染料通过非共价的形式结合到特定的DNA结构上,并且只有在与靶标物质结合、形成特定的DNA结构后,荧光才会增强。Yang等[15]建立了一种基于N-甲基吗啡啉(NMM)/G–四链体结构的卡那霉素检测的免标记荧光策略。在没有卡那霉素的情况下,两个ssDNA(如图4)相互杂交,阻碍了P1(5’-GGGTTTTGGGTCGGCTTAGCCTCAACCCCC AGGGTTTTGGG-3’)形成G-四链体结构。因此,即使添加了NMM,也无法检测到荧光增强。当添加卡那霉素时,它将以高亲和力特异性结合P2(5’-TGGGGGTTGAGGCTAAGCCGA-3’),导 致P1从P1–P2复合物中释放。处于游离单一状态的P1可以通过自身折叠并结合NMM形成G-四链体DNA结构,从而显著增强荧光。实验表明通过向P1–P2复合物中添加卡那霉素确实导致荧光强度急剧增强。因此本策略对于检测卡那霉素是切实可行的。
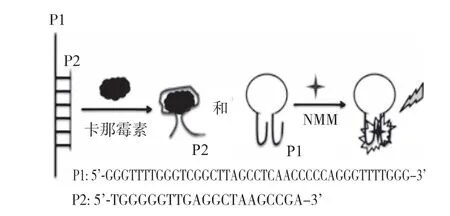
图4 基于NMM/G–四链体结构的卡那霉素检测过程示意图
纳米银簇(AgNCs)作为一种新型荧光纳米材料吸引了广泛关注[16],尤其是以DNA为模板合成的银纳米簇,它可以同时具备发光功能和识别功能,避免了以往荧光探针制备中复杂的荧光分子标记过程和识别分子修饰过程[17]。林碧霞等[18]建立了一种基于DNA模板合成的银纳米簇检测卡那霉素的荧光方法(如图5)。

图5 银纳米簇检测卡那霉素的原理图
当加入目标物质卡那霉素时,适配体DNA序列识别卡那霉素形成发夹结构,使更多的G、C碱基靠近银簇序列,同时引起DNA二级结构发生变化,使银纳米粒子的粒径变小,导致银簇荧光增强。且增强的荧光比值与卡那霉素浓度呈良好的线性关系,可据此进行卡那霉素的定性、定量检测。此外,该方法虽比用罗丹明B、荧光素、CdTe 作为发光元件所建立的方法检出限高,但本方法的线性范围更宽,且试剂毒性更低。
目前最常见的dsDNA结合染料包括溴化乙锭,碘化丙啶、Hoechst染料SYBR Green I(SG I)花青染料等[19]。SG I于1994年开发,用于凝胶中的DNA染色,此后一直被广泛用于生物分析[20],因为它具有两个优异的特性:可与dsDNA选择性结合和信噪比较高[21]。Su等[22]开发了一种无标记生物传感器,将SG I作为信号输出的荧光指示剂来扩增检测核酸。靶标的存在释放了探针DNA的引物结合部分,并触发了聚合酶辅助的循环聚合反应,从而产生了大量dsDNA产物,也使SG I的荧光强度得到大幅提高。该生物传感器可用于靶标抗生素的检测。
Yang等[23]利用二维有机纳米框架(Cu-TCPP纳米片)对单、双链DNA不同的吸附特性,开发了一种基于信号放大技术的免标记荧光适配体传感器检测氯霉素。氯霉素可打开适配体探针的发卡结构,在DNA聚合酶的辅助作用下通过循环链置换反应产生大量的双链DNA,双链核酸染料SYBR Green I嵌入其中,可产生强烈荧光。未参与扩增的发卡被吸附于Cu-TCPP 纳米片上,有效地降低了方法的背景荧光信号,检出限可低至0.3 pg/mL。
3 展望
随着对适配体的不断研究探索,利用其对抗生素进行定性或者定量的分析方法取得了巨大的进展,为食品中抗生素残留的快速检测提供了新的途径。基于荧光法和比色法的适配体传感器是目前应用最广泛的适配体传感器之一,优点在于适配体所用实验材料廉价易得,对大分子亲和力强,筛选过程简单,靶标范围广,稳定性好,易被活性或指定基团修饰。表1为两类型适配体的原理、优缺点比较,表2为基于荧光法与比色法的适配体的原理、优缺点和适用范围比较。

表1 标记型和免标记型适配体的原理与优缺点

表2 荧光法和比色法适配体原理与优缺点
总之,标记型适配体需结合信号分子,反应快速,具有高辨别能力,但相较于免标记适配体所需成本较高且应用不够灵活;免标记型适配体是目前抗生素的快速检测研究的热门,因为能够省略探针标记和纯化步骤,使制作周期缩短,降低了标记适配体探针的批间差异,避免了有害放射性物质的结合和纯化,但可能出现非特异性吸附而产生假阳性信号的问题,这也是检测复杂样品中抗生素残留的重要挑战。目前有研究显示,采用双信号模式的免标记适配体可以很好地避免此类问题,依靠G-四链体与染料结合特性和DNA变构原理,使用两类免标记荧光染料,在抗生素目标物出现和未出现时与不同染料结合,发出不同颜色荧光,据此建立针对抗生素的双信号荧光适配体快速检测技术,具有简单、经济、省时的优点[24]。

