术前纤维蛋白原与白蛋白比值对胆囊癌术后总生存期的影响
刘成欣,马秀现
(郑州大学第一附属医院 肝胆外科,河南 郑州 450052)
胆囊癌(gallballder cancer,GBC)是胆道系统最常见的恶性肿瘤,占胆道系统恶性肿瘤的80%~95%[1]。我国GBC的发病率为(1.00~1.30)/10万,近年来发病率无明显升高[2]。虽然GBC的发病率低,但由于其恶性程度高,发病初期常常无明显症状,当症状出现时,多已达中晚期,预后差,并且目前对该疾病缺乏有效的诊疗手段。临床常用TNM分期作为判断患者预后的常用指标,但确定患者的TNM分期需要术后完整病理结果,无法为术前治疗方案的制定提供参考。同时,也会出现相同分期的GBC患者的术后生存时间存在差异的情况。因此,有必要综合其他方面的检查对患者进行综合评估,以此准确评估患者的预后。术前纤维蛋白原与白蛋白比值(fibrinogen to albumin ratio,FAR)作为评估肿瘤预后的标志物,已被证实与胃癌、肝癌、肾癌、乳腺癌等多种肿瘤的预后相关[3-6]。本研究通过回顾性搜集GBC患者的入院诊断、实验室检查结果及随访信息,以确定不同FAR水平下患者预后总生存期(overall survival,OS)的差异,为胆囊癌的临床诊治工作提供参考依据。
1 资料与方法
1.1 一般资料回顾性收集2013年1月至2017年8月郑州大学第一附属医院收治的80例GBC患者的临床病理资料。纳入标准:(1)接受GBC根治术;(2)术中快速冰冻病理结果或术后病理结果诊断为GBC;(3)病历资料完整,包括年龄、性别、术前实验室检查结果、术后病理报告。排除标准:(1)合并其他肿瘤;(2)心、肝、肾功能不全;(3)术前接受过放化疗;(4)合并血液系统疾病。记录观测指标包括:性别、年龄、纤维蛋白原、白蛋白,OS等。本研究通过郑州大学第一附属医院医学伦理委员会审核批准。
1.2 随访门诊或电话进行随访。以患者死亡为终点事件,总生存时间定义为手术日期距因肿瘤而死亡或末次随访日期的时间,以月为基本单位,了解患者预后的生存情况。随访截至2020年8月31日。
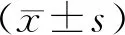
2 结果
2.1 临床特征本研究共纳入80例GBC患者,其中男36例,女44例;年龄40~84岁,平均(64.2±9.1)岁;术前平均白蛋白质量浓度为(39.5±4.1)g·L-1,术前平均纤维蛋白原质量浓度为(3.6±1.0)g·L-1;术后1、2、3 a生存率为41.3%、30.3%、22.5%,术后中位OS为12.8个月(95% CI为10.2~15.6个月)。
2.2 FAR最佳临界值的的确定以术前FAR为检验变量,OS为状态变量,通过FAR的ROC曲线分析可得,FAR曲线下面积(area under curve,AUC)为0.694(0.573~0.815),当约登指数最大时,对应的FAR截取值为0.086,灵敏度为64.8%,特异度为73.1%。因此,将0.086作为FAR最佳临界值。见图1。

FAR为纤维蛋白原与白蛋白比值;GBC为胆囊癌;ROC为受试者工作特征曲线。
2.3 术前不同FAR水平GBC患者的生存曲线分析根据ROC曲线截取的术前FAR最佳临界值,将GBC患者分为低水平组(FAR≤0.086)和高水平组(FAR>0.086)。对比两组生存曲线可见,低水平组患者的术后OS高于高水平组患者。见图2。低水平组的患者术后1、2、3 a生存率为58.6%、49.2%、38.3%,术后中位生存时间为17.1个月(95% CI为12.0~22.5个月)。高水平FAR组的患者术后1、2、3 a生存率为25.7%、9.1%、9.1%,术后中位生存时间为9.0个月(95% CI为6.7~11.6个月)。删失患者均死于肿瘤复发,两组术后OS比较,差异有统计学意义(P=0.001)。

FAR为纤维蛋白原与白蛋白比值;GBC为胆囊癌。
3 讨论
目前,根治性切除术仍是治疗GBC且是唯一有希望治愈GBC的治疗手段[7],尽管近些年来针对GBC的发病机制及潜在治疗靶点的相关研究已经取得了一定的进展,但对于GBC的临床治疗仍然缺乏规范的综合治疗方案[8-9]。有研究报道,接受胆囊癌根治性切除的患者5 a生存率仅为25.4%[10]。而本研究中,80例GBC患者术后的1、2、3 a生存率分别为41.3%、30.3%、22.5%,整体术后中位OS为12.8个月(95% CI为10.2~15.6个月),与其研究结果基本一致。对比不同FAR水平下的GBC患者的生存曲线可见,低水平FAR组患者术后OS高于高水平FAR组的患者。低水平FAR组患者术后1、2、3 a生存率为58.6%、49.2%、38.3%,术后中位OS为17.1个月(95% CI为12.0~22.5个月)。高水平FAR组患者术后1、2、3 a生存率为25.7%、9.1%、9.1%,术后中位OS为9.0个月(95% CI为6.7~11.6个月)。可见,术前低水平的FAR术后能够获得较长的OS。产生这种差异的原因,推测是肿瘤自身的发生、发展引起机体内发生了相应的变化。有研究证实,纤维蛋白原作为反映机体凝血功能的一项临床指标,其血浆水平的升高与疾病的进展有关,肿瘤细胞能够通过合成和分泌纤维蛋白原为自身的生长提供适宜的微环境,从而促进原发肿瘤的发生、发展[11]。同时,血浆纤维蛋白原也可通过阻碍自然杀伤细胞对血管内肿瘤细胞的清除作用,增强肿瘤的转移潜能[12]。也有研究显示,GBC患者的血浆纤维蛋白原水平高于胆囊炎患者,且在GBC患者中,伴有高纤维蛋白原的患者术后中位OS短于血浆纤维蛋白原水平正常的患者[13-14]。以上研究表明,纤维蛋白原对恶性肿瘤的发生、发展过程起促进作用,其血浆水平对GBC的进展及预后均有一定的参考价值。术前白蛋白水平作为临床上评估患者营养及免疫状态的常用指标,当其低于正常值时,与术后并发症的发生、死亡率升高密切相关[15]。因此,术后关注患者的营养状况对改善患者预后同样具有重要的意义[16]。基于以上研究,我们了解到恶性肿瘤的产生和发展会引起机体凝血功能及营养状况的改变,这一变化的出现最终导致FAR数值的增大。FAR作为一种肿瘤预后标志物,能够综合患者的凝血功能与营养状况,在评估恶性肿瘤术后OS中具有一定的价值。因此,术前关注患者FAR水平,制定个体化的治疗方案,有助于改善患者的预后,延长患者术后OS。其作为一种简单易得的临床指标,在评估GBC患者术后OS中有一定的优势。
本研究分析了不同FAR水平下的GBC患者术后生存情况,探讨了FAR作为一种临床指标预测患者术后生存时间的价值。结果显示,术前FAR低的GBC患者的OS较FAR高的GBC患者的OS长。但是,本研究为小样本单中心的研究,且未考虑患者术后辅助化疗及靶向治疗对胆囊癌术后OS的影响。未来还需要进行多中心的大样本研究,以便得到全国的数据,从而能够准确反映不同FAR水平患者的术后生存情况。

