万寿菊中叶黄素的超高压提取工艺优化
刘冰雪 王玲玲 张晓雪 耿宇婷 康荷笛 赵修华

摘 要:为研究万寿菊中叶黄素的提取工艺,本研究以东北万寿菊花为提取原料,采用超高压法提取万寿菊花中叶黄素并对其提取工艺进行优化。采用单因素和响应面实验,考察了4种不同因素料液比、提取次数、保压时间及提取压力对叶黄素提取率的影响,最终得到最佳提取工艺条件为:料液比为1∶95.21(g/mL),提取次数为4次,保压时间为3 min,提取压力为200 MPa,在此条件下进行3次重复实验,得到叶黄素实际提取率可达(68.57±2.31) mg/g,与预测值69.38 mg/g一致。与热回流提取法和微波-超声协同提取法相比,超高压技术提取万寿菊花中叶黄素的提取率可以显著提高。研究结果表明,超高压技术提取万寿菊花中的叶黄素提取稳定性好、工艺合理可靠,并且重复性强,可广泛应用。
关键词:万寿菊;叶黄素;超高压提取;工艺优化;响应面
中图分类号:R914 文献标识码:A 文章编号:1006-8023(2021)04-0071-08
Optimization of Ultra-High Pressure Extraction Process
for Lutein from Marigold
LIU Bingxue, WANG Lingling, ZHANG Xiaoxue, GENG Yuting, KANG Hedi, ZHAO Xiuhua*
(College of Chemistry, Chemical Engineering and Resource Utilization, Northeast Forestry University, Harbin 150040, China)
Abstract:In order to study the extraction technology of lutein from marigold, this study used northeast marigold as raw material to extract lutein from marigold by ultra-high pressure method and optimized the extraction technology. The single factor experiment and response surface were used to investigate the effects of four different extraction methods, such as solid-liquid ratio, extraction times, holding time and extraction pressure, on the extraction yield of lutein from marigold. Finally, the optimal extraction conditions were obtained as follows: the solid-liquid ratio was 1∶95.21(g/mL), the extraction times was 4 times, the pressure holding time was 3 min, and the extraction pressure was 200 MPa. Under these conditions, the experiment was repeated for three times. The actual extraction yield of lutein was( 68.57±2.31)mg/g, which was consistent with the predicted value of 69.38 mg/g. Compared with thermal reflux extraction and microwave-ultrasonic extraction, the extraction rate of lutein from marigold could be significantly improved by ultrahigh pressure extraction. The results showed that the ultra-high pressure extraction of lutein from marigold was stable, reliable and reproducible, and could be widely used.
Keywords:Marigold; lutein; ultra-high pressure extraction; process optimization; response surface
收稿日期:2021-03-12
基金項目:黑龙江省杰出青年基金项目 (JC2018005)
第一作者简介:刘冰雪,硕士研究生。研究方向为药物化学。E-mail: 792224304@qq.com
*通信作者:赵修华,博士,教授。研究方向为植物化学与植物药。E-mail: xiuhuazhao@nefu.edu.cn
引文格式:刘冰雪, 王玲玲, 张晓雪, 等. 万寿菊中叶黄素的超高压提取工艺优化[J].森林工程, 2021,37(4):71-78.
LIU B X, WANG L L, ZHANG X X, et al. Optimization of ultra-high pressure extraction process for lutein from marigold [J]. Forest Engineering,2021,37(4):71-78.
0 引言
叶黄素是自然界中的一种天然色素,属类胡萝卜素家族,分子内含有多个不饱和双键,从而使其具有较强抗氧化性[1]。叶黄素具有诸多的药理活性,包括预防和治疗多种疾病(黄斑病变、青光眼等)有重要作用[2],同时也可以增强老年人的认知能力。研究显示,在老年人血清中叶黄素含量越高,海马旁区灰质越厚,认知能力测试表现越好[3]。Cheng 等[4]利用 HPLC 法测定了 8 个万寿菊品种的叶子和花瓣中所含叶黄素的量,研究表明,叶黄素主要存在于万寿菊的花瓣中,花瓣中叶黄素的含量是花叶中的 20 倍。万寿菊原产于墨西哥,现如今遍及中国各地。万寿菊在东北分布更为广泛,常做路边观赏花卉[5]。
由于葉黄素用途广泛,对其研究愈加深入。已研究的提取方法有热浸提法[6]、超声-微波辅助提取法[7]、酶提取法[8]、超临界萃取法[9]等。热浸提法因为提取温度高,容易热解易失活。超声-微波辅助提取法具有高效率的优点,但工业批量生产难以实现。酶提取法其操作虽然简单,但耗时过长的缺点无法解决。超临界萃取法,虽得到提取物的纯度高,但设备造价高、操作难度大、耗能高及提取成本高等缺点至今无法克服。超高压提取技术其原理为:其媒介为水或流体,在一定时间用较大的压强(≥100MPa)去破坏植物细胞壁,释放目标活性物质[10]。与其他技术相比,超高压技术具有耗能低、提取时间短、效率高以及对生物活性影响小等优点[11]。李彦炜[12]采用超高压技术,对黄精多糖进行提取,最终提取率高达74.14%,同时,苏可盈等[13]提取黑茶中的物质采用了超高压和热回流2种提取方法,结果显示,超高压提取法提取率为13.57%~14.22%,高于热水提取法的提取率(10.45%~12.45%),超高压法提取结果优于传统热回流法。综上所述,超高压技术提取是一种有效的提取手段。目前,超高压法提取叶黄素的方法还未曾报道。本实验以万寿菊为原料,以叶黄素提取率为评价指标,以单因素实验结果为前提, 确定响应面优化参数,实现对超高压法提取万寿菊中叶黄素的工艺优化。
1 研究方法
1.1 材料
万寿菊干花购于河北省安国市御颜坊中药材有限公司,产地为河北。叶黄素标准品(90%)购于上海源叶生物科技有限公司;无水乙醇(分析纯) 、丙酮(分析纯)、乙腈(色谱纯)和正己烷(分析纯) 购于天津市致远化学试剂有限公司;乙酸乙酯(分析纯) 购于瑞达化工商行化工有限公司;甲醇(色谱纯) 购于山东禹王实业有限公司;去离子水为实验室自制;真空密封袋(16丝)购于河北永贺塑料包装制品有限公司。
1.2 仪器与设备
HPP.W1-400/1 超高压设备:天津华泰森淼生物工程技术股份有限公司;标准筛 60目;2489 型高效液相色仪:美国 Waters 公司;旋转蒸发器:德州市昊诚实验仪器有限公司;P-290 真空封口包装机:瑞安市贵泽电子商务商行。
1.3 方法
1.3.1 超高压提取流程
万寿菊干花粉碎后过60目筛。称取1 g粉末于密封袋中,并加入一定体积(料液比为1∶20~1∶120 (g/mL))的试剂(氯仿、乙酸乙酯、正己烷、甲醇和乙醇)于密封真空袋,混匀放入提取容器中。调节参数值(提取压力:50~300 MPa;保压时间:1~6 min;提取次数:1~6 次)进行提取。取出高压处理后的料液,抽滤。为获得提取液中以其他形式存在的叶黄素,对提取液进行皂化。皂化参数参考孟繁玲等[14]的方法,用1 %质量分数的氢氧化钠溶液与其混合,加入氢氧化钠溶液与提取液体积比为1∶10,避光60 ℃恒温水浴1 h,于皂化结束时用冰乙酸将溶液调至中性。
1.3.2 筛选提取溶剂
提取溶剂对工艺的影响重中之重[15]。本研究对万寿菊干花中叶黄素提取工艺中的提取溶剂进行筛选,本着对叶黄素溶解性好、沸点低且价格低廉的目的,以氯仿、乙酸乙酯、正己烷、甲醇和乙醇5种溶剂作为提取溶剂,以万寿菊中叶黄素提取率为最终目的进行考察。
称量5份万寿菊粉末,每份1 g,分别加入40 mL的氯仿、乙酸乙酯、正己烷、甲醇和乙醇于真空袋中。置于提取容器内,设定参数值:压力100 MPa,循环3次,保压时间为3 min,进行高压提取。待处理后得叶黄素提取液。
1.3.3 单因素实验设计
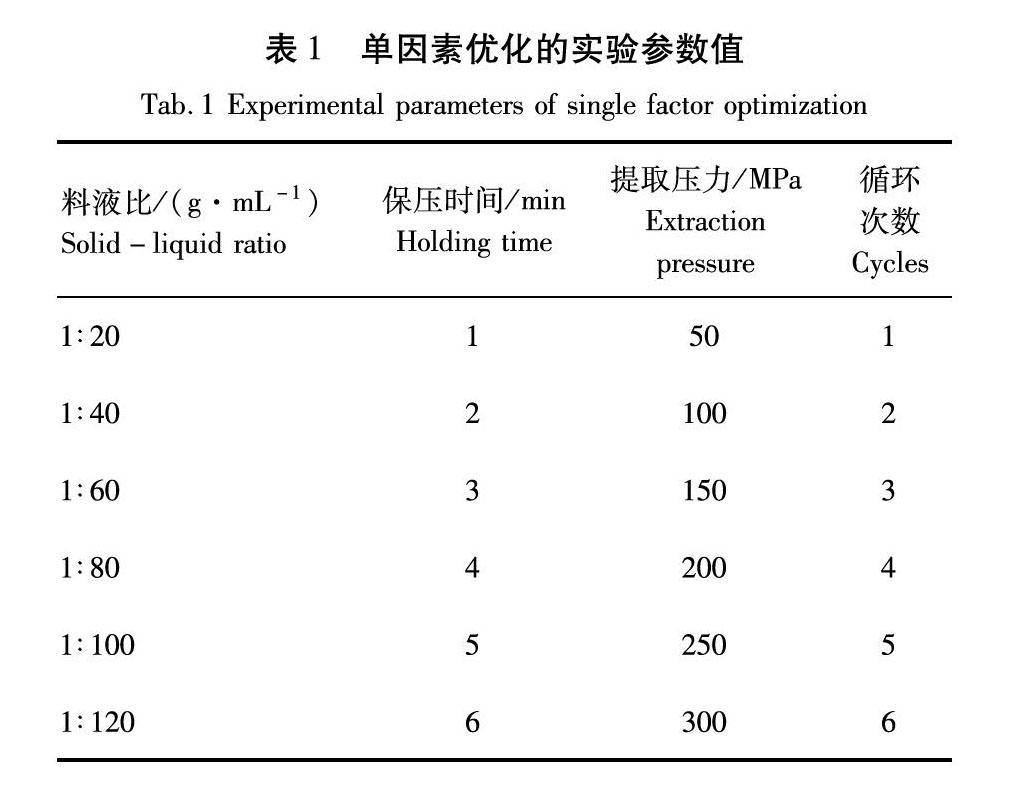
经预实验,将保压时间、提取压力、循环次数和料液比进行单因素优化。具体优化考察范围及水平设定见表1。
1.3.4 响应面优化实验
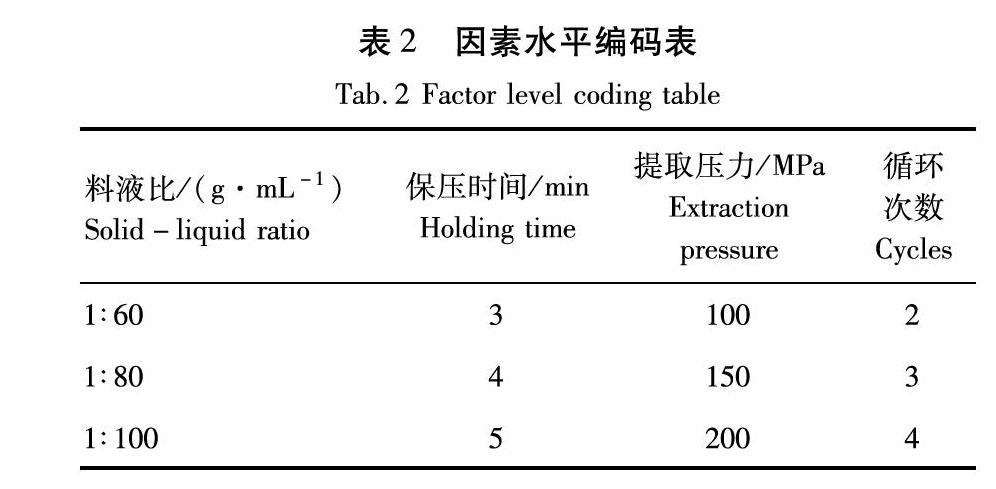
在上述实验结果上,采用响应面软件,进行了4个因素的响应面实验设计,其参数见表2。建立数学模型,以得到最佳工艺。
1.3.5 传统提取对比实验
(1)热回流提取:称量粉末1 g,料液比1∶40 (g/mL),提取溶剂为乙醇,加热回流4 h,抽滤,皂化处理。得叶黄素提取液
(2)微波-超声协同提取:称量粉末1 g,料液比1∶40(g/mL),提取溶剂为乙醇,50 ℃超声提取0.5 h后,抽滤,皂化处理,得叶黄素提取液。
1.3.6 标准曲线的绘制
(1)HPLC法测定叶黄素条件:色谱柱选用 Diamonsil C18 反相柱(200 mm×4.6 mm×5 μm);波长为445 nm;流动相比例是甲醇与乙腈的比为80∶20;流动相流速为1.0 mL/min;进样量为10 μL[16]。
(2)标准曲线溶液的制备:称量10 mg叶黄素标准品于10 mL容量瓶中用甲醇溶解并定容,配制质量浓度为1 mg/mL的叶黄素标准品母液。采用对半稀释法,配得质量浓度为1、0.5、0.25、0.125、0.062 5、0.031 25 mg/mL的叶黄素标准溶液,按照上述HPLC检测方法进行测定,X为标准品质量浓度 (mg/mL),Y为峰面积,计算分析得到其回归方程为:Y=2×107X+75 333,R2=0.999 8,线性范围为0~1 mg/mL。
1.3.7 提取率计算
按上述处理得到的叶黄素提取液,经HPLC法检测其浓度。叶黄素提取率公式为:
提取率=提取液中叶黄素的质量(mg)投入万寿菊干花的质量(g)×100% 。 (1)
2 结果与分析
2.1 溶剂筛选结果
本研究对5种提取试剂进行筛选。在同等条件下进行提取,对比不同溶剂对提取实验结果的影响,实验结果如图1所示。由图1可知,其影响由大到小顺序为:氯仿、乙酸乙酯、乙醇、甲醇、正己烷。其中提取率表现最优的3种溶剂为氯仿、乙酸乙酯和乙醇,提取率分别为25.64%、23.8%、22.67%,对比这些提取率结果相差不大。这3种溶剂比较,就有机试剂的毒性而言,乙醇為三者中最小,价格相对便宜且来源广,易回收可反复使用[17]。基于上述原因,确定乙醇为提取溶剂。
2.2 单因素试验结果与分析
按照上述实验方法,分析了料液比、保压时间、提取压力及提取次数4个因素对万寿菊中叶黄素提取率的影响。试验结果如图2所示。
由图2(a)可知,在料液比从1∶20 (g/mL)提高到1∶120 (g/mL),叶黄素提取率随着料液比的升高呈先升高后趋于平缓。料液比的变化对于提取原料中叶黄素的结果影响较大,较小的料液比无法将原料中的叶黄素完全提取出来,故在较小料液比时叶黄素的提取率较小。而当料液比1∶80 (g/mL)时,料液比足够大,可将原料中的有效成分完全提取出来,所以在料液比进一步增大时,对提取率的结果影响不大。故料液比进一步优化范围为1∶60~1∶100 (g/mL)。
由图2(b)可知,当保压时间从1 min提高到6 min时,叶黄素提取率随保压时间的升高呈先升高后几乎不变。保压时间5 min到6 min其结果不变。保压期间高压设备对物料持续施加压力,保压时间过短,有可能造成提取溶剂对原材料浸润不充分或细胞有效成分无法扩散到提取溶剂中,但保压时间过长,则会浪费大量能耗。故选择保压时间进一步优化范围为3~5 min。
由图2(c)可知,在提取压力从50 MPa提高到300 MPa,叶黄素提取率随着提取压力的升高呈先升高后趋于平缓。提取压力150 MPa后在升高提取压力时,叶黄素提取率基本维持稳定。这可能是万寿菊干花粉末质地较为细腻、疏松,再经历超高压处理时叶黄素已扩散至溶剂中。通俗来说,提取压力越大,提取率越高,但当提取率达到临界值时,过高的压力只会造成资源的浪费,且可能导致提取材料结构损坏,影响提取效率。故选择料液比进一步优化范围为100~200 MPa。
由图2(d)可知,在提取次数从1 次提高到6 次,叶黄素提取率随提取次数的升高呈先升高后稍有降低。提取次数为3 次时,叶黄素提取率达到峰值。随提取次数再增加,叶黄素提取率稍有下降,说明提取次数过多可能对叶黄素结构具有一定的破坏性。故选提取次数进一步优化范围为2~4 次。
2.3 实验参数设计及结果
以单因素试验结果为基础,利用 Box-Behnken 中心组合设计原理,进行分析试验,考察料液比(A)、提取压力(B)、保压时间(C)和提取次数(D)对叶黄素提取率(R)影响,结果见表3。
2.3.1 实验结果拟合
回归方程的建立与显著性检验。利用 Design-Expert 8.0.6软件, 通过对多项式回归分析,得到的拟合全变量二次回归方程模型为:
Y=62.66+5.30A+6.45B+0.012C+0.44D+1.15AB-0.38AC-0.21AD+0.19BC-0.25BD-0.29CD-4.23A2-2.71B2+0.030C2+0.073D2。
根据建立的模型进行方差分析和显著性的检验,方程显著性检验分析结果见表4。回归模型的F值为161.39,研究表明:Pr>F的概率小于0.000 1时,说明该模型符合极显著标准,Pr>F的概率小于0.05即视为模型显著,因此A、B、D、AB、A2、B2对叶黄素提取率的影响显著。利用 Design-Expert 8.0.6软件, 通过对多项式回归分析,得到的拟合全变量二次回归方程模型中回归决定系数R2值为0.993 8,校正决定系数R2(Adj)值为0.987 7,计算结果表明,该模型拟合度好,该响应面适合本研究内容的后续优化和设计。
2.3.2 两因素间的交叉作用
图3为不同因素的交互作用对回收率的影响,响应曲面越陡峭,表明该因素对回收率的影响越大[18]。从图3可知,回收率的响应曲面向下开口,其关系呈现明显二次抛物,且随着各因素参数值的增大,提取率逐渐升高,并出现极大值,随后呈不同斜率的下降,另从方差分析及结果中可知,AB曲线变化最为密集陡峭,其次为AC,影响最小为BC。
2.3.3 验证试验
由响应面结果分析,得到的最优条件为:料液比为1∶95.21 (g/mL),提取次数为4次,保压时间为3 min,提取压力为200 MPa。在此条件下验证模型的有效性,并与传统热回流法和超声-微波协同提取法进行比较,试验重复3次。结果显示,传统热回流法提取率为14.26±0.45 mg/g、超声-微波协同提取法提取率为9.73±0.66 mg/g、超高压辅助提取叶黄素的提取率为68.57±2.31 mg/g。试验结果与软件得出的最优预测值69.38 mg/g相近。对比结果表明,超高压辅助提取法显著优于传同回流法和超声-微波辅助提取法。在所得模型的拟合下程度较好,该工艺稳定性好、重复性强。
3 结论
在本研究中,超高压提取技术与热回流提取法、微波-超声协同提取法进行对比,以叶黄素提取率为参考值,其结果显著提高。这一结果表明,超高压提取技术快速高压破壁的原理,更利于破坏植物细胞壁,释放目标产物。大大缩短提取时间,也有效地避免由热效应引起的结构异化、损失及降低活性[18]。同时也大大减少了能量损耗。本研究以万寿菊干花为原料,采取超高压技术提取万寿菊中的叶黄素,在单因素试验结果的基础上通过响应面分析法,确定了超高压技术提取万寿菊中叶黄素的最佳工艺条件为:料液比为1∶95.21(g/mL),提取次数为4次,保压时间为3 min,提取压力为200 MPa,此条件下进行3次重复实验,叶黄素实际提取率可达(68.57±2.31)mg/g。说明超高压技术对有万寿菊中叶黄素的提取稳定性好、重复性强。本试验为提取叶黄素提供了一种新的方法。
【参 考 文 献】
[1]尤新.叶黄素和叶黄素酯的护眼功能[J].中国食物与营养,2015,21(7):79-80.
YOU X. Protection function of lutein and lutein ester on eyes[J]. Food and Nutrition in China, 2015, 21(7): 79-80.
[2]MAHMASSANI H A, SWITKOWSKI K M, SCOTT T M, et al. Maternal intake of lutein and zeaxanthin during pregnancy is positively associated with offspring verbal intelligence and vehavior regulation in mid-childhood in the project viva cohort[J]. The Journal of Nutrition, 2021, 151(3):615-627.
[3]JOHNSON E J, MARAS J E, RASMUSSEN H M, et al. Intake of lutein and zeaxanthin differ with age, sex and ethicity[J]. Journal of the American Dietetic Association, 2010, 110(9):1357-1362.
[4]CHENG X, ZHAO X, HUANG C, et al. Lutein content in petals and leaves of marigold and analysis of lutein synthesis gene expression [J]. Acta Physiologiae Plantarum, 2019, 41(7): 128-139.
[5]BANDARIYAN E, MOGHEISEH A, AHMADI A. The effect of lutein and Urtica dioica extract on in vitro production of embryo and oxidative status in polycystic ovary syndrome in a model of mice[J]. BMC Complementary Medicine and Therapies, 2021, 21(1): 1-11
[6]CHUYEN H V, NGUYEN M H, ROACH P D, et al. Microwave-assisted extraction and ultrasound-assisted extraction for recovering carotenoids from Gac peel and their effects on antioxidant capacity of the extracts[J]. Food Science & Nutrition, 2018, 6(1): 189-196.
[7]郭艷萍,许冲,吴云海.响应面法优化微波提取南瓜皮叶黄素的工艺研究[J].山西化工,2019,39(5):7-9.
GUO Y P, XU C, WU Y H. Study on optimization of microwave extraction of lutein from pumpkin skin by response surface method[J]. Shanxi Chemical Industry, 2019, 39(5): 7-9.
[8]李大婧,刘春泉,方桂珍.酶为介质有机溶剂提取万寿菊花中叶黄素的工艺研究[J].农业工程学报,2007,23(5):232-236.
LI D J, LIU C Q, FANG G Z. Enzyme-mediated organic solvent extraction of lutein from marigold flower (Tagetes erecta)[J]. Transactions of the Chinese Society of Agricultural Engineering, 2007, 23(5): 232-236.
[9]侯成林.超临界CO2萃取法提取万寿菊叶黄素的研究概况[J].家庭生活指南,2018,16(7):232-244.
HOU C L. Research profile of supercritical CO2 extraction of percussy chrysanthemum serotonin[J]. Family Life Guide, 2018, 16(7): 232-244.
[10]井凤,刘峰,刘伟.超高压技术在中药有效成分提取中的应用[J].科学与管理,2016,36(4):63-66.
JING F, LIU F, LIU W. The application of high hydrostatic pressure in active components of Chinese tradition medicine extraction[J]. Science and Management, 2016, 36(4): 63-66.
[11]蔺以柱,陈有国,熊德新,等.万寿菊不同种植密度对比试验[J].农业科技通讯,2019,50(4):44-47.
LIN Y Z, CHEN Y G, XIONG D X, et al. A comparative test of the different planting densities of the 10,000-year-old chrysanthemum [J]. Bulletin of Agricultural Science and Technology, 2019, 50(4):44-47.
[12]李彦伟.超高压提取黄精多糖工艺优化、结构分析及抗氧化性研究[D].大连:大连理工大学,2019.
LI Y W. Study on the process optimization, structure and antioxidant activity of Polygonatum polysaccharides by ultra-high pressure extraction[D]. Dalian: Dalian University of Technology, 2019.
[13]苏可盈,李倩,赵世民,等.黑茶超高压和热水提取物的体外降血糖活性研究[J].食品科技,2020,45(11):237-242..
SU K Y, LI Q, ZHAO S M, et al. Study on in vitro hypoglycemic activity of black tea extracts from ultra-high pressure and hot water[J]. Food Technology, 2020, 45(11):237-242.
[14]孟繁玲,张宇,徐少博,等.南瓜中游离叶黄素的制备及抗氧化活性[J].食品与生物技术学报,2020,39(8):81-88.
MENG F L, ZHANG Y, XU S B, et al. Manufacture process and antioxidant activity of free lutein from Cucurbita moschata Duch.[J]. Journal of Food Science and Biotechnology, 2020, 39(8): 81-88.
[15]徐晓辉,王莉洁,孙丹,等.万寿菊悬浮培养细胞生产游离叶黄素工艺的研究[J].生物化工,2020,6(2):5-9.
XU X H, WANG L J, SUN D, et al. Study on the process of producing free lutein by cell suspension cultures of Tagetes erecta L.[J]. Biological Chemical Engineering, 2020, 6(2): 5-9.
[16]韩月,李占君,李梦媛,等.响应面优化油桦中三萜类化合物提取工艺[J].森林工程,2021,37(2):79-85.
HAN Y, LI Z J, LI M Y. et al. Optimization of the extraction process of triterpenoids from Betula alba with response surface[J]. Forest engineering, 2021, 37(2):79-85.
[17]李占君,刘运伟,郭兴,等.紫苏籽粕桃酥制备工艺的优化[J].森林工程,2021,37(1):45-52.
LI Z J, LIU Z W, GUO X, et al. Optimization of the preparation process of Perilla seed meal and peach crisp[J]. Forest engineering, 2021, 37(1):45-52.
[18]王偉,程铭,章苇虹,等.超高压提取蝉花孢梗束成分工艺的研究[J].食品与营养科学,2020,9(3):236-243.
WANG W, CHENG M, ZHANG W H, et al. Study on the extraction technology of components from synnemata of Isaria cicadae by ultra-high pressure[J]. Hans Journal of Food and Nutrition Science, 2020, 9(3): 236-243.

