犬慢性肾衰竭进程中肠道菌群代谢物短链脂肪酸水平的变化及其对肾功能的影响
刘 静,朱道仙,卢劲晔,张一多,卢 炜,陆 江*
(1.江苏农牧科技职业学院宠物科技学院,泰州 225300;2.江苏农牧科技职业学院动物医学院,泰州 225300)
近年来,随着宠物老龄化发展,宠物老年病在临床上发病率越来越高,慢性肾衰竭 (chronic renal failure, CRF)便是其中之一。约有1/10的老年犬受到慢性肾衰竭的困扰[1]。该病治疗成本高、周期长、并发症多,对小动物诊疗业提出了严峻的挑战。因此,如何延缓CRF进程,提高患犬的生活质量,成为宠物临床上一个难题。
短链脂肪酸(SCFAs)是肠中部分菌群分解膳食纤维而产生的碳原子小于6的脂肪酸,具有多种生物学功能。慢性肾病患者服用产SCFAs的益生菌或摄入SCFAs能降低尿毒素和氧化应激水平、保护残肾功能和提高生活质量[2-3],肠道菌群改变也可促进慢性肾病的发展[4]。然而,在犬慢性肾衰过程中SCFAs的变化规律、SCFAs与肠道菌群相互关系以及SCFAs对肾功能影响等方面尚不清楚。本研究对CRF患犬短链脂肪酸水平进行了评估,分析CRF犬肠道菌群特征,并探究短链脂肪酸与肠道菌群及肾功能指标之间的关系,以期为宠物犬慢性肾衰竭的治疗提供新思路。
1 材料与方法
1.1 临床研究
本研究选取2017年9月—2019年12月在江苏农牧科技职业学院教学宠物医院就诊并根据渐进性消瘦病史、高氮血症及B超检查肾体积缩小等依据诊断为慢性肾衰竭的患犬51例。按照国际肾病研究协会(the International Renal Interest Society,IRIS)制定的犬慢性肾衰竭分期标准[5],将其分成轻度慢性肾衰组(M-CRF组,包括Ⅰ级和Ⅱ级)22例,重度慢性肾衰组(S-CRF组,包括Ⅲ级和Ⅳ级)29例。并且根据年龄、体重相近原则随机选取来该宠物医院体检的健康犬26例作为对照组(HC组),研究对象排除标准为采集样本前4周使用过益生菌及抗生素等。所有纳入研究对象,均向主人阐述了本研究实施过程,并在主人同意后进行相关研究。
1.2 血液样本采集及血液生化指标测定
所有样本在就诊当天采集静脉血3 mL,1 500 r·min-1离心15 min,分离出血清。采用全自动血液生化分析仪(Catalyst Dx动物生化分析仪,美国爱德士生物科技公司生产)检测血清中血糖(Glu)、总蛋白(TP)、三酰甘油(TG)、总胆固醇(TC)、C-反应蛋白(CRP)、胱抑素C(Cys-C)、尿素氮(BUN)、肌酐(Cr)、钙(Ca)及磷(P)等指标。
1.3 粪便样本采集
就诊第2天,无菌收集直肠中粪便,分装于2个试管中,样品采集完毕后转移到-80 ℃冰箱保存备用。一份用于检测短链脂肪酸含量,另一份用于肠道菌群16S rDNA测序。
1.4 肠道菌群16S rDNA高通量测序
1.4.1 粪便总DNA提取与PCR 称取无菌粪便样100 mg,采用Qiagen DNA试剂盒按说明书提取总DNA,再以获得的细菌DNA为模板进行细菌16S rDNA的V3-V4可变区PCR扩增,上游引物为5′-ACTCCTACGGGAGGCAGCAG-3′,下游引物为5′-GGACTGCACGGGTATCTAAT-3′。反应条件:95 ℃预变性 10 min;92 ℃变性45 s,50 ℃退火30 s,72 ℃延伸30 s,6个循环;92 ℃变性45 s,68 ℃ 退火30 s,72 ℃延伸30 s,30个循环;然后72 ℃ 延伸10 min;4 ℃保存。采用PCR产物纯化试剂盒(生工生物工程(上海)股份有限公司)对所得PCR产物进行纯化后,用于后续操作。
1.4.2 Illumina高通量测序及处理 使用NEB Next®UltraTMDNA Library Prep Kit for Illumina建库试剂盒进行文库构建, 构建好的文库经过Qubit定量和文库检测合格后, 使用Illumina Miseq PE 300平台对PCR产物进行Paired-end测序。测序数据经QIIME(version 1.9.1)进行去除接头序列、低复杂度序列和低质量序列的处理,得到高通量原始碱基序列,用RDF分类器将相似性大于97%的序列划分为一个分类操作单元(OTU),与GreenGene数据库进行比对,得到物种注释。
1.4.3 生物信息学分析 用QIIME 1.9.1[6]分析菌群α多样性,用基于weighted UniFrac matrices的主坐标分析[7](PCoA)进行β多样性分析,LEfSe分析[8]组间差异菌群,用CCA分析[9]环境因子与肠道菌群物种相互关系。
1.5 粪中短链脂肪酸测定
粪便中短链脂肪酸含量的测定采用气相色谱法(Agilent 6890 N气相色谱仪,美国)。准确称取200 mg 样品,加4 mL超纯水,振荡混匀30 min,然后12 000 r·min-1离心10 min,将上清液转移,重复以上步骤1次,合并上清液并定容到10 mL离心管中。取4.5 mL上清液,按9∶1体积比在样品中加入25%偏磷酸,固定3 h以上。然后12 000 r·min-1离心10 min,45 μm滤膜过滤加入上机瓶。色谱条件:采用DB-1 ms毛细管柱进行分离,载气为氮气,流量1 mL·min-1,辅助气为氢气,火焰离子检测器(FID)温度280 ℃,分流比50∶1,进样量2 μL。色谱温度程序:初始温度40 ℃,以5 ℃·min-1速度升至70 ℃,维持3 min,再以20 ℃·min-1速度升至160 ℃,维持3 min,最后以35 ℃·min-1速度升至280 ℃,维持3 min。用内标法计算各短链脂肪酸浓度。
1.6 动物试验
为了研究肠道菌群和丁酸盐对慢性肾衰患犬肾功能的潜在作用,无菌收集上述临床病例中3只S-CRF患犬的新鲜粪便,充分混匀,参考Zhao等[10]的方法制备粪菌液,并分装在-80 ℃保存,用于动物试验。选取25只5岁左右,体重约5 kg,雄性中华田园犬饲养于江苏农牧科技职业学院宠物饲养房,一犬一笼,自由饮水,环境温度为室温25 ℃,适应性饲养1周。然后将动物随机等分为5组:对照组(Con组)、慢性肾衰模型组(5/6 Nx组)、移植CRF患犬肠道菌群组(5/6 Nx+Microbiota组)、补充0.5%丁酸钠组(5/6 Nx+0.5% Butyrate组)和移植CRF患犬肠道菌群同时补充0.5%丁酸钠组(5/6 Nx+Microbiota+0.5% Butyrate组)。Con组犬仅作双侧肾包膜摘除术,其余各组动物参考王宁等[11]的方法采取肾动脉结扎法制作慢性肾衰模型。从试验第4周开始,5/6 Nx+Microbiota组动物灌服5 mL CRF犬的粪菌液,5/6 Nx+0.5% Butyrate组动物按300 μg·kg-1体重灌服0.5%丁酸钠,Nx+Microbiota+0.5% Butyrate组动物灌服5 mL CRF犬的粪菌液同时按300 μg·kg-1体重灌服0.5%丁酸钠,Con组动物灌服5 mL 0.9%氯化钠溶液。粪菌液每周灌服2次,0.5%丁酸钠每天1次, 所有灌服操作均在上午8:00—10:00完成。整个试验过程所有犬饮水及饮食均不受限制。试验总周期为12周。采用“1.2”的方法检测血中BUN、Cr等肾功能指标。
1.7 数据处理

2 结 果
2.1 纳入研究病例的临床基本特征
从表1可知,慢性肾衰患犬的肾功能指标Cys-C、BUN、Cr及P的水平,炎症生化标志物CRP水平均显著高于HC组(P<0.05),且S-CRF组这些指标均显著高于M-CRF组(P<0.05)。而年龄、性别、血中Glu、TP、TG、TC及Ca水平等方面,在3组间无显著差异。

表1 慢性肾衰竭患犬与健康犬临床参数的比较
2.2 慢性肾衰竭患犬肠道菌群多样性及组成的变化
丰富度和均匀度是衡量肠道菌群多样性的两个重要方面。从图1a、b可以看出,S-CRF组丰富度指标观察物种数显著低于M-CRF组及HC组,S-CRF组和M-CRF组均匀度指标Simpson指数显著低于HC组(P<0.05)。PCoA分析结果显示,各组组内样本间距离较短,聚集程度较高;组间比较,HC组和M-CRF组样本相互聚集,H-CRF组样本与HC组、M-CRF组样本间距离较大,呈分离趋势(图1c)。各组在门水平主要为拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes),二者占80%左右,其他丰度>1%的门主要为梭杆菌门(Fusobacteria)、变形杆菌门(Proteobacteria)及放线菌门(Actinobacteria)(图1 d);在属水平,相对丰度比例≥1%的菌属主要有普氏杆菌属(Prevotella)、拟杆菌属(Bacteroides)及梭杆菌属(Fusobacterium)等19个属。这些物种共同构成了各组犬肠道核心菌群。

a.各组肠道菌群ɑ多样性指标(观察物种数)比较;b.各组肠道菌群ɑ多样性指标(Simpson指数)比较;c.各组肠道菌群β多样性比较(PCoA分析);d.各组肠道菌群在门水平的比较;e.各组肠道菌群在属水平比较a. Comparison of gut microflora ɑ diversity index (observed species) in each group; b. Comparison of gut microflora diversity index (simpson index) in each group; c. Comparison of gut microflora beta diversity index (PCoA analysis); d. Comparison of gut microflora abundance in different groups at phylum level; e. Comparison of gut microflora abundance in different groups at genus level图1 CRF犬肠道菌群组成及多样性的变化Fig.1 Changes of composition and diversity of gut microflora in dogs with CRF
2.3 慢性肾衰竭患犬肠道差异菌群及其与环境因子关系分析
经过LEfSe分析(linear discriminant analysis effect size)发现,S-CRF组与HC组间存在大量差异菌群(LDA值>3.0),拟杆菌科(Bacteroidaceae)、拟杆菌属(Bacteroides)及假单胞菌科(Pseudomonadaceae)等7个物种富集于S-CRF组,普氏杆菌科(Prevotellaceae)、梭菌科(Clostridiaceae)、普氏杆菌属(Prevotella)及普拉梭菌属(Faecalibacterium)等11个物种富集于HC组(图2a);与HC组比较,M-CRF组普氏杆菌科、普氏杆菌属、梭菌科及瘤胃球菌属(Ruminococcus)等丰度降低,拟杆菌科、拟杆菌属及产碱菌科(Alcaligenaceae)等丰度升高(图2b);与M-CRF组比较,S-CRF组普氏杆菌科及普氏杆菌属丰度降低,而拟杆菌科、拟杆菌属、假单胞菌科及假单胞菌属(Pseudomonadales)丰度升高(图2c)。为了进一步了解肠道菌群对慢性肾衰内环境变化的适用性,对肠道菌群与环境因子进行典型相关分析(canonical correlation analyses,CCA)。从图2 d可以看出,拟杆菌属、假单胞杆菌属及副拟杆菌属等细菌与肾功能指标Cr、BUN、Cys-C及P等呈正相关关系,说明这些细菌适应了慢性肾衰的环境变化;而普氏杆菌属、普拉杆菌属及梭菌属等细菌与相关肾功能指标呈负相关关系,说明慢性肾衰引起的内环境变化可以抑制这些细菌的生长繁殖。
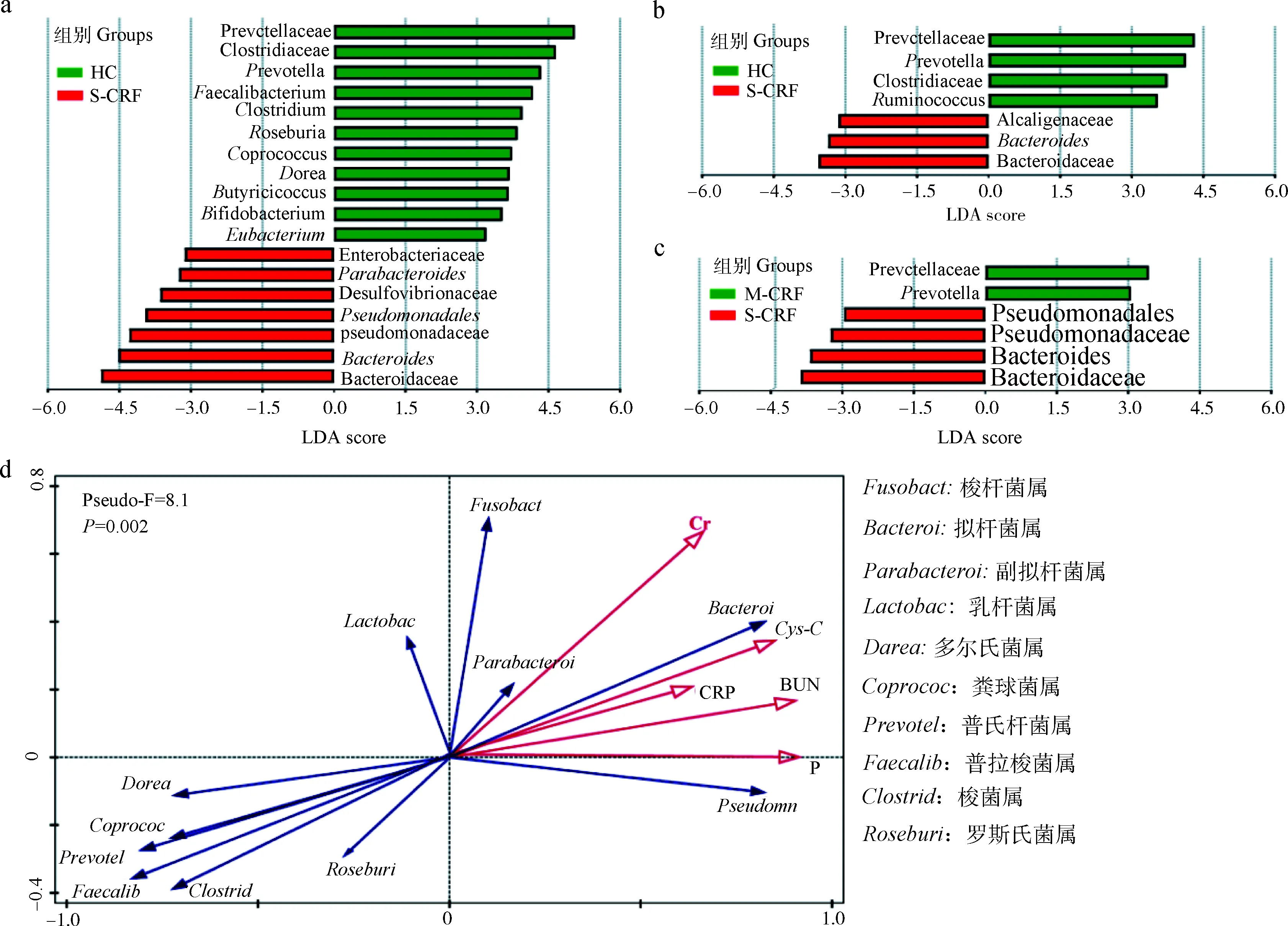
a. HC组与S-CRF组菌群比较的LDA值;b. HC组与M-CRF组菌群比较的LDA值;c. M-CRF组与S-CRF组菌群比较的LDA值;d.肠道菌群与体内环境参数间相互关系的CCA分析a. Comparison of LDA value of differential gut microflora between HC group and S-CRF group; b. Comparison of LDA value of differential gut microflora between HC group and M-CRF group; c. Comparison of LDA value of differential gut microflora between M-CRF group and S-CRF group; d. CCA analysis of the relationship between gut microflora and environmental factors in vivo图2 差异菌群及其与环境因子关系分析Fig.2 Analysis of the relationship between differential gut microflora and environmental factors
2.4 慢性肾衰患犬粪中短链脂肪酸的变化
粪中主要短链脂肪酸随着肾衰程度加重呈现降低趋势(图3a、b、c),S-CRF组乙酸、丙酸及丁酸浓度均显著低于HC组和M-CRF组(P<0.05),M-CRF 组丁酸浓度显著低于HC组(P<0.05)。进一步分析产短链脂肪酸菌群相对丰度发现,S-CRF组产乙酸菌及产丙酸菌的相对丰度也显著低于HC组和M-CRF组(P<0.05),且S-CRF组和M-CRF组产丁酸菌相对丰度均较HC组降低(图3 d、e、f)。
2.5 短链脂肪酸与肾功能指标的相关性
从图4可以看出,乙酸浓度与Cr、BUN及Cys-C水平之间无相关性(P>0.05,图4a);丙酸浓度与Cys-C、Cr和BUN水平之间亦呈较弱的负相关关系(r分别为-0.312、-0.326和-0.231,P<0.05,图4b);丁酸浓度与Cys-C、Cr和BUN水平之间呈较强的负相关关系(r分别为-0.451、-0.583和-0.514,P<0.01,图4c)。
2.6 试验犬肾功能的变化
从图5a、b可知,各组Cr、BUN水平在造模前(0周)无显著性变化,而各试验组造模后(4周)Cr、BUN水平显著高于Con组及生理阈值(P<0.05),表明造模成功。与5/6 Nx组比较,在12周时,5/6 Nx+Microbiota组血清Cr显著升高,5/6 Nx+0.5% Butyrate组和5/6 Nx+Microbiota+0.5% Butyrate组Cr显著降低(P<0.05,图5a)。与5/6 Nx组比较,在12周时,5/6 Nx+Microbiota组BUN显著升高,5/6 Nx+0.5% Butyrate组BUN显著降低(P<0.05,图5b)。5/6 Nx+0.5% Butyrate组血清丁酸在第12周分别高于5/6 Nx组,5/6 Nx+Microbiota组(P<0.05,图5c)。
3 讨 论
SCFAs主要包括乙酸、丙酸和丁酸等,主要由肠道中细菌发酵不易消化的碳水化合物产生,主要有普拉杆菌属、梭菌属、粪球菌属、多尔氏菌属、瘤胃球菌属及罗斯氏菌属等,这些菌群的改变影响SCFAs产生[12]。本研究发现患犬SCFAs低于健康犬,且肠道菌群多样性随着CRF发展呈降低趋势,虽然拟杆菌门和厚壁菌门是本研究中两个丰度最高的门,但拟杆菌门中主要菌属丰度却发生了变化,表现为普氏杆菌属富集于HC组,拟杆菌属富集于S-CRF组。与相关研究结论一致[13]。对肾功能指标与肠道菌群进行CCA分析发现,肾功能指标与拟杆菌属、假单胞杆菌属及副拟杆菌属等细菌丰度呈正相关,与普氏杆菌属、普拉杆菌属及梭菌属等细菌呈负相关。这可能是肠道菌群对CRF引起的肠道内环境变化的适应能力不同造成的,大量BUN、Cr进入肠道为那些含有脲酶的细菌(如假单胞杆菌属等)提供丰富的氮源,有利于其生长繁殖[14]。慢性肾衰患犬肠道中那些相对丰度降低的菌群大部分具有产SCFAs能力,LEfSe分析发现慢性肾衰患犬产SCFAs菌群及普氏杆菌科和普氏杆菌属细菌富集较少,而普氏杆菌科相关成员含有形成丁酸的两个关键酶,磷酸丁酰转移酶和丁酸激酶,可促进丁酸合成[15]。进一步研究发现,5/6 Nx犬移植CRF犬粪菌液后血清丁酸水平降低。提示CRF患犬的SCFAs特别是丁酸浓度降低可能与慢性肾衰引起的肠道菌群改变有密切关系。
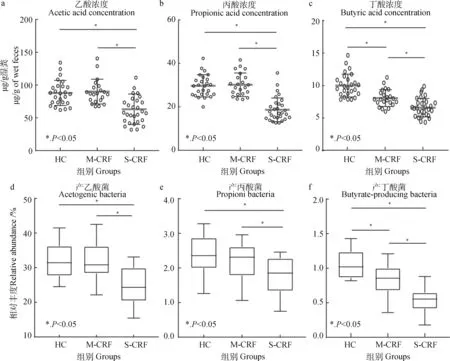
a.乙酸浓度;b.丙酸浓度;c.丁酸浓度;d.产乙酸菌相对丰度;e.产丙酸菌相对丰度;f.产丁酸菌相对丰度a. Acetic acid concentration; b. Propionic acid concentration; c. Butyric acid concentration; d. Relative abundance of acetogenic bacteria; e. Relative abundance of propionibacteria; f. Relative abundance of butyrate-producing bacteria图3 粪中短链脂肪酸浓度变化Fig.3 Changes of short chain fatty acids concentration in feces
SCFAs除了可以直接为宿主提供能量外,还可进入血液循环作为信号分子,参与宿主不同的生物过程,对动物生理病理发挥重要作用[16]。SCFAs可以通过抑制NF-κB通路和MAPK通路而发挥抗炎症和氧化应激作用以延缓慢性肾病进展[17]。SCFAs也可通过促进肾小管上皮细胞表达促进自噬相关基因-7(ATG-7)和线粒体DNA水平增加,激活自噬,抑制凋亡而实现肾保护作用[18]。相关报道发现[19],由于粪便中短链脂肪酸的种类及其丰度较为稳定,且粪便作为测定短链脂肪酸的生物样品较其他种类物样品有采样简单、样品易获得、方便储存的优点,已成为检测短链脂肪酸最为常用的生物样品。因而在本研究主要测定了粪便中的SCFAs含量,结果表明,重度CRF患犬的乙酸、丙酸及丁酸浓度均低于对照组,且与肾功能指标呈负相关关系。动物试验发现,5/6 Nx犬给与丁酸钠后可降低Cr及BUN水平,然而5/6 Nx犬移植CRF患犬粪菌液后,可使Cr及BUN水平进一步升高,丁酸盐则可回调这些变化。这说明SCFAs减少可能加剧CRF患犬肾功能障碍,具体机制有待进一步研究。

a.乙酸与肾功能指标的相关性分析;b.丙酸与肾功能指标的相关性分析;c.丁酸与肾功能指标的相关性分析a. Correlation analysis of acetic acid and renal function indexes; b. Correlation analysis of propionic acid and renal function indexes; c. Correlation analysis of butyric acid and renal function indexes图4 短链脂肪酸与肾功能指标的相关性分析Fig.4 Correlation analysis of short chain fatty acids and renal function indexes

a.不同阶段各组血清肌酐浓度的比较;b.不同阶段各组血清尿素氮浓度的比较。c.不同阶段各组血清丁酸浓度的比较。*.P<0.05a. Comparison of serum creatinine in different stages of chronic renal failure; b. Comparison of serum BUN in different stages of chronic renal failure; c. Comparison of serum butyric acid in different stages of chronic renal failure. *. P<0.05图5 粪菌移植及丁酸钠对慢性肾衰模型犬肾功能的影响Fig.5 Effect of fecal bacteria transplantation and sodium butyrate on renal function in chronic renal failure model in dogs
综上所述,慢性肾衰竭可降低患犬粪中短链脂肪酸浓度,可能与肠道菌群改变有关,且短链脂肪酸与肾功能关系密切。重建肠道菌群平衡,提高短链脂肪酸水平以期成为延缓犬慢性肾衰竭的新方法。
4 结 论
慢性肾衰竭患犬肠道菌群多样性降低,菌群结构及丰度改变,粪中短链脂肪酸浓度降低,这些变化可加剧肾功能障碍。

