右美托咪定对氯胺酮致发育期大鼠神经损伤的影响
张志恒,白 荟,申美伦,马相影,李柔茜,金箫笛,高 利
(东北农业大学动物医学学院 黑龙江省实验动物与比较医学重点实验室,哈尔滨 150030)
啮齿和非人灵长类动物在发育期使用麻醉药、镇静药会引起神经元和胶质细胞凋亡增多,导致神经发生、突触传递及脂质代谢发生异常,这也可能与其晚年的认知和行为异常有关[1]。在发育关键期对幼龄动物进行长时间(大于6 h)单次麻醉或较短时间多次麻醉可能会对机体产生影响[2]。氯胺酮是一种非竞争性N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)受体拮抗剂,麻醉效果良好且起效快,对于急慢性疼痛的动物均有效[3-5]。氯胺酮能够引起未成熟或幼龄动物神经细胞凋亡并导致认知功能障碍,且呈现时间和剂量依赖性[6]。单次或低剂量给予氯胺酮不会引起发育期大鼠神经细胞结构及功能的改变,而高剂量重复注射或延长暴露时间便会观察到神经细胞的退变[7]。Slikker等[8]将氯胺酮肌注到妊娠122 d、5日龄 及35日龄的恒河猴中,幼龄组均产生了神经毒性。在非人灵长类动物中的这种暴露与脑部发育异常、认知功能下降有关[9]。
寻求更安全有效的麻醉方式至关重要,如何降低氯胺酮对发育期动物的毒性引起了广泛关注。对于幼龄动物而言,理想的麻醉药应具备以下特点:起效迅速、作用持续时间短、给药途径简单、副作用小及镇痛效果良好[10]。右美托咪定(dexmedetomidine,Dex)是一种α2-肾上腺素受体激动剂,在兽医临床实践中具有良好的镇静、镇痛和抗焦虑作用,且无呼吸抑制作用,但可引起副交感神经兴奋、心动过缓和低血压。右美托咪定和氯胺酮具有互补的药理作用。右美托咪定可降低氯胺酮麻醉引起的心血管及精神方面的不良反应[11]。氯胺酮和右美托咪定的组合可产生有效的镇静作用,使动物的诱导麻醉更平稳,并可有效降低围手术期不良事件的发生率[12]。但其对发育期动物的神经毒性和安全性还需要进行更深入的研究证实。因此,本研究通过构建氯胺酮致发育期大鼠神经毒性模型,使用右美托咪定进行干预,探究右美托咪定对氯胺酮致发育期大鼠氧化应激及认知功能障碍的影响。
1 材料与方法
1.1 实验动物
7日龄SD大鼠48只,来源为哈尔滨医科大学实验动物中心。
1.2 试剂
氯胺酮由东北农业大学动物医学学院临床外科教研室提供;右美托咪定购自硕腾公司; 氧化应激试剂盒CAT、GSH购于南京建成生物工程研究所;MDA、GHS-Px和蛋白浓度检测试剂盒购于碧云天生物技术公司。ELISA试剂盒IL-1β和IL-18购于慧嘉生物科技有限公司。
1.3 动物分组和药物处理
根据先前报道的试验方案[13]建立持续暴露氯胺酮致幼鼠神经毒性模型。7日龄SD大鼠腹腔注射20 mg·kg-1氯胺酮,每隔90 min 1次,共注射5次 (麻醉时间共7.5 h)。7日龄SD大鼠随机分为Con组(对照组,腹腔注射生理盐水)、Ket组[氯胺酮组,腹腔注射20 mg·kg-1氯胺酮(每1.5 h注射1次,共5次)]、Dex组(腹腔注射15 μg·kg-1Dex)、Ket+Dex组(氯胺酮注射前30 min,腹腔注射15 μg·kg-1Dex)。每次给药0.1 mL,氯胺酮和Dex均使用生理盐水溶解,生理盐水和Dex提前30 min 腹腔注射。
1.4 样本采集及保存
动物最后1次给药1.5 h后,随机分为两部分:一部分动物分离海马和皮质组织,-80 ℃保存,用于试剂盒指标检测;另一部分使用4%多聚甲醛进行心灌流并固定保存,用于制作脑组织尼氏染色切片。
1.5 海马神经元结构观察
通过尼氏染色法检测右美托咪定对氯胺酮作用下海马神经元的影响。取4%多聚甲醛固定的脑组织样本,修整固定后进行如下操作:生理盐水冲洗;不同浓度梯度酒精脱水,二甲苯透明,石蜡包埋,修形,切片(厚度5 μm)及尼氏染色,并使用中性树胶封片。光学显微镜下观察染色后切片。
1.6 氧化应激检测
使用试剂盒检测各组脑样本中谷胱甘肽(GSH)、丙二醛(MDA)、过氧化氢酶(CAT)的含量。评价Dex对氯胺酮致海马组织损伤后氧化应激水平的影响。所有操作均按照试剂盒说明书进行。
1.7 数据分析
2 结 果
2.1 Dex对7日龄大鼠海马及皮质神经元的影响
尼氏染色结果如图1所示,与对照组相比,K组海马CA1区和CA3区域神经元密度明显下降,数量减少;海马和前额叶皮质区域尼氏小体数目减少,神经元细胞结构被破坏,Ket组CA1区神经元轴突排列混乱;DG区域变化不明显。以上结果提示,7日龄SD大鼠连续给予氯胺酮麻醉后脑区出现细胞损伤。而Ket+Dex组与Ket组相比,氯胺酮造成的神经元损伤被美托咪定预先用药所缓解。
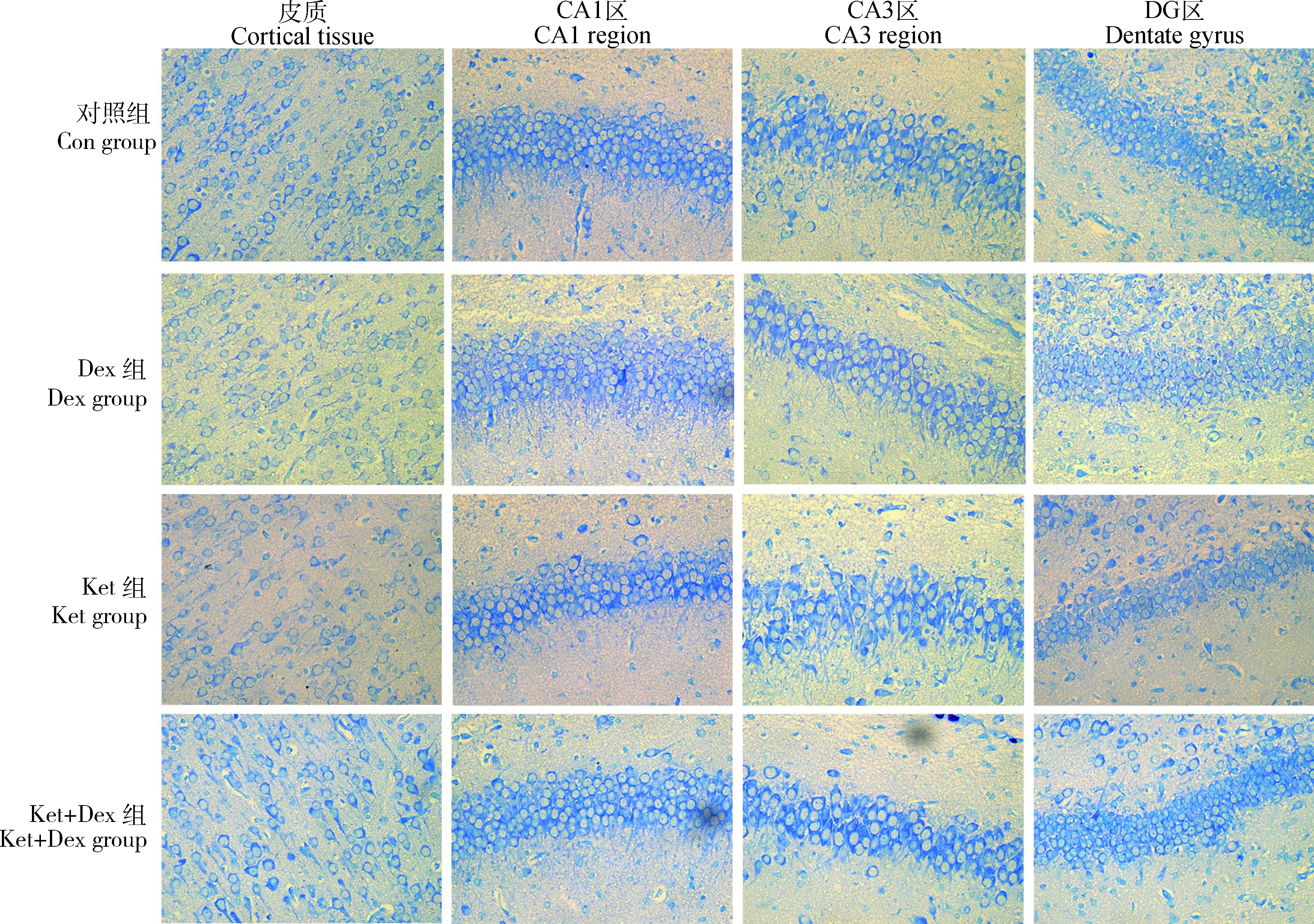
图1 大脑皮质及海马尼氏染色(400×)Fig.1 Nissl staining in the cerebrum and the hippocampus (400×)
2.2 Dex对7日龄大鼠海马及皮质氧化应激水平的影响
如图2、3所示,Ket组大鼠皮质和海马中GSH含量与Con组相比显著降低(P<0.05),MDA含量均显著升高(P<0.05),CAT含量显著下降(P<0.05);Ket+Dex组海马和皮质组织GSH和CAT的含量与Ket组相比均显著升高,而MDA含量显著降低(P<0.05);此外,Dex组海马和皮质组织GSH、CAT和MDA含量与Con组相比无明显差异(P>0.05),不具有统计学意义。
2.3 Dex对7日龄大鼠海马及皮质炎症因子IL-1β和IL-18的影响
如图4、5所示,Ket组大鼠皮质和海马中炎症因子IL-1β和IL-18的浓度与Con组相比显著升高(P<0.05), Ket+Dex组海马和皮质组织中IL-1β和IL-18与Ket组相比均显著降低(P<0.05);此外,Dex组海马和皮质组织炎症因子IL-1β和IL-18 含量与Con组无明显差异(P>0.05),不具有统计学意义。
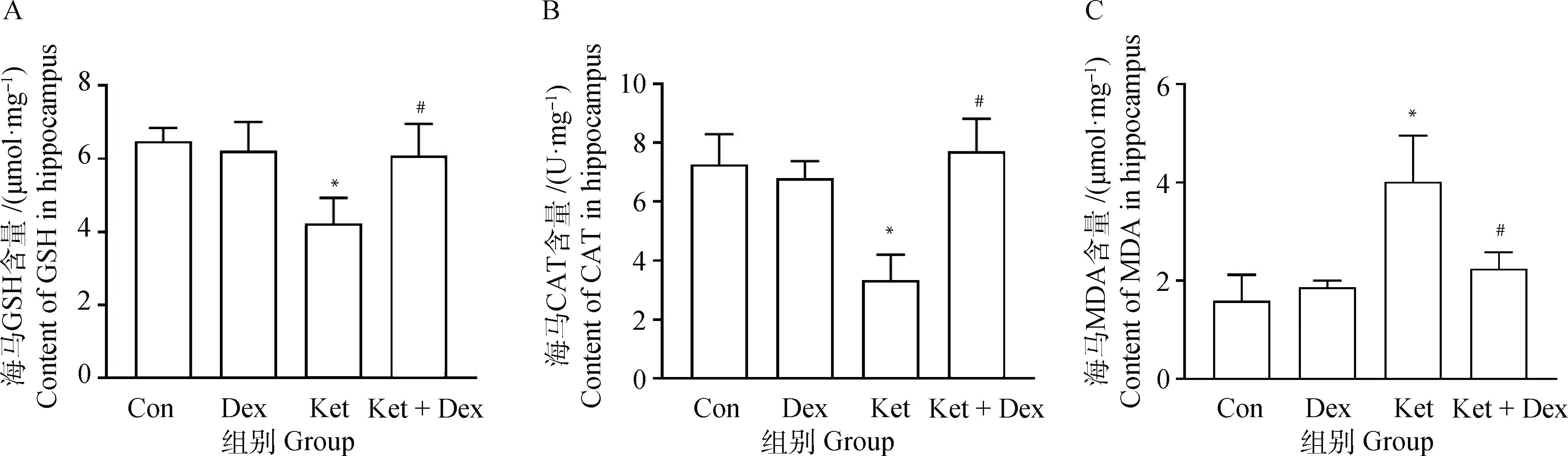
Con.对照组;Dex.右美托咪定组;Ket.氯胺酮组; Ket+Dex.氯胺酮+右美托咪定组。与对照组比较,*.P<0.05;与氯胺酮组比较,#.P<0.05。下同Con.Control group; Dex.Dexmedetomidine group; Ket. Ketamine group; Ket+Dex. Ketamine+dexmedetomidine group. Compared with the control group, * .P<0.05.Compared with ketamine group, #. P<0.05.The same as below图2 大鼠海马中GSH、CAT和MDA的变化Fig.2 Changes of GSH, CAT and MDA in rat hippocampus

图3 大鼠大脑皮质GSH、CAT和MDA的变化Fig.3 Changes of GSH, CAT and MDA in cerebral cortex of rat
3 讨 论
大量研究表明[9, 14-16],大多数镇静、镇痛药物都会造成发育期哺乳动物大脑神经元凋亡或者产生退行性病变。并且长期或多次暴露于麻醉时,这种变化表现得尤为显著。麻醉药物对于发育期动物的大脑神经毒性的产生机制及如何采取有效措施干预这一过程仍然是亟待解决的问题。右美托咪定是一种高选择性α2受体激动剂,可提供镇痛和类似自然睡眠的镇静作用,常作为兽医临床诊疗中的镇静镇痛药物。右美托咪定能够通过减弱中枢或外周交感神经末梢去甲肾上腺素的释放发挥交感神经阻滞作用[17-18]。右美托咪定可单独或与咪达唑仑、氯胺酮、丙泊酚和氯丙嗪联合用于动物的镇静以及各种侵入性/非侵入性手术的麻醉[18]。右美托咪定作用的α2受体广泛存在于肝、肺、肾和大脑等器官中。此外,有研究显示,右美托咪定具有良好的神经保护作用,可降低大脑血流量减轻哺乳动物和人的细胞凋亡、儿茶酚胺和谷氨酸释放[20],其作用机制可能与氧化应激及炎症反应有关[21-22]。因此,有必要进行右美托咪定干预幼龄动物早期麻醉药物暴露导致的神经元损伤的影响进行进一步研究。基于此,本试验选取7日龄发育期大鼠作为研究模型,通过连续注射氯胺酮建立发育期大鼠神经损伤模型,探究右美托咪定对氯胺酮麻醉致发育期大鼠大脑神经元损伤、氧化应激及炎症因子释放的影响及可能的机制。结果表明,氯胺酮麻醉会造成发育期大脑神经元损失、氧化应激及炎症因子的释放,而右美托咪定能够有效减轻氯胺酮对发育期大脑的神经毒性。

图4 大鼠海马中炎症因子IL-1β和IL-18的变化Fig.4 Changes of IL-1β and IL-18 in rat hippocampus

图5 大鼠大脑皮质中炎症因子IL-1β和IL-18的变化Fig.5 Changes of IL-1β and IL-18 in cerebral cortex of rat
哺乳动物的大脑在发育期以不同形式的突触构建成复杂的神经网络,该阶段的神经元比较敏感,很容易受到外界刺激的影响[23]。在这一时期使用氯胺酮能够改变神经细胞生理平衡并对大脑正常发育产生不利影响。1999年,Ikonomidou等[15]关于全身麻醉药物对于神经细胞凋亡的研究显示:在对出生后第0、3和7日龄的大鼠中应用NMDA受体拮抗剂可导致大脑神经细胞死亡,随后的研究显示,多次注射20 mg·kg-1氯胺酮会引起7日龄大鼠额叶皮质神经元凋亡显著增加,使NMDAR1亚基的蛋白和基因表达上调,而非麻醉剂量的氯胺酮则不会造成这种损伤[24-25]。本研究结果显示,连续氯胺酮给药后7日龄大鼠大脑神经元损伤,具体表现为海马CA1及CA3区和皮质的神经元丢失增加、尼氏体数量减少、密度降低且排列混乱;右美托咪定提前30 min给药能够有效降低氯胺酮引起发育期大鼠大脑神经元丢失。此外,单独给予右美托咪定并没有引起海马和皮质神经元死亡,这与笔者的预期一致。
通常情况下,生物体内的抗氧化与氧化系统保持着动态平衡。细胞内抗氧化与氧化系统之间的不平衡就会引起氧化应激[26]。体内还同时存在很多过氧化物和抗氧化物。如MDA、GSH和CAT等。MDA是脂质过氧化反应后终产物,会导致蛋白质和DNA等发生交联反应导致细胞死亡,还会影响线粒体膜和细胞膜的破坏。CAT存在于各种细胞中,作为一种自由基清除剂,可以清除体内过量的过氧化氢,以保护细胞免受氧化损伤。GSH能够保护机体免受ROS损伤,维持机体的正常抗氧化功能[27-28]。Li等[29]和潘寅兵等[30]研究发现,孕期大鼠应用氯胺酮后其子代大鼠大脑ROS水平和过氧化物含量增加,最终引起氧化应激,造成神经损伤。在本研究中发现对发育期连续注射氯胺酮,其皮质和海马中抗氧化物质GSH和CAT的含量显著下降,而脂质过氧化物MDA含量显著升高,这些结果说明了氯胺酮造成了氧化应激损伤。而使用右美托咪定预先给药再注射氯胺酮后的发育期大鼠的抗氧化水平增加、脂质过氧化水平降低:CAT和GSH显著升高,MDA下降,这些结果进一步表明,右美托咪定可以降低氯胺酮导致的氧化应激水平增加。
IL-1β和IL-18是非常重要的促炎性细胞因子,具有自分泌、旁分泌和全身性功能[31]。炎性因子IL-1β和IL-18的浓度增加也在氯胺酮导致发育期大鼠大脑神经损伤中发挥了重要作用。因此在本研究中也检测了海马和皮质组织中IL-1β 和IL-18的含量。结果表明,氯胺酮显著增加了大鼠皮质和海马中炎症因子IL-1β和IL-18的水平,这可以从侧面说明氯胺酮加重了发育期大鼠的炎症反应。而通过右美托咪定预先给药改变了氯胺酮导致的炎症反应。
4 结 论
右美托咪定预处理能够有效降低发育其大鼠海马和皮质MDA水平、增加CAT和GSH含量,并抑制炎症因子IL-1β和IL-18的分泌,在氯胺酮致发育期大鼠神经损伤时发挥神经保护作用。

