参虎败毒颗粒体内抗猪繁殖与呼吸综合征病毒的效果观察
李 晨,邱存义,冯逸雪,韩力康,杜连昭,王茜茜,马 欣,李瑞香*,王兴龙*
(1. 西北农林科技大学动物医学院,杨凌 712100; 2. 渭南市临渭区动物疫控中心,渭南 714000; 3. 浙江金大康动物保健品有限公司,金华 321016)
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome, PRRS),又称猪蓝耳病,是由猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus, PRRSV)感染猪后引起的一种严重危害养猪业的传染病。PRRSV造成以流产、早产、产死胎或木乃伊胎为特征的母猪繁殖障碍性疾病和仔猪、育肥猪呼吸系统疾病。1996 年,我国首次分离到该毒株,正式确定了PRRS 在我国的传播[1-2]。2006 年暴发的高致病性蓝耳病(HP-PRRS),其致病性相对经典PRRSV 有了显著升高[3],近年来,国内又在流行类NADC-30毒株,给防控带来巨大压力[4]。PRRSV有两种基因型,PRRSV-I型(Lelysted virus,LV)为欧洲型毒株,PRRSV-II型(VR-2332)为美洲型毒株[5-6]。虽然欧洲型和美洲型毒株感染猪后引起的临床症状相似,但二者抗原性差异较大,核苷酸相似度为55%~70%,氨基酸相似度为50%~80%[7-9]。目前,生产上主要用弱毒活疫苗或灭活疫苗预防PRRS,多数情况下免疫无法为野毒株提供充分保护,弱毒活疫苗还存在返强风险[10-11]。积极寻求PRRS新的防控方案是近年来动物疫病防控领域研究的热点。许多研究发现,中药及其多糖类化合物具有很好的抗病毒效果[12],参虎败毒颗粒是由黄芩、虎杖、白头翁、苦参、板蓝根等中药组成,具有清热解毒、扶正祛邪、利湿退黄、抗菌抗病毒作用[13],推测参虎败毒颗粒可能对PRRSV具有较好抑制效果。因此,有必要对参虎败毒颗粒抗PRRSV的作用进行研究,为其临床应用和后期高效抗PRRSV复方中药的开发寻找依据。
1 材料与方法
1.1 中药及试剂
参虎败毒颗粒复方中药由浙江金大康动物保健品有限公司提供;反转录试剂盒购自北京康润诚业生物科技有限公司;猪繁殖与呼吸综合征病毒抗体ELISA检测试剂盒购自北京金诺百泰生物技术有限公司。
1.2 毒株及试验动物
PRRSV JXA1毒株(104.7TCID50·mL-1)由西北农林科技大学兽医传染病实验室提供,动物选用20头35日龄健康、体重相近的PRRSV病原、抗体阴性断奶仔猪,由勉县良种繁育场提供。
1.3 PRRSV检测引物
根据GenBank发表的序列,设计针对PRRSV ORF6、ORF7和猪β-actin片段引物及探针,PRRSV ORF6与探针检测病毒血症,PRRSV ORF7与β-actin检测组织病毒载量(表1)。

表1 PCR引物和探针序列
1.4 方法
1.4.1 试验动物分组与处理 将20头仔猪随机平均分为A、B、C、D共4个组。A组仔猪接种PRRSV前3 d饲料中添加药物;B组接种PRRSV当天饲料中添加药物;C组仔猪只接种PRRSV不添加药物;D组仔猪为阴性对照组,各组单独饲养管理。A、B、C组仔猪在试验第3天肌肉注射PRRSV JXA1毒株2.0 mL。
每日观察各组仔猪临床症状并测定体温,攻毒后14 d各组随机选取1头仔猪处死,进行眼观肺部病理变化检查和组织病理学检查,并检测肺的病毒载量。攻毒后1、3、5、7、14、21、28、35 d采抗凝和非抗凝血,进行PRRSV抗体和病毒血症检测。动物分组及处理方案见表2。

表2 试验动物分组及处理方案
1.4.2 病理组织切片制作 肺组织样品经固定、脱水、透明、浸蜡、包埋后,制作组织切片并进行HE染色[14],显微镜下观察组织病理变化并拍照。
1.5 统计分析
用SPSS 20.0软件对各组数据进行统计分析,以邓肯氏法进行多重比较,P<0.01表示差异极显著(**),P<0.05表示差异显著(*),P>0.05表示差异不显著。
1.6 动物使用伦理
遵照《陕西省实验动物管理办法》(陕西省人民政府令 第150号)和西北农林科技大学实验动物管理处置办法进行实验动物操作,符合动物福利要求。
2 结 果
2.1 仔猪体温变化
A、B组攻毒后第6天体温升高至40 ℃,持续至第11和12天恢复正常,高热分别持续5和6 d;C组攻毒后第5天体温升高至40 ℃,持续至第14天,高热持续时间超过9 d;D组仔猪体温正常(图1)。
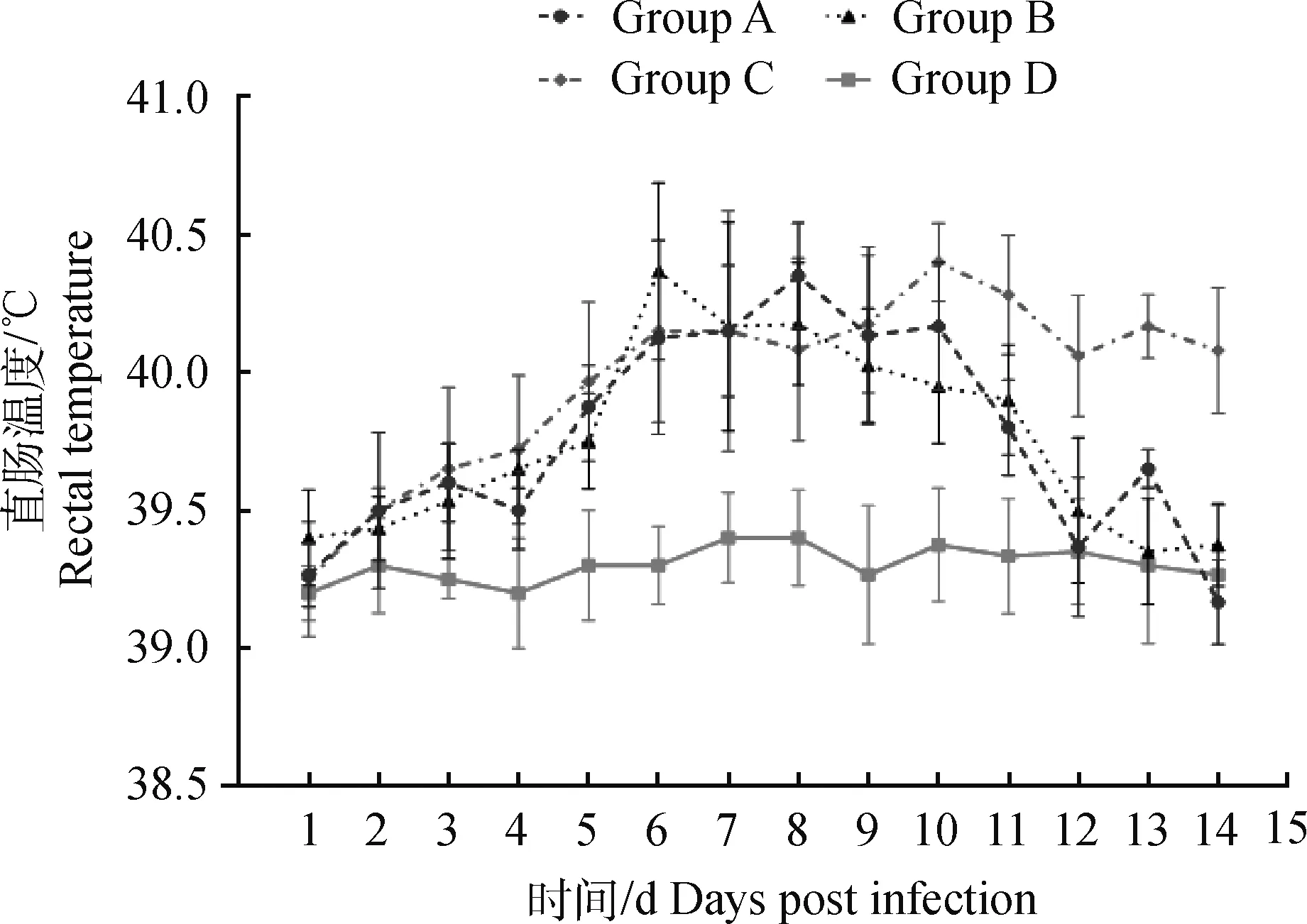
图1 仔猪直肠温度变化Fig.1 Rectal temperature changes in piglets
2.2 仔猪肺组织眼观病理变化
攻毒14 d,各组随机选1头仔猪处死,眼观病变主要集中在肺部,A组仔猪肺略显苍白,边缘有少许实病,肺叶轻度皱缩(图2a)。B组仔猪肺暗红色,有部分出血点,边缘及肺叶出血,小面积实变,肺叶少许皱缩(图2b)。C组仔猪肺颜色更深,实变更为明显,肺表面有出血点,出现明显皱缩和凹凸不平(图2c)。D组仔猪肺粉红色、饱满、无皱缩(图2d)。

a. A组仔猪肺;b. B组仔猪肺;c. C组仔猪肺;d. D组仔猪肺a. Lung from the piglet in group A; b. Lung from the piglet in group B; c. Lung from the piglet in group C; d. Lung from the piglet in group D 图2 各组仔猪肺组织眼观病理变化Fig.2 Gross lesions in lungs from the piglets in different groups
2.3 仔猪肺组织病理学变化
分别在10倍物镜下观察仔猪肺泡腔和肺泡壁(图3a~d);在40倍物镜下观察仔猪支气管管腔及官腔周围淋巴细胞浸润情况(图3e~h)。A组可观察到少量肺泡结构破坏,肺泡壁稍增厚(图3a);支气管上皮细胞肿大、增生,管腔内有炎性渗出物和脱落的细胞以及少量巨噬细胞,细支气管周围大量有淋巴细胞和巨噬细胞浸润(图3e)。B组少量肺泡结构破坏,肺泡壁增厚,厚薄不均匀(图3b);支气管上皮细胞肿大、增生,管腔内有炎性渗出物和脱落的细胞以及少量巨噬细胞,细支气管周围有大量淋巴细胞和巨噬细胞浸润(图3f)。C组肺泡结构大量破坏,肺泡壁有大量淋巴细胞浸润,肺泡壁增厚导致肺泡狭窄(图3c);支气管上皮细胞肿大、增生,管腔内有炎性渗出物和脱落的细胞以及大量巨噬细胞,细支气管周围有大量淋巴细胞和巨噬细胞浸润(图3g)。D组肺泡结构清晰,无明显病变(图3d);支气管上皮细胞无明显病变,管腔内无渗出物(图3h)。

a、e. A组仔猪肺组织病理学变化;b、f. B组仔猪肺组织病理学变化;c、g. C组仔猪肺组织病理学变化;d、h. D组仔猪肺组织病理学变化a, e. Micro-lesions in lungs from piglet in group A; b, f. Micro-lesions in lungs from piglet in group B; c, g. Micro-lesions in lungs from piglet in group C; d, h. Micro-lesions in lung from piglets in group D图3 各组仔猪肺组织病理学变化Fig.3 Micro-lesions in lungs from piglets in each group
2.4 仔猪脾和淋巴结组织病理变化
为观察参虎败毒颗粒组织毒性和PRRSV对免疫器官的影响,取各组仔猪脾和淋巴结制作组织病理学切片。其中A组连续用药17 d,B组连续用药14 d。结果发现,各组脾和淋巴结组织结构未受到明显影响,各组脾组织中脾小结结构清晰,无明显病变(图4a~d);各组淋巴结无明显病变,生发中心结构清晰,淋巴细胞数量没有明显变化(图4e~h)。
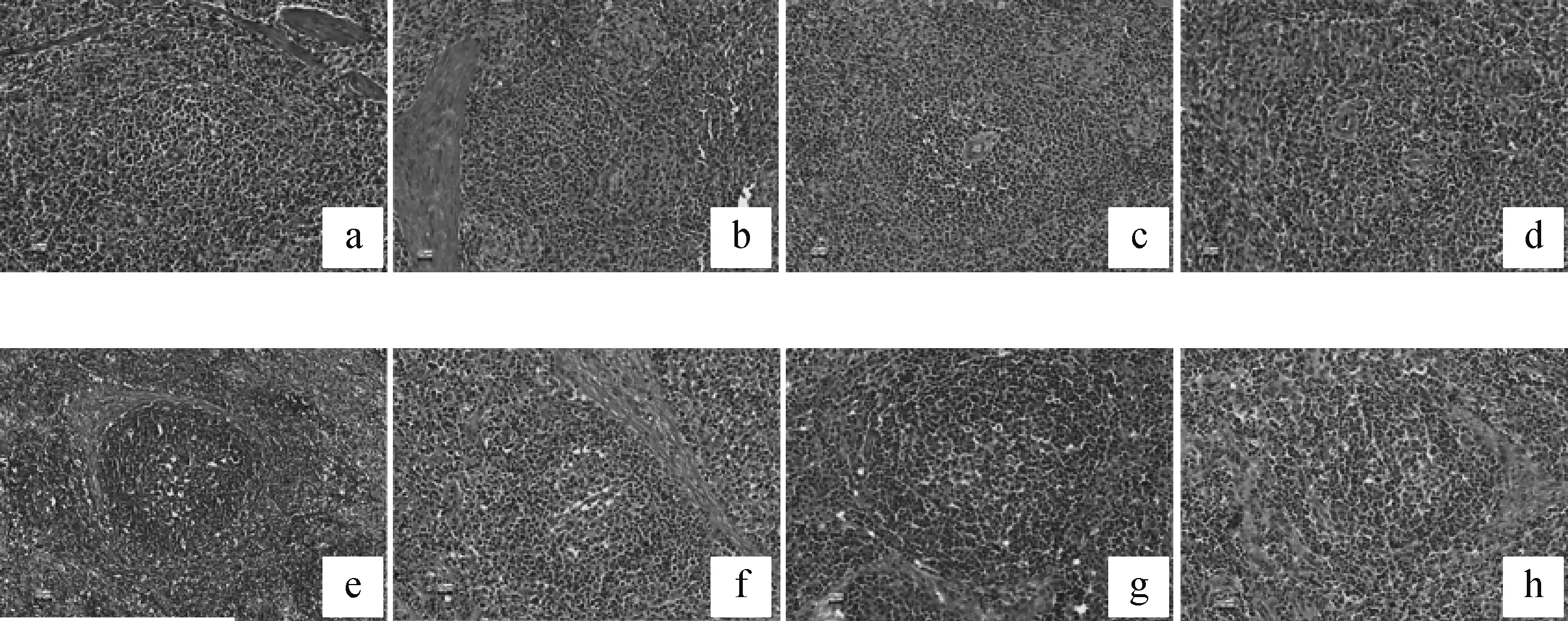
a~d. A~D组仔猪脾组织病理学变化;e~h. A~D组仔猪淋巴结组织病理学变化a-d. Micro-lesions in spleens of the piglets from Group A-D; e-h. Micro-lesions in lymph nodes of the piglets from Group A-D图4 各组仔猪脾和淋巴结组织病理学变化(10×)Fig.4 Micro-lesions in spleens and lymph nodes of the piglets from different groups (10×)
2.5 仔猪血液中PRRSV载量
RT-qPCR检测攻毒后1、3、5、7、14、21和28 d仔猪全血样品,当Ct > 35时判定为阴性,A组仔猪21 d PRRSV检出比例为2/4,28 d 降为0/4;B组仔猪21 d 检出比例为4/4,28 d降为0/4;C组仔猪21 d 检出比例为4/4,28 d降为3/4;D组全程检出比例均为0/4 (表3)。
A、B组部分猪在21和28 d 时PRRSV检测为阴性,因此,仅对1、3、5、7和14 d仔猪全血病毒载量进行定量分析。结果如图5所示,A、B、C组仔猪病毒载量均在第5天达到峰值,随后逐渐下降。A组在攻毒后第3、5、7、14天病毒载量均极显著低于C组(P<0.01)。B组在攻毒后第3和5天病毒载量极显著低于C组(P<0.01),在攻毒后第7和14天病毒载量显著低于C组(P<0.05)。

表3 仔猪血液中PRRSV检出比例

a. 仔猪PRRSV病毒载量;b. RT-qPCR标准曲线(y=-3.195x+39.801,R2=0.998)。ns表示差异不显著,下同a.PRRSV viral load in piglets; b. Standard curve of RT-qPCR (y=-3.195x+39.801,R2=0.998). ns represents non-significant difference, same as below图5 RT-qPCR检测全血样品中PRRSV载量Fig.5 RT-qPCR analyze viral loads in blood samples
2.6 仔猪肺组织PRRSV载量
RT-qPCR检测攻毒后14 d A、B、C组仔猪肺组织PRRSV载量,β-actin为内参,将病毒载量最少的组作为参照。结果显示,C组病毒载量显著高于A组(P<0.05), A、B组差异不明显(P>0.05,图6)。
2.7 仔猪PRRSV抗体产生情况
A、B、C组仔猪PRRSV抗体均在第14天转阳,A、B组在第21天抗体S/P值达到峰值,随后下降(图7a、b),C组在攻毒后28 d抗体S/P值达到峰值(图7c)。A组仔猪抗体(S/P平均值1.061)低于B组(S/P平均值1.913)和C组(S/P平均值1.744)(图7d),但差异不显著,A组抗体离散度小于其他两组。

图6 各组仔猪肺组织PRRSV载量Fig.6 Viral loads in lungs from the piglets in different groups

a.A组抗体S/P值;b. B组抗体S/P值;c. C组抗体S/P值;d. 各组相对抗体S/P值a. S/P value of group A; b. S/P value of group B; c. S/P value of group C; d. Relative S/P value in each group图7 PRRSV抗体产生情况Fig.7 The production of PRRSV antibodies
3 讨 论
参虎败毒颗粒组方起源于古方七清败毒颗粒,主要成分为黄芩、虎杖、白头翁、苦参、板蓝根、大青叶和绵马贯众。黄芩具有清热燥湿,泻火解毒的作用,其多糖成分主要包括黄芩苷、黄芩素等[15]。黄芩苷与黄芩素均能不同程度地干扰和抑制病毒的复制增殖[16],体外抗PRRSV中药单体筛选试验中,黄芩苷在最大安全浓度(18 μmol·L-1)时对PRRSV具有较好的抑制作用和直接杀灭作用,但在低浓度(9 μmol·L-1)时抗PRRSV作用不明显[17],而以黄芩为主要成分的栀子四黄散饲喂感染PRRSV的猪,发现其具有减轻临床症状的作用,也可促进IgG、IFN-γ的产生和抑制IL-10的升高[18]。虎杖具有清热祛湿,退热止痛的作用,其主要活性成分包括白藜芦醇和大黄素等,白藜芦醇对许多DNA和RNA病毒具有抑制作用和免疫调节作用[19-20],中药体外抗PRRSV结果发现,虎杖具有显著的抗PRRSV作用,其抑制率可达90%以上[21]。白头翁具有清热解毒,凉血止痢的作用,白头翁多糖成分主要为白头翁皂苷、白头翁素和三萜酸等[22],体外抗PRRSV试验结果表明,白头翁粗提取物对PRRSV感染Marc-145细胞具有显著的抑制作用、直接杀灭作用和阻断作用[23]。苦参具有清热利湿,抗菌消炎的作用,苦参碱是其主要活性成分,有研究显示,苦参碱提前作用于Marc-145细胞后接毒可显著降低细胞CD163和CD151的表达,但单独使用苦参碱作用于细胞时不会抑制CD163和CD151的表达[24],另有研究表明,苦参碱可能在细胞感染PRRSV后不同时间点抑制不同的细胞受体而发挥抗病毒作用[25]。板蓝根的功效是清热解毒、凉血止咳,其主要活性成分板蓝根多糖具有较好的抗病毒效果和免疫增强作用[26],体外抗病毒试验结果表明,板蓝根多糖对PRRSV具有较强的阻断作用和抑制作用,但在低浓度时对PRRSV无直接杀灭作用[27-28],另有研究表明,通过饲喂板蓝根提取物可显著抑制PRRSV弱毒疫苗免疫后猪体内病毒核酸载量,且病毒核酸载量在试验过程中呈下降趋势[29]。
本研究中,提前和感染同时药物处理的两组仔猪在攻毒后12 d体温恢复至正常,而无药物处理感染组体温在14 d仍高于40 ℃,并且肺部眼观和组织病理变化结果都显示,饲喂参虎败毒颗粒可显著减轻PRRSV对肺的损伤,该结果与解慧梅等[18]使用栀子四黄散治疗感染PRRSV仔猪的结果相似。药物处理可减轻PRRSV感染引起的临床症状,本试验中设置了提前药物处理组,结果显示,提前预防用药效果更好,提示中药制剂可能对PRRSV的预防作用强于治疗作用。饲喂参虎败毒颗粒的两组仔猪在攻毒后14 d内均可极显著或显著抑制猪体内PRRSV载量,促进PRRSV的清除,该结果和王惠[30]研究的板蓝根配合不同中药制剂可降低PRRSV载量结果一致,且提前预防用药效果优于接毒同时用药,这可能与仔猪感染PRRSV前含有一定的血药浓度有关。PRRSV抗体S/P值结果显示,3组仔猪血清PRRSV抗体阳性率均在攻毒后14 d达到100%,但饲喂参虎败毒颗粒的两组仔猪PRRSV抗体峰值提前,提前药物处理组抗体S/P值低于无药物处理感染组(病毒对照组),与林昌华等[31-32]提前饲喂月桂酸降低PRRSV抗体水平的结果相似,不同的是,饲喂月桂酸后PRRSV抗体峰值与对照组保持一致,而本试验中饲喂参虎败毒颗粒后可使PRRSV抗体峰值提前,这可能与药物的免疫调节作用有关,需进一步研究。
JXA1毒株为高致病PRRSV毒株,但试验过程中未造成感染仔猪死亡,可能与接种剂量(2 mL×104.7TCID50·mL-1)偏少、病毒多次细胞传代(30代)导致毒力下降或试验仔猪日龄偏大有关(35日龄),但攻毒仍然造成了明显的肺组织病理损伤,药物处理组和感染组存在明显的眼观和组织病理变化差异,可以证明药物确实能够抑制PRRSV的致病变作用,对试验预期效果影响不大。
4 结 论
综上所述,参虎败毒颗粒可显著减轻PRRSV感染造成的肺损伤、降低病毒血症、促进病毒清除,且预防性用药效果更好,提示参虎败毒颗粒可作为预防和治疗PRRSV的药物。另外,参虎败毒颗粒可以缩短PRRSV病毒血症持续时间,提示可以在接种PRRSV弱毒疫苗后使用,以减少疫苗毒猪体带毒时间,降低弱毒疫苗变异返强风险。本研究证明了参虎败毒颗粒具有很好的体内抗PRRSV的作用,为PRRSV临床防控用药提供了重要的理论支撑,同时为更加高效的抗PRRSV复方中药的研究提供参考数据。

