牦牛源正呼肠孤病毒2型的检测和分离鉴定
吕 珽,陈虹吟,汤 承,2,岳 华,2*
(1.西南民族大学畜牧兽医学院,成都 610041; 2.动物医学四川省高校重点实验室,成都 610041)
哺乳动物正呼肠孤病毒(mammalian orthoreovirus,MRV)属于呼肠病毒科(Reoviridae)棘突呼肠病毒亚科(Spinareovirinae)正呼肠孤病毒属(Orthoreovirus),是一种双链RNA病毒,其宿主谱极为广泛,可感染猪、牛、绵羊、猫、犬、猴、狒狒、水貂、小鼠与蝙蝠以及人在内的多种哺乳动物,呼吸道和肠道是病毒的主要感染部位[1]。MRV基因组大小约23 500 bp,分10个节段(L1~L3,M1~M3,S1~S4)。S1基因编码σ1和σ1 s两个蛋白,σ1为结构蛋白,可决定MRV的血清型,与受体结合、组织嗜性以及血凝反应密切相关[2-3]。根据中和试验和血凝抑制试验的结果,MRV可分为4种血清型,其代表株分别为Lang-T1L(MRV-1)、Jones-T2 J(MRV-2)、Dearing-T3D (MRV-3)与Ndelle-T4 N (MRV-4)。由于不同血清型的MRV在S1基因编码的σ1蛋白中包含特定的氨基酸插入和缺失,导致不同血清型的MRV S1序列相似性较低,因此也可采用S1基因序列的进化分析进行基因分型,其结果与中和试验和血凝抑制试验分型结果是一致的[4-7]。
迄今为止,MRV-2已在人、蝙蝠、田鼠、狮子、白尾鹿、猪等多种宿主上发现并分离,具有广泛的地域分布,包括中国、意大利、斯洛文尼亚等国家[8-12]。MRV-2与多种人类疾病相关,包括呼吸道感染、脑炎和腹泻[13-14]。2003年,SARS疫情期间,在北京某医院4例SARS患者的鼻咽拭子中也检测到MRV-2阳性,这些毒株可能起源于国内的蝙蝠,并可引起猕猴和豚鼠严重呼吸道疾病[10-11,15-16]。最近,本实验室在腹泻仔猪中分离到MRV-2,分离毒株能引起仔猪严重腹泻[17]。综上表明,MRV-2毒株可能对人和动物有较强的致病性,其对公共卫生的危害值得关注。
目前,已经有很多牛源MRV病毒株分离的报道,分离毒株均为1型[18-21]。但是还未见MRV-2在牛上的分离报道。牦牛是青藏高原农牧民不可或缺的生产生活资料,由于MRV在牛上的感染普遍,但对牛的危害尚不清楚,因此需要进一步研究。本研究旨在是调查MRV在川西北牦牛上的感染情况,并对病毒进行分离鉴定。
1 材料与方法
1.1 临床样本与细胞系
72份牦牛犊牛腹泻样本于2018年6—8月采自川西北15个牧场(若尔盖县35份、红原县34份、阿坝县13份);15份血清样本为2018年6月采自若尔盖县(7份)和红原县(8份)的腹泻牦牛。所有样本于-80 ℃保存备用。用于分离病毒的Vero细胞系由西南民族大学动物医学实验室保存。
1.2 核酸提取
300 μL处理好的样本按照Trizol试剂说明书提取总RNA,并反转录合成cDNA,于-20 ℃保存。
1.3 样本MRV RT-PCR检测
采用文献[22]报道的检测MRV核酸的RT-PCR方法对提取的核酸样本进行检测,靶基因为L1,引物序列:5′-TTCACTCAGGCATTATCCGA-3′(上游引物);5′-TCCGCTTCTGACTCCTGA-3′(下游引物),引物由上海生工生物工程技术服务有限公司合成。阳性PCR产物进行双向测序。
1.4 阳性样本血清型鉴定
采用本实验室建立的RT-PCR方法对MRV核酸阳性样本进行血清型鉴定:5′-GGTCAAGGATTGGAAAAGACGG-3′(上游引物),5′-CGAACTTACCAGATGCGAGGA-3′(下游引物)目的片段为601 bp。阳性PCR产物进行双向测序。
1.5 病毒的分离纯化和TCID50测定
将处理好的阳性粪便样本接种到Vero细胞上,按照本实验室报道的方法[17]进行病毒的分离纯化和TCID50测定。
1.6 病毒鉴定
1.6.1 分离株的RT-PCR鉴定 纯化后的病毒液按照“1.3”的方法进行核酸提取,按照“1.4”和“1.5”的方法进行检测,将PCR产物双向测序,测序结果进行BLAST比对。
1.6.2 病毒分离株电镜观察 收集病毒感染的细胞,1 500 r·min-1离心10 min,弃上清液,加入0.5%戊二醛固定,4 ℃静置10 min,12 000 r·min-1离心13 min,弃上清,加入3%戊二醛固定液,送至成都里来医学实验中心进行透射电子显微镜观察。
1.7 MRV2分离株基因组的扩增
设计29对引物(表1),对分离株基因组进行分段扩增,对扩增产物进行克隆转化后交由生工生物工程有限公司测序。用DNAStar 7.0分析序列,ORF Finder工具预测开放阅读框。

表1 扩增MRV2基因组的引物信息
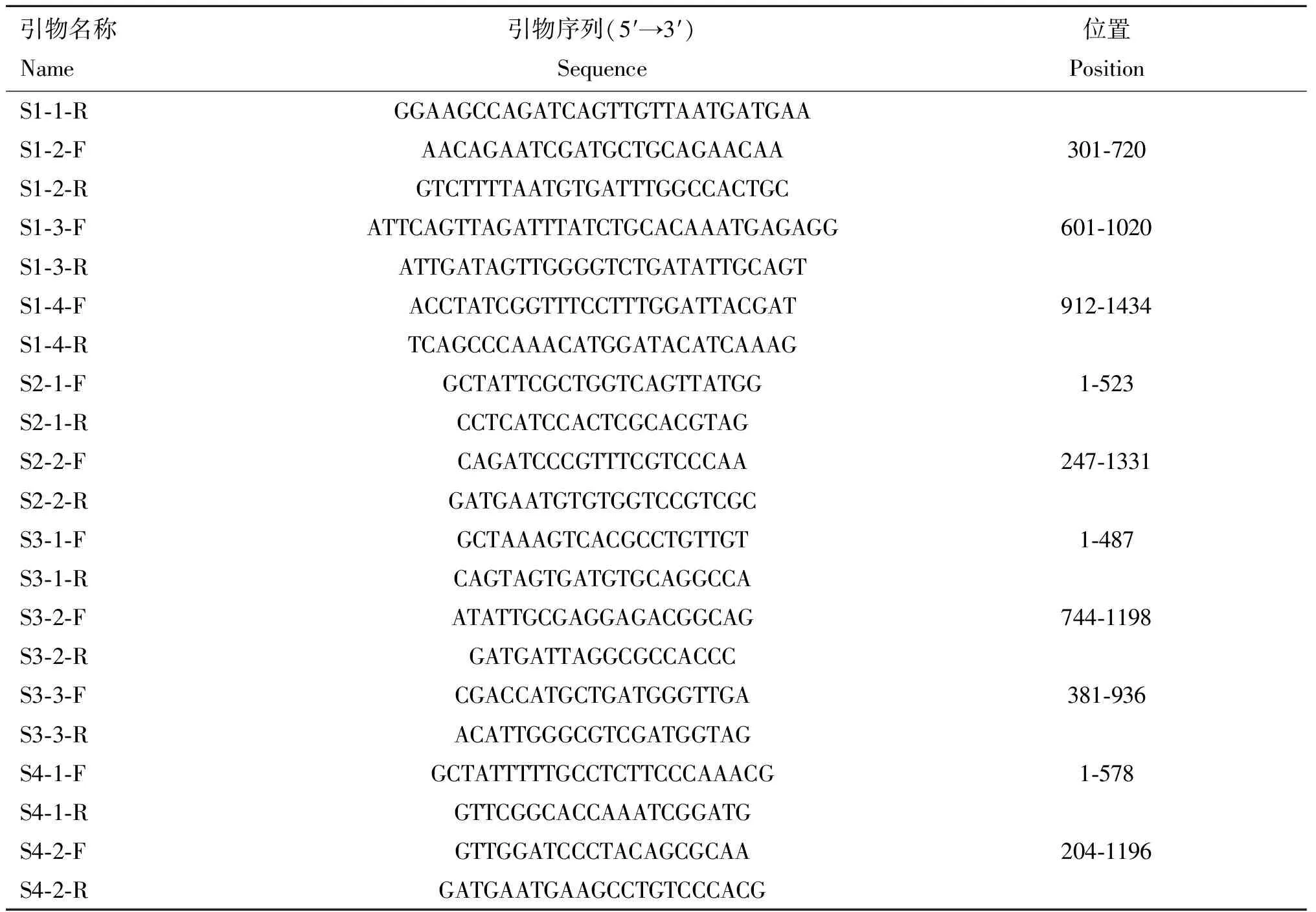
(转下页 Carried forward)
1.8 序列比对和进化分析
利用DNAStar 7.0软件拼接序列并分析同源性。使用MEGA7.0对S1进行多序列比对,并选取GenBank中登录的MRV-1、MRV-2、MRV-3代表毒株的S1完整序列,采用最大似然法构建系统发育树,Bootstrap值为1 000。
2 结 果
2.1 牦牛样本中MRV的检测
72份牦牛腹泻粪便样本检测出MRV阳性样本15份,阳性率为20.83%;15份血清样本检出6份阳性,检出率为40%。6份血清阳性样本对应的腹泻粪便样本中MRV均为阳性。
2.2 临床样本中MRV血清型鉴定
采用本实验室特异性检测MRV-2的RT-PCR方法,从15份MRV核酸阳性样本中扩增出9个S1基因片段,来自6个牧场,测序结果经BLAST比对分析,显示为MRV-2的S1基因片段。6份阳性血清核酸样本中扩增出的5个S1基因片段,来自3个牧场,测序结果也证实为MRV-2的S1基因片段。
本试验获得的14条S1片段核苷酸长度为601 bp(GenBank登录号:MW149466-MW149479),序列相似性为89.68%~100.00%,采用最大似然法构建系统发育树,可见本试验获得的14份的阳性样本S1片段核苷酸与MRV-2毒株聚为一支(图1),表明这14个 阳性样本为MRV-2。
2.3 病毒的分离和纯化
阳性样本接毒24 h后出现细胞死亡,连续传至第3代后,感染细胞于接毒12 h后出现稳定病变,表现为细胞变形、固缩、聚集、脱落。连续传至第6代时,收获病毒液进行噬斑纯化获得1株纯化毒株,命名为Yak/AB14/2018,病毒滴度为4×10-8.56TCID50·mL-1。
2.4 病毒分离株的鉴定
2.4.1 RT-PCR鉴定 采用“1.4”和“1.5”的方法检测分离株,将PCR产物测序,测序结果经BLAST比对分析显示为MRVL1基因和MRV-2S1基因的目的片段,证明分离获得了牦牛源MRV-2病毒。

图1 S1基因片段系统发育树Fig.1 Phylogenetic tree based on S1 gene fragment
2.4.2 电镜观察 病毒培养物电镜观察可见病毒粒子在感染细胞的细胞质内呈典型的晶格状排列,该病毒无囊膜,直径约70 nm,与正呼肠孤病毒科病毒的电镜特征一致(图2)。

图2 透射电镜观察病毒粒子Fig.2 Particles observed by transmission electron microscope
2.5 MRV-2分离株基因组的扩增和序列分析
使用29对引物分段扩增获得牦牛源MRV2分离株Yak/AB14/2018基因组,全长23 587 bp,分为10个节段(L1~L3、M1~M3、S1~S4)(GenBank登录号:MW652775-MW652783,MW149479),所有病毒基因组中的片段均未检测到重组事件。10个节段的长度:L1 3 854 bp (1 267 aa)、L2 3 915 bp (1 289 aa)、L3 3902 bp (1 275 aa)、M1 2 304 bp (736 aa)、M2 2 206 bp (708 aa)、M3 2 241 bp (721 aa)、S1 1 434 bp(460 aa)、S2 1 331 bp(418 aa)、S3 1 198 bp (366 aa)、S4 1 196 bp (365 aa);与4种血清型代表株的核苷酸相似度分别为88.1%~99.9%、74.6~99.6%、83.0%~100.0%、71.1%~99.9%、74.7%~100.0%、83.6~100.0%、38.2~98.8%、82.5~100.0%、84.9~100.0%、76.5%~99.2%;氨基酸相似度分别为96.7%~99.9%,90.6%~99.3%,97.5%~99.9%、79.2%~99.7%、93.9%~100.0%、94.9%~100.0%、16.8%~98.8%、97.1%~100.0%、96.4%~100.0%、96.4%~100.0%。每个基因节段与中国猪源毒株遗传关系最近,证明本毒株与中国猪源毒株同源。
2.6 MRV-2分离株S1基因的分子特征
Yak/AB14/2018毒株的S1基因与MRV-2毒株的核苷酸相似性59.6%~98.8%,氨基酸相似性54.7%~98.8%,与国内猪源MRV-2分离株(GenBanK登录号:MN582426)的核苷酸和氨基酸相似性最高,而与其余国内MRV-2毒株的核苷酸相似性为62.2%~65.1%,氨基酸相似性为55.8%~62.0%。与MRV-1毒株的核苷酸相似性为53.5%~54.4%,氨基酸相似性为28.9%~30.7%;与MRV-3的核苷酸相似性为38.2%~39.8%,氨基酸相似性为16.8%~17.3%。
Yak/AB14/2018毒株的S1基因(MW149479)编码的σ1蛋白和国内猪源MRV-2(MN582426)相比有8个氨基酸突变(R5V、R104G、L142S、A143G、S144F、R217K、P312S、I417V);这两个毒株与共同聚为一大支的其余4株MRV-2毒株(AY862138、AY862137、JN799419、KU195673)相比有9个共同的氨基酸突变(N40D、D90 N、D106 N、S154E、K246R、G251R、V301M、D314 N、Q340R);这一大支的6个毒株与其他MRV-2毒株相比,有43个共同的氨基酸突变。
3 讨 论
由于L1在不同血清型的MRV之间最为保守,常用作MRV的分子检测靶标[23],本研究采用靶向L1基因的PCR方法,对牦牛腹泻粪便和血清样本进行MRV检测,检出率为20.83%和40.00%,为当地犊牛腹泻防控提供参考。同时采用靶向S1的RT-PCR方法对MRV阳性核酸进行血清型分型,但由于S1基因的变异较大,目前,还没有通用的分型引物,所以采用文献[21]报道的方法定型失败,因此自行设计引物进行定型。本试验从牦牛腹泻粪便中MRV2的检出率为12.5%,占MRV阳性样本的60%,其余阳性样本定型失败可能是由于序列变异大,综上表明,MRV2是当地牦牛MRV的优势流行株,其生物学意义还需进一步研究。这些牦牛源MRV-2毒株S1基因与国内猪源MRV2毒株(MN582426)、荷兰人源(AY862138、AY862137)、奥地利猪源(JN799419)、加拿大人源(KU195673)MRV2毒株毒株(图1)有共同区别于其它MRV-2毒株的氨基酸突变,表明进化树上这一大支的MRV2毒株具有广泛的地理分布,其流行和公共卫生意义需要进一步关注。
本试验从牦牛腹泻粪便中成功分离到1株MRV-2毒株,这是首次分离到牦牛源MRV-2毒株,为进一步研究其生物学特性奠定了基础。并成功获得牦牛源MRV-2毒株的完整基因组,且每个基因节段的序列相似度结果显示该分离株与国内猪源毒株同源。现有的资料表明,MRV-2与人的呼吸道疾病、脑炎和腹泻等有关[13-14],国内也报道了从儿童的腹泻粪便样本和重症呼吸道病人口咽拭子中分离到MRV-2[9,11,13],而与Yak/AB14/2018同源的猪源毒株是重配毒株,其L2、S1、S4 3个基因节段与人源毒株同源,所以Yak/AB14/2018是否可感染人进一步研究。该猪源毒株的S3基因来自国内蝙蝠源,这与已有的研究报道蝙蝠可作为移动病毒库参与MRV在不同物种间循环的推测相符[24]。本分离株在牦牛和猪之间循环时蝙蝠可能起到了一定作用,但其具体方式不清楚,需要在牦牛和猪密度较大的地方开展更多监测活动。
MRVS1基因编码的结构蛋白σ1具有独立的宿主细胞结合能力,σ1的结构域介导病毒与细胞表面受体的结合[25]。σ1蛋白尾部插入到病毒衣壳中,起到锚定作用,而头部和中间部分主要在与受体结合、吸附过程中发挥作用[26,27]。不同血清型的σ1蛋白头部、体部与头部结合区域内有42个保守氨基酸位点[28]。与其他MRV-2毒株相比,Yak/AB14/2018有4个独特的氨基酸突变(G104R、S142L、F144S、S312P),其中1个(S312P)位于σ1蛋白受体结合区域。这些独特的氨基酸突变是否与牦牛宿主和青藏高原独特自然地理环境有关还需要进一步研究。和Yak/AB14/2018聚为同一进化分支的5株毒株(图1)均为病人和患病动物中分离到,并且这5个毒株氨基酸序列与其他MRV-2毒株相比,在σ1可能的受体结合区域有12个等同的氨基酸突变,其对σ1蛋白功能的影响需要进一步研究证实。
4 结 论
首次从牦牛腹泻粪便和腹泻牦牛血清中检测到MRV,其中MRV-2是优势毒株,证明MRV可感染牦牛。从腹泻粪便中成功地分离到1株MRV-2毒株,并成功获得该毒株完整基因组,其S1基因编码的蛋白有独特的氨基酸突变,为进一步研究牛源MRV-2的生物学特性奠定了基础。本研究结果为深入了解MRV-2的流行病学和遗传进化提供了参考。

