猪流行性腹泻病毒通过miR-133c-3p/BCL2L2轴调控细胞凋亡
郑红青,吴旭锦*,朱小甫,尹宝英,高军花,李艳芝,植婵萍
(1.咸阳职业技术学院畜牧兽医研究所,咸阳市动物疫病分子生物学诊断技术研究重点实验室,咸阳 712000;2.邢台市农业农村局,邢台 054001; 3.衡水职业技术学院,衡水 053000; 4.广东茂名农林科技职业学院,茂名 525000)
猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)最早于1971年发现于英国[1],2010年之前的毒株由于有疫苗毒株的保护,以零星发病为主要特征。习惯上把2010年之前的PEDV毒株分到G1a组[2]。在2010年10月,我国南方几个省发现了新的变异毒株,这些毒株主要危害7日龄以内的仔猪,仔猪发病率和死亡率可高达90%[3]。PEDV属于冠状病毒科α冠状病毒属,是有膜的单股正义RNA病毒,核酸长约28 kb,包括5′端帽子结构和3′的poly A尾。基因组有6个开放阅读框,分别为ORF1a/1b,分别编码S、M、E、N和ORF3,其中ORF1a/1b又被切割成16个非结构蛋白[4]。这些非结构蛋白对于病毒基因的复制至关重要。S基因可被切割成S1和S2亚单位,与病毒的进入和膜融合有关。由于RNA病毒的易突变决定了PED疫苗研发的难度[5],目前PEDV突变毒株已经在世界范围内进化了4个主要的组群,给我国和世界养猪业造成了重大经济损失[3]。
微小RNA(microRNA,miRNAs)是非编码RNA,长18~25 bp,不编码蛋白质。成熟的microRNAs是单链的,通过与靶蛋白mRNA 3′UTR区域的结合,导致靶蛋白mRNA被切割,从而调控基因的转录水平,甚至影响蛋白翻译的水平,调控蛋白的表达,进而调控细胞内多种生物学过程[6]。近年来的研究表明,miRNAs也可以通过直接与病毒基因组RNA结合或者通过改变细胞的转录谱来影响RNA病毒的复制和致病性[7]。在关于miR-133c-3p的研究中发现,它在多种细胞中发挥着调控细胞凋亡和增殖的作用。体内试验发现,miR-133c-3p可抑制心肌细胞的纤维化和心肌肥大[8]。另外,在癌细胞的研究中发现,miR-133c-3p可抑制细胞的增殖和迁移[9-11]。
BCL2蛋白家族整合了触发细胞存活或凋亡的信号,BCL-w蛋白(又称为BCL2样蛋白2),属于BCL2家族的成员,由BCL2L2基因编码[12]。研究表明,BCL-w的BH1结构域的Gly94残基可以抑制BAK的活性,BCL-w的抗凋亡作用主要通过与BAK、BAX相互作用发挥抑制细胞凋亡的作用[13]。非刺激情况下,BCL-w蛋白通常通过其疏水结构域与线粒体、内质网和核膜的脂质双分子层结合,在静息细胞中,BCL-w的c端结构域在疏水囊内折叠,仅松散地附着在线粒体膜上,当接收到凋亡信号时,BCL-w的c端臂通过促凋亡BH3-only蛋白的连接释放,从而促进BCL-w与线粒体之间的紧密相互作用发挥抗凋亡的作用[14-15]。
关于PEDV感染引起细胞凋亡的机制,有研究对PEDV感染细胞转录组测序发现,感染前后与凋亡相关信号通路分子表达水平差异显著[16],并且PEDV也可以通过p53和线粒体凋亡通路促进细胞凋亡[17-18]。PEDV感染诱导Vero细胞凋亡[19],那么PEDV是否也诱导MARC-145细胞的凋亡,这种凋亡是否由于microRNAs的表达丰度改变影响凋亡相关蛋白的表达,而凋亡蛋白表达量的改变抑制或促进了细胞凋亡呢?对这个问题的研究将对阐明PEDV致病机制具有重要意义。
本研究首先以PEDV感染MARC-145细胞为模型,分析了在PEDV感染过程中与细胞凋亡相关的microRNAs表达丰度的变化,选取差异表达最明显的miR-133c-3p进一步探究PEDV感染诱导细胞凋亡的可能机制,以期为明确PEDV的胞内复制机制及抵抗PEDV感染提供新的参考资料。
1 材料与方法
1.1 材料和仪器
MARC-145细胞(非洲绿猴肾上皮细胞)(咸阳市动物疫病分子生物学诊断技术研究重点实验室)实验室保存,Vero细胞为实验室保存,高糖DMEM细胞培养液购自美国Hyclone公司;减血清培养基OPTI-MEM、胰蛋白酶、转染试剂Lipofectamine 2000、microRNA模拟物(miR-133-3p mimics)、模拟物对照(mimics control)、抑制剂(inhibitor)和抑制剂对照(inhibitor control)、SC、siBCL-w-1、siBCL-w-2、siBCL-w-3、CO2培养箱、生物安全柜均购自美国Thermo公司;胎牛血清购自德国PAN-Biotech公司;荧光定量试剂盒、microRNA第一股RNA合成试剂盒、总RNA提取试剂RNAiso均购自宝生物工程(大连)有限公司;辣根过氧化物酶(HRP)标记的羊抗兔IgG(货号:bs-0295G-HRP)和HRP标记羊抗小鼠IgG(货号:bs-40296G-HRP)购自北京博奥森生物技术有限公司;引物由北京擎科生物公司合成,引物序列见表1;MTT细胞增殖及细胞毒性检测试剂盒购自碧云天公司; PEDV N蛋白单克隆抗体由上海兽医研究所童光志研究员馈赠;细胞内参β-actin和BCL-w蛋白的抗体购于细胞信号通路技术公司;pmirGLO质粒购自普洛麦格公司。anti-BCL-w (2724)购自Cell Signaling Technology (CST)。
1.2 病毒和细胞培养
本研究使用的PEDV毒株为CH/HBTS/2017(GenBank收录号:MH581489.1),作者于2018年分离自河北唐山某暴发猪流行性腹泻猪场的病料中。MARC-145细胞用含有10% 胎牛血清、1%双抗的高糖DMEM 培养基,在37 ℃、5% CO2培养箱中培养。细胞传代时用0.25%胰蛋白酶进行消化传代。
1.3 猪流行性腹泻病毒感染MARC-145细胞
用Vero细胞扩增病毒,待细胞病变80%时收毒,TCID50测病毒滴度,细胞长到80%融合度,用PBS缓冲液清洗3遍,配制含5 μg·mL-1胰酶的DMEM感染液,将病毒加到MARC-145细胞上,轻轻摇匀,孵育1.5 h后弃掉毒液,换液在CO2培养箱继续培养。
1.4 免疫荧光试验
MARC-145长成单层细胞后,用含2 μg·mL-1胰酶的DMEM培养液感染CH/HBTS/2017毒株,感染复数为0.1 MOI。12 h后留样用4%多聚甲醛4 ℃ 固定30 min,再用1% Triton 100室温通透10 min, PBS洗3次,每次5 min,5%脱脂奶粉封闭1 h,一抗PEDV N蛋白抗体过夜孵育,PBS洗3次, 每次5 min。FITC标记的羊抗小鼠IgG(货号:bs-0296G-FITC)室温孵育1 h,Hochest 33258染核5 min, 封片观察。
1.5 TCID50的测定
经过24 h培养生长状态良好的MARC-145细胞,消化后将浓度稀释到2×105个·mL-1左右,铺到96孔板,每孔加100 μL细胞混悬液,将培养板放到细胞培养箱培养24 h长成单层细胞。用10支1.5 mL离心管,每管900 μL 含10 μg·mL-1胰酶的DMEM培养基依次将病毒倍比稀释(从10-1稀释到10-10),将96孔板培养的单层细胞用PBS洗3遍后, 按照96孔板上的列数从第1~10列将病毒稀释液依次加入,剩余只加培养基作对照。第3天用Reed-Muench方法计算TCID50。
1.6 细胞转染
将MARC-145细胞以2×105个·孔-1的密度接种至12 孔板,待细胞长到80%融合度时进行转染。按照LipofectamineTM2000 转染试剂使用说明书,将mimics control(MC)、miR-133c-3p、inhibitor、inhibitor control(IC)和LipofectamineTM2000分别跟OPTI-MEM混合,室温静置5 min后,将合成的模拟物和抑制剂的混合液及其对照分别跟Lipofectamine混合液混合,轻轻混匀,静置15 min后,轻轻滴到细胞培养液上。
1.7 荧光定量PCR(RT-qPCR)
培养细胞处理后用PBS冲洗3遍,加RNAiso到细胞表面,静置5 min,按照厂家说明书提取细胞的总RNA。用500 ng的细胞总RNA用逆转录试剂盒得到cDNA,按照microRNA逆转录试剂盒说明书所示,合成microRNA的cDNA,使用定量PCR试剂盒和特异性引物(表1)进行荧光定量PCR的反应体系配制,使用荧光定量PCR仪在反应条件:95 ℃ 5 min, 95 ℃ 20 s、62 ℃ 30 s,40个循环,72 ℃ 3 min条件下进行反应。
其中microRNA内参使用试剂盒中的U6 small RNA引物,BCL2L2内参为GAPDH,采用2-ΔΔCt法计算miRNA和BCL2L2 mRNA表达。
1.8 MTT试验
每孔约5×103个细胞接种于96孔板,到80%融合度时将模拟物对照按照0、20、50 nmol·L-1转染MARC-145细胞,6 h后更换新鲜培养基,24 h后移除培养基,每孔加20 μL 5 mg·mL-1无菌的MTT染料,37 ℃培养4 h,每孔加150 μL的DMSO,读取490 nm的吸光值。
1.9 流式细胞术
经过不同处理的细胞用胰酶消化下来,用PBS洗1遍,用FACS buffer重悬,单细胞悬液在Annexin V中室温孵育30 min上机检测。
1.10 荧光素酶报告基因试验
将含有miR-133c-3p结合位点的BCL2L2 3′UTR区域的野生型(WT)和突变型(MuT)连接到pmirGLO荧光素酶报告基因质粒,分别命名为pmir-BCL2L2-WT和pmir-BCL2L2-MuT,将miR-133c-3p模拟物和模拟物对照(MC)跟上述2个质粒分别转染进MARC-145细胞,48 h后,按照荧光素酶报告基因试剂盒使用说明使用多功能酶标仪检测荧光素酶活性。

表1 引物序列
1.11 Western blot
将含蛋白酶抑制剂的RIPA加到处理细胞表面,冰上孵育30 min,12 000 r·min-1离心5 min,吸取上清提取细胞的总蛋白。提取的总蛋白用蛋白定量试剂盒定量,SDS-PAGE电泳时每孔加相同的蛋白量,电泳完毕转到PVDF膜,转膜完成后用5%的脱脂奶粉液封闭,然后用一抗[PEDV N蛋白抗体或anti-BCL-w (2724)]4 ℃孵育过夜,再用HRP标记二抗(羊抗小鼠IgG或羊抗兔IgG)室温孵育2 h,TBST洗3遍,使用曝光显影液进行曝光。
1.12 统计分析

2 结 果
2.1 PEDV感染MARC-145细胞并诱导细胞凋亡
将PEDV毒株CH/HBTS/2018株以0.1和1 MOI感染MARC-145细胞,细胞在0、12和24 h后细胞病变如图1a所示,在感染12 h后细胞也出现了融合的现象,但融合细胞数量比较少,在感染24 h后1 MOI感染的细胞病变出现了片状融合。12和24 h病毒的滴度如图1b所示,1 MOI感染后24 h病毒滴度在6.5 lgTCID50·mL-1左右,0.1 MOI感染24 h后病毒滴度在4.2 lg TCID50·mL-1左右。由结果可知,病毒可以在MACR-145细胞高效增殖。在病毒感染12 h后留样,间接免疫荧光示踪病毒,检测病毒感染细胞的情况,如图1c所示,病毒以0.5和0.1 MOI感染可以在MARC-145细胞内高效复制。分别以0.0、0.1、0.5、1.0 MOI感染MARC-145细胞,流式细胞术检测PEDV感染MarC145细胞24 h后细胞的凋亡情况,如图1e所示,与对照组相比,感染0.1 MOI病毒12 h后,细胞凋亡率显著升高(图1d)(P<0.05),随着感染复数的增大,细胞凋亡率显著增加(P<0.01)。
2.2 PEDV感染引起miR-133c-3p显著上调
为了进一步探究PEDV感染引起细胞凋亡的原因,进一步从RNA水平揭示PEDV诱导细胞凋亡的机制,选择了6个文献中报道的影响细胞凋亡的microRNAs,分别是miR-133c-3p、miR-7、miR-186-5p、miR-155、miR-149-5p、miR-138-5p。使用RT-qPCR方法检测在PEDV感染前后它们的表达差异。如图2所示,miR-133c-3p的表达显著上调(P<0.01),miR-149-5p略有升高(P<0.05),miR-138-5p表达下调(P<0.05),miR-7、miR-186-5p和miR-155的表达在PEDV感染前后差异无统计学意义(P>0.05)。
2.3 过表达miR-133c-3p促进了细胞凋亡
将合成的miR-133c-3p的模拟物对照(MC)转染细胞后,用MTT试验检测细胞活性,结果表明0、20、30、50 nmol·L-1的转染浓度不影响细胞活性(图3a)。转染miR-133c-3p后6 h感染PEDV,继续感染18 h后收样,流式细胞术检测细胞凋亡,结果显示,miR-133c-3p过表达并感染PEDV后细胞凋亡率显著升高(P<0.001)(图3)。
2.4 敲低miR-133c-3p抑制了病毒感染引起的细胞凋亡
将miR-133c-3p的抑制剂转染MARC-145 12 h换液后感染1 MOI病毒,继续培养12 h后收取细胞样品,流式细胞术检测细胞凋亡情况,结果显示,敲低miR-133c-3p后细胞凋亡率明显下降(P<0.01)(图4)。
2.5 PEDV感染后下调了miR-133c-3p的靶基因BCL-w的表达
为了进一步确认miR-133c-3p调控的靶基因,使用生物信息学在线预测网站(http://www.targetscan.org/vert_72/)预测其靶基因,荧光素酶报告基因用来验证miR-133c-3p和BCL2L2 3′UTR区域的结合。结果发现,BCL2L2基因的3′UTR区域有miR-133c-3p的结合位点(图5a),进一步检测了miR-133c-3p的模拟物(mimic)和模拟物对照(MC)转染组的荧光素酶活性,结果发现,miR-133c-3p可以显著降低野生型报告基因质粒的荧光素酶活性,而对突变型质粒没有影响(P<0.01),这表明miR-133c-3p可以与BCL2L2靶基因区域的结合(图5b)。Western blot检测了细胞内转染miR-133c-3p 24 h时BCL-w蛋白的表达,结果发现,miR-133c-3p可以在细胞内下调BCL-w基因的表达水平,并且PEDV感染也可以下调BCL-w的表达水平(P<0.001)(图5c)。
2.6 敲低BCL-w可以促进细胞凋亡
为了检测BCL-w是否影响细胞凋亡,合成3条siRNAs,分别将siRNA control(SC)、siBCL-w-1、siBC-Lw-2、siBCL-w-3(序列见表1)转染MARC-145,Western blot检测细胞内BCL-w的表达水平,由图6a可知,siBCL2L2-3敲除效率最高。将SC和siBCL-w-3转染细胞后流式细胞术检测细胞凋亡情况,结果显示,敲低BCL-w的表达水平促进了细胞凋亡(图6b)。

a.不同感染复数PEDV感染MARC-145细胞的病变;b.不同感染复数感染MARC-145细胞后12和24 h后病毒的滴度;c.IFA检测PEDV感染MARC-145细胞的感染情况;d.不同剂量 PEDV 导致细胞凋亡百分比柱状图;e.流式细胞仪检测 PEDV 诱导 MARC-145细胞凋亡程度;与Mock组比较,*. P<0.05和**. P<0.01表示显著差异。下同a. Cytopathy infected with 0.1 and 1 MOI virus in MARC-145 cells. b. Virus titer infected with 0.1 and 1 MOI virus in MARC-145 cells; c. Results of of MARC-145 cells apoptosis that are detected by flow cytometry after 0, 0.1, 0.5, 1 MOI of the PEDV infected; d. Histogram of apoptotic rate in different dose of PEDV; e. The apoptosis of Marc-145 cells induced by PEDV detected by flow cytometry. Compared with Mock group, *.P<0.05, **.P<0.01 and * * *.P<0.001 indicate significant difference at 0.05, 0.01 and 0.001 level, separately, the same as below图1 流式细胞术检测猪流行性腹泻病毒感染MARC-145细胞的凋亡率Fig.1 The apoptotic rate of MARC-145 cells was measured after PEDV infection by using flow cytometry
3 讨 论
PEDV感染仔猪后能引起仔猪尤其是7日龄以内的仔猪严重的腹泻,给我国和世界养猪业造成了严重的经济损失[20-21]。由于RNA病毒易突变的特性,至今没有有效的疫苗可用,因此急需对病毒感染细胞的机制进行深入研究。

图2 与凋亡相关的microRNAs表达情况Fig.2 Expression of microRNAs related to apoptosis
本试验通过检测PEDV感染细胞时凋亡相关microRNAs的表达差异,发现了与PEDV感染关系密切的miR-133c-3p,为了进一步研究miR-133c-3p在PEDV感染过程中所起的作用,过表达miR-133c-3p后发现miR-133c-3p抑制了PEDV的复制,并且促进了感染细胞的凋亡。为了确定miR-133c-3p调控的主要靶点,用生物信息学的方法预测,发现在BCL2L2的3′UTR区域有其结合位点,荧光素酶报告基因试验证明miR-133c-3p可以在体外与BCL2L2 3′UTR区域结合,在过表达miR-133c-3p后发现细胞内BCL-w的表达水平下调。

a.转染不同浓度的模拟物对照,MTT检测细胞活性的影响;b.凋亡率的柱状图;c.流式细胞术检测过表达miR-133c-3p后细胞的凋亡率a. MTT to detect the effect of cell viability after transfection of different concentrations of mimic control; b. Histogram of apoptotic rate; c. The cell apoptosis rate after over-express of miR-133c-3p and then analyzed by flow cytometry图3 过表达miR-133c-3p对细胞凋亡的影响Fig.3 Effect of over-expression of miR-133c-3p on cells apoptosis

与IC组比较,**.P<0.01表示显著差异Compared to IC group, **.P<0.01 indicate a significant difference图4 敲低miR-133c-3p后细胞的凋亡率Fig.4 The apoptosis rate of cells after knock-down of miR-133c-3p

a.生物信息学方法预测在BCL2L2 3′UTR的靶向结合位点;b.miR-133c-3p可以下调野生型质粒的荧光素酶活性;c.过表达miR-133c-3p下调细胞内BCL-w和PEDV蛋白的表达的水平;与MC组比较,**.P<0.01和***.P<0.001表示显著差异a. Bioinformatics methods to predict the target binding site in BCL2L2 3′UTR; b. miR-133c-3p down-regulate the luciferase activity of wild-type plasmids; c. Overexpression of miR-133c-3p down-regulates the level of BCL-w and PEDV in cells; **.P<0.01 and ***.P<0.001 indicate significant difference图5 BCL2L2是miR-133c-3p的靶基因Fig.5 BCL2L2 is the target gene of miR-133c-3p
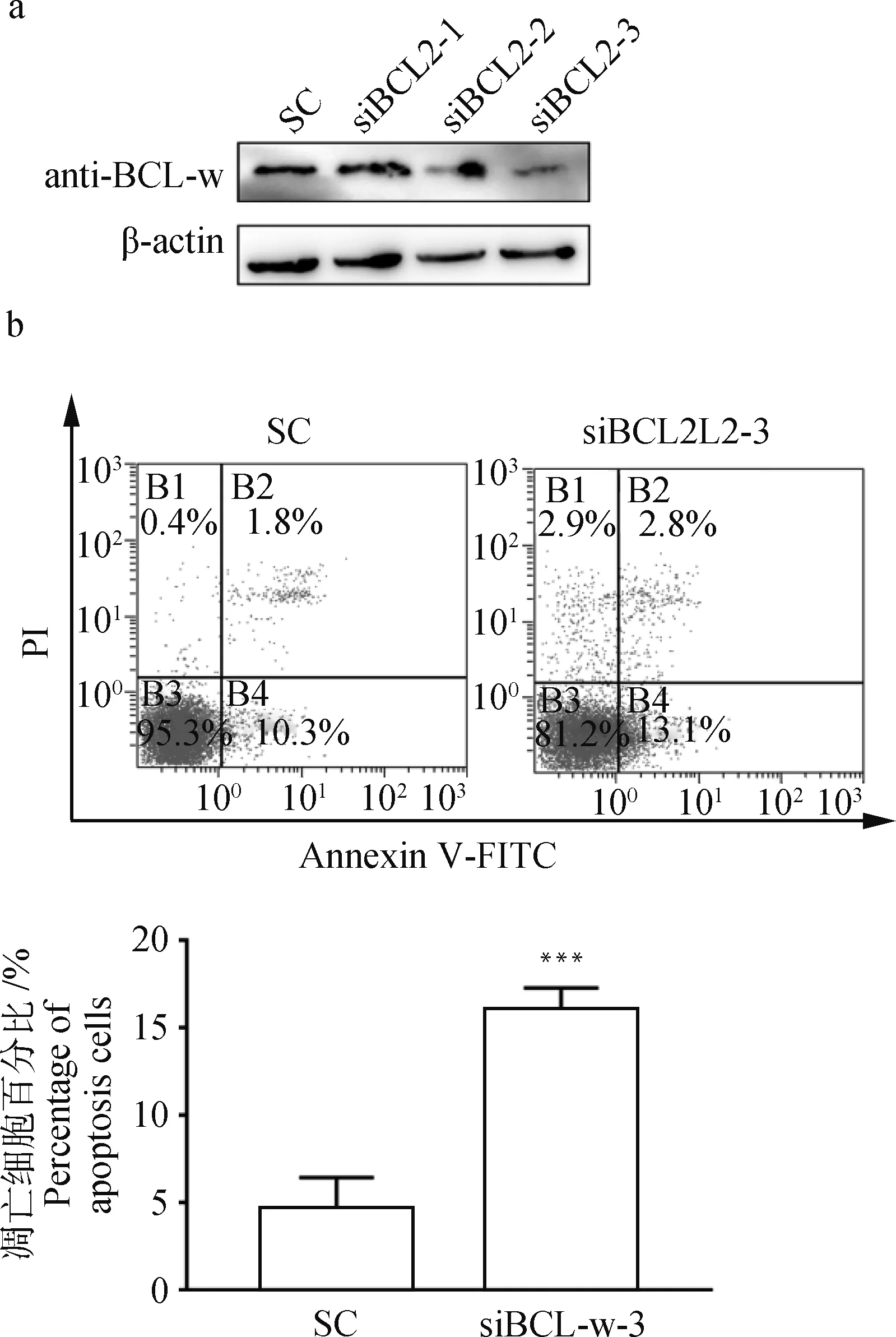
a. Western blot 检测siRNAs的敲除效率;b.流式细胞术检测检测敲低BCL-w后细胞的凋亡情况,***.P<0.001表示显著差异a. The level of BCL-w after know-down of siRNAs; b. The cell apoptosis rate after transfection of siBCL-w and then analyzed by flow cytometry; **. P<0.01 and ***.P<0.001 indicate a significant difference图6 敲低BCL-w诱导细胞凋亡Fig.6 Know-down of BCL-w promote the cell apoptosis
凋亡是细胞为了适应外界刺激发生的程序性的死亡,病毒感染诱导细胞凋亡,而细胞凋亡会抑制病毒持续感染和扩散,从而防止组织进一步损伤[22]。研究表明,许多冠状病毒可以诱导细胞凋亡,如中东呼吸道综合征冠状病毒(MERS)和SARS冠状病毒感染都可以诱导感染细胞的凋亡[23-24],传染性胃肠炎病毒可以诱导PK-15细胞的凋亡[25],而PEDV可以诱导Vero细胞凋亡[18],本研究结果显示,PEDV感染可诱导MARC-145细胞的凋亡,并且随着感染复数的增大凋亡率也相应增加。病毒可以通过诱导凋亡促进病毒释放,也可以在病毒感染的前期抑制细胞凋亡促进病毒的复制[26-27],这可能也意味着凋亡在病毒感染的不同阶段发挥不同的作用。
microRNAs是一类很短的RNA分子,在细胞增殖、分化、死亡和发育这些生物过程中发挥重要的作用,它发挥作用的机制是通过调控基因转录后水平而影响相应蛋白表达水平[22]。病毒在感染细胞的过程中会改变细胞内microRNAs的表达谱,而这些microRNAs会靶向重要的细胞元件,导致细胞生理过程的改变。A型流感病毒感染A549细胞后,miR-34a 的表达显著下降[28],而另一篇报道称A型流感病毒引起miR-29c的表达上调[29],我们先前在MARC-145细胞的研究中发现PEDV的感染能引起miR-671-5p表达的上调[30],本研究发现PEDV的感染能引起细胞miR-133c-3p表达的上调,该结果说明病毒感染可能通过改变microRNAs表达的丰度来改变细胞的生理状态。从microRNAs水平解释PEDV感染细胞时对凋亡的调控,这将为阐明病毒和细胞互作的分子机制提供依据,从而为抗PEDV新方法的开发提供理论基础。
病毒感染引起的microRNA变化有可能影响病毒的复制,很可能病毒存在多种促进和抑制自身复制的机制,这些机制受多种因素的影响处于动态变化中。一方面,microRNAs通过下调凋亡抑制蛋白的表达水平诱导细胞凋亡,如miR-15/16通过下调BCL2促进细胞凋亡[31],miR-186-5p通过下调IGF-1(胰岛素样生长因子)促进细胞凋亡[32],miR-146a通过下调BCL2诱导细胞凋亡[33],另一方面,miRNAs通过下调凋亡激活通路的蛋白抑制细胞凋亡,如miR-C12通过抑制细胞凋亡促进疱疹病毒的复制[34],并且,先前研究表明,miR-133c-3p可以通过靶向几个凋亡抑制蛋白诱导细胞凋亡,如在狼疮肾炎中miR-133c-3p通过靶向LASP1抑制细胞增殖,促进细胞凋亡[35];在胶质母细胞瘤细胞的研究中发现,miR-133c-3p可以通过抑制EGF的表达水平促进细胞凋亡,从而抑制了细胞增殖[11]。而在本研究中,PEDV感染上调了miR-133c-3p的水平,而上调的miR-133c-3p又促进了细胞凋亡,而且敲低BCL-w后诱导细胞凋亡,但是凋亡率没有过表达miR-133c-3p所引起的凋亡率高,这可能提示,miR-133c-3p可能靶向多个凋亡抑制蛋白或通过多种途径影响细胞凋亡。本研究不仅证明了miR-133c-3p诱导凋亡的作用,而且进一步丰富了miR-133c-3p的调控凋亡的机制。
BCL2L2作为BCL2家族蛋白的分子,是重要的凋亡抑制剂,miR-335c-5p通过下调BCL2L2的水平促进了卵巢癌细胞的凋亡,从而促进了化疗的敏感性[36],miR-126a-5p通过下调BCL2L2促进宫颈癌细胞的凋亡[37],BCL2L2是microRNA影响细胞凋亡的过程中一个很重要的靶基因,本研究中,miR-133c-3p靶向调控BCL2L2。该结果提示,miR-133c-3p通过靶向BCL2L2调控细胞凋亡机制有可能是PEDV感染MARC-145细胞引起凋亡很重要的因素。
综上所述,PEDV的感染诱导MARC-145细胞的凋亡,进一步研究发现,PEDV的感染显著上调了miR-133c-3p的表达,而miR-133c-3p通过下调其靶基因下调了凋亡抑制蛋白BCL-w的表达进而诱导了细胞凋亡,本研究为抵抗PEDV新方法的研究提供了理论依据。
4 结 论
PEDV的感染上调了miR-133c-3p的表达,导致BCL-w表达水平降低,从而促进了细胞凋亡。

