甜叶菊绿原酸增强大肠杆菌感染蛋雏鸡免疫力研究
卓春柳,王方方,钟翠红,王 斌,石玉祥,徐美利,武亚南,张永英*
(1.河北工程大学,邯郸 056000; 2.晨光生物科技集团股份有限公司,邯郸 056000)
大肠杆菌病是家禽养殖业十分常见的疾病,饲养密度大、环境条件差、饲养管理不当均可导致家禽机体免疫力急剧下降,诱发应激反应,往往还会造成大肠杆菌等条件病原菌易感性增加[1]。大肠杆菌是正常机体内生态系统的共生菌,但机体内生态系统失调时,可引起机体发病[2],其中,肠外致病性大肠杆菌(avian pathogenicEscherichiacoli, APEC)可引起家禽多种病症,例如脐炎、卵黄囊感染、蜂窝织炎等。APEC虽是肠外致病菌,但APEC与肠道致病性大肠杆菌具有同源性,同样具有肠道致病性[3]。APEC侵袭会导致炎症反应发生,增加IL-1β、IL-2和TNF-α等表达,促进白细胞浸润,从而导致上皮屏障功能受损,诱发大肠杆菌病[4]。机体早期肠道微生物群的变化会影响肠道细菌与肠黏膜宿主细胞之间的相互作用[5],肠道结构在正常状态下保持相对稳定,但在病理状态下,病原微生物及其代谢产物作用于肠道黏膜,其完整性会被破坏,尤其是细胞与细胞间的紧密连接受到损伤时,就会引起病原微生物的侵入[6]。因此,增强肠道上皮屏障功能,维持肠道菌群稳定,抑制APEC黏附定植是抑制APEC致病的关键。
目前,饲料端禁抗、畜禽养殖端“减抗限抗”,APEC对抗生素呈现多种耐药[7],因此,急需开发低成本且绿色安全有效的抗生素替代品以预防大肠杆菌病等细菌性疾病。绿原酸(chlorogenic acid, CGA)是一种天然植物抗菌、抗氧化剂,可提自咖啡豆、水果、蔬菜、杜仲科、菊科及忍冬科等多种植物,具有抗炎抑菌、抗氧化、抗糖尿病、抗癌等生理功能[8-9],其参与机体物质代谢、免疫调控,增强机体细胞免疫能力和体液免疫能力,促进机体免疫系统发育。研究资料表明,摄入CGA可降低多种疾病的风险。畜牧生产中有关CGA在断奶仔猪[10-14]、鱼[15-16]和鼠[17-19]的应用研究已取得一定进展,结果表明,CGA可抑制氧化应激反应,维持肠道微生物菌群稳定[20],抑制肠上皮细胞凋亡,降低肠道通透性,修复肠道结构损伤,调节肠道组织炎症反应,增强肠道屏障功能[19],提高断奶仔猪[12]和鼠[21]机体免疫力,但CGA对蛋雏鸡有何影响却未见报道。
本研究通过腹气囊感染大肠杆菌O78构建蛋雏鸡大肠杆菌感染模型,根据机体抗氧化力、免疫力指标和紧密连接蛋白相关基因表达以及通过对盲肠内容物微生物种类进行高通量测序,探究甜叶菊绿原酸对腹气囊感染蛋雏鸡免疫功能和肠道屏障结构的影响,旨在研究甜叶菊绿原酸对腹气囊感染大肠杆菌O78蛋雏鸡免疫力的作用机制,为甜叶菊绿原酸用作新型抗生素替代品提供基础参数支持。
1 材料与方法
1.1 主要材料
甜叶菊绿原酸(纯度为60%绿原酸)和杜仲素(8%绿原酸)由晨光生物科技集团提供;大肠杆菌O78来自河北工程大学预防实验室。
1.2 试验设计
随机将1日龄、体重无显著差异的360只健康海兰蛋鸡分为6组,分组见表1,空白对照组(C)、大肠杆菌O78处理组(EC0)、1.0 g·L-1杜仲素+大肠杆菌O78处理组(ED1)、1.0 g·L-1CGA+大肠杆菌O78处理组(EC1)、2.0 g·L-1CGA+大肠杆菌O78处理组(EC2)、4.0 g·L-1CGA+大肠杆菌O78处理组(EC4),每组3个重复,每个重复20只鸡,公母各半。预饲7 d后开始正式试验,在蛋雏鸡7日龄感时染大肠杆菌O78:腹气囊注射1.21×108cfu·mL-1大肠杆菌O78悬液,0.5 mL·只-1,并对病死雏鸡进行剖检和实验室检查。同时按表1分别向试验组蛋雏鸡饮水中添加不同药物,每日1次,连用3 d,按饲养标准进行饲养管理,试验动物基础饲粮组成及营养水平见表2,试验周期10 d,饲养试验于2019年在河北省邯郸市河北工程大学生命科学学院实验动物房进行。
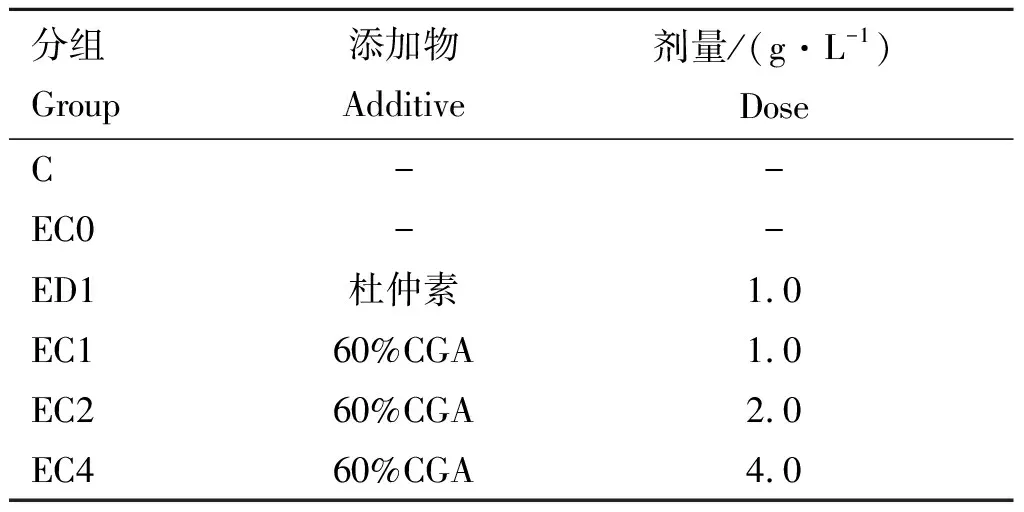
表1 试验分组
1.3 ELISA检测血清免疫相关指标
每组随机取4只鸡,心脏取血,5 000 r·min-1离心5 min,取上清液并分装,获得血清样品,于-20 ℃冰箱冻存待测。严格按照ELISA试剂盒(南京建成生物工程有限公司)说明书检测血清IL-1β、 IL-2、IL-6、IgM、IgA、TNF-α水平。
1.4 实时荧光定量PCR(qRT-PCR)检测肠道因子表达量
每组随机取4只鸡,解剖后取其空肠和回肠,置于-80 ℃超低温冰箱保存。严格按照试剂盒(普洛麦格公司)说明书提取RNA,将经过质检后合格的RNA制备成cDNA,以β-actin作为内参基因,根据NCBI-Gene所收录基因CDS序列,利用Primer5.0、Primer Plus和DNAMAN等软件,设计基因引物,引物序列见表3,引物由苏州金唯智生物科技有限公司天津分公司合成。以上述合成的cDNA作为模板,利用荧光定量PCR仪进行实时荧光定量PCR的扩增。反应体系:模板cDNA溶液1.0 μL,Mix 12.5 μL,上、下游引物各0.5 μL,ddH2O 10.5 μL,总计25 μL。利用2-△Ct相对定量法计算基因的相对表达量,计算公式:△Ct=Ct目的基因-Ct内参基因。
1.5 盲肠食糜微生物菌群16S rDNA测序
每组随机取4只鸡,解剖后无菌采集盲肠组织,置于-80 ℃储存,随后进行高通量测序分析。文库构建及测序分析由北京诺禾致源生物信息科技有限公司完成。

表2 基础饲粮组成及营养水平(风干基础)
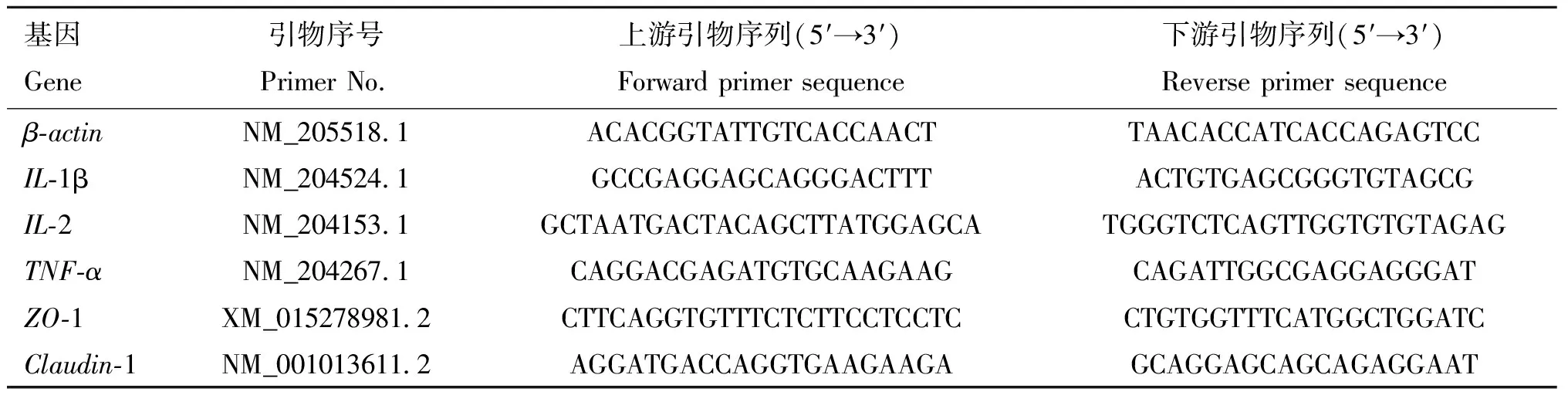
表3 引物序列
1.6 数据分析
本试验数据采用统计学软件 SPSS 20.0 进行处理分析,差异显著性检验采用方差分析,不同字母标注表示差异显著(P<0.05)。柱状图作图软件为GraphPad Prism5。
2 结 果
2.1 甜叶菊绿原酸对腹气囊感染大肠杆菌蛋雏鸡的保护
腹气囊感染大肠杆菌数小时后,个别蛋雏鸡出现精神颓靡、双翅下垂(图1),并排有黄绿色或白色粪便。对病死鸡进行临床检查,可发现鸡大肠杆菌病典型病理变化(图2):心包增厚并覆满白色或黄色纤维性渗出物,肝肿大并覆有白色或淡黄色纤维性渗出物,肠道黏膜出血、脱落。临床检查后取病料进行实验室检查(图3):在麦康凯琼脂培养基上形成桃红色、圆形菌落,在伊红美兰琼脂培养基上形成紫黑色带有金属光泽的圆形菌落,染色、镜检确定其为两端钝圆的革兰阴性短杆菌,后通过生化试验和血清学鉴定,病料中分离的大肠杆菌和感染所用大肠杆菌为同一菌株,表明成功建立了大肠杆菌感染模型。图4显示,腹气囊感染大肠杆菌O78显著增加了蛋雏鸡死亡率(P<0.05),而在应用甜叶菊绿原酸后,蛋雏鸡死亡率明显降低,且EC2和EC4组(2.0和4.0 g·L-1甜叶菊绿原酸)作用效果优于ED1组(P<0.05)。

图1 蛋雏鸡精神颓靡、双翅下垂Fig.1 The layers with depressed spirit and drooping wings

图2 病死鸡临床检查Fig.2 Clinical examination of sick layers
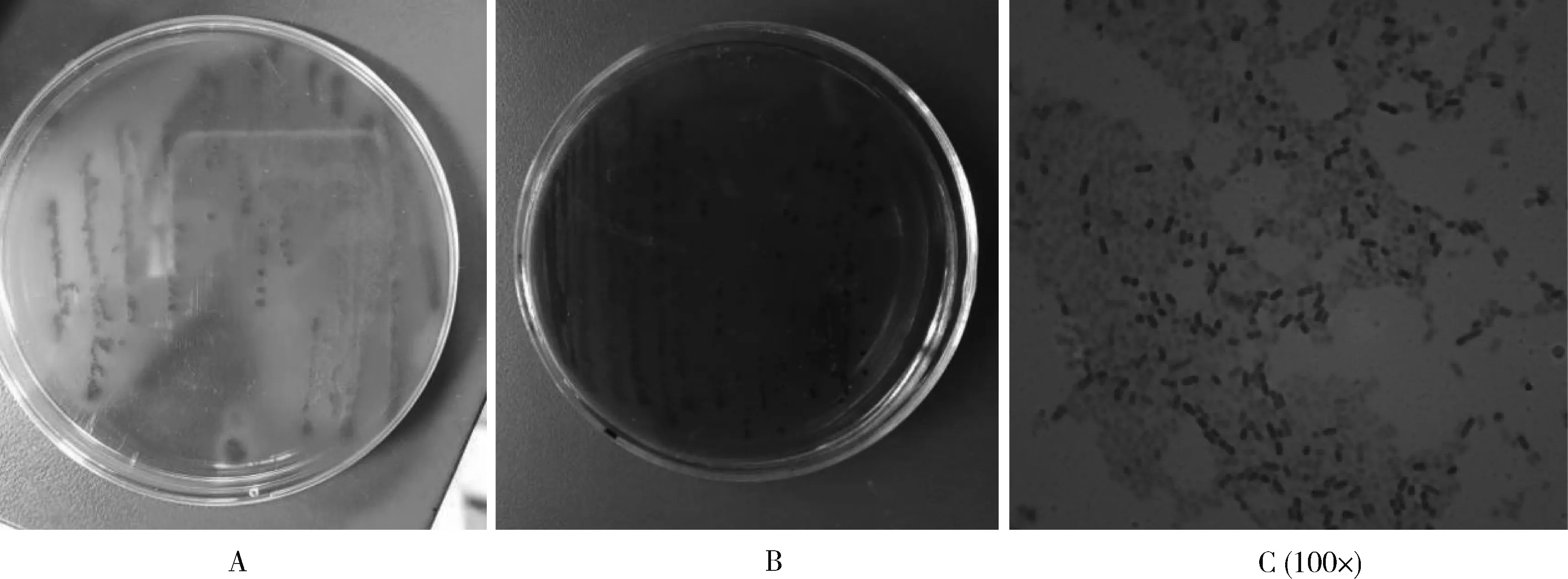
图3 病死鸡实验室检查Fig.3 Laboratory examination of sick layers

所标字母相异表示差异显著(P<0.05),所标字母相同表示差异不显著(P>0.05)。下同Different letters mean significant difference among treatments(P<0.05), same letter means no significant difference among treatments(P>0.05). The same as below图4 甜叶菊绿原酸对腹气囊感染大肠杆菌蛋雏鸡的保护率Fig.4 The protective effect of stevia chlorogenic acid on layers with abdominal air sac infection of E.coli
2.2 甜叶菊绿原酸对腹气囊感染大肠杆菌蛋雏鸡血清免疫指标的影响
与C组相比,腹气囊感染大肠杆菌O78蛋雏鸡血清IgA和IgM含量显著降低(P<0.05),蛋雏鸡血清炎性因子IL-1β、IL-2、IL-6、TNF-α含量显著升高(P<0.05)。与EC0和ED1组相比,甜叶菊绿原酸添加组血清IgA和IgM含量有升高趋势,其中EC4组蛋雏鸡血清IgA和IgM含量显著升高(P<0.05)。与EC0组相比,应用杜仲素和甜叶菊绿原酸后,蛋雏鸡血清炎性因子含量不同程度降低,其中ED1、EC1、EC2和EC4组血清TNF-α含量显著降低(P<0.05);与ED1相比,EC1组血清炎性因子含量无显著性变化(P>0.05),但EC2和EC4组血清IL-1β、IL-2、IL-6、TNF-α含量有所升高(图5)。

图5 甜叶菊绿原酸对腹气囊感染大肠杆菌蛋雏鸡血清免疫指标影响结果Fig.5 Effect of stevia chlorogenic acid on serum immune indexes of layers infected with E.coli by abdominal air sac
2.3 甜叶菊绿原酸对腹气囊感染大肠杆菌蛋雏鸡回肠、空肠免疫相关基因表达的影响
与C组相比,腹气囊感染大肠杆菌O78显著增加蛋雏鸡回肠炎性因子IL-1β、IL-2、TNF-α基因表达(P<0.05),增加空肠炎性因子TNF-α基因表达(P>0.05)。与EC0组相比,ED1和甜叶菊绿原酸处理组(EC1、EC2、EC4)蛋雏鸡回肠炎性因子IL-1β、TNF-α基因表达显著降低(P<0.05),ED1和EC2组蛋雏鸡回肠炎性因子IL-2基因表达显著降低(P<0.05); 而空肠炎性因子基因表达均无显著性差异(P>0.05);与ED1组相比,绿原酸添加组无显著差异,但EC2组蛋雏鸡回肠炎性因子IL-1β、TNF-α基因表达降低(P>0.05),但甜叶菊绿原酸处理组(EC1、EC2、EC4)各组之间无显著性差异(P>0.05); 而空肠炎性因子基因表达均无显著性差异(P>0.05,图6、图7)。
2.4 甜叶菊绿原酸对腹气囊感染大肠杆菌蛋雏鸡回肠、空肠紧密连接蛋白相关基因表达的影响
与C组相比,腹气囊感染大肠杆菌O78增加蛋雏鸡回肠紧密连接蛋白Claudin-1(P<0.05)和ZO-1的基因表达(P>0.05),而ED1和甜叶菊绿原酸处理组(EC1、EC2、EC4)可抑制大肠杆菌O78感染引起的蛋雏鸡回肠紧密连接蛋白基因表达。与C组相比,腹气囊感染大肠杆菌O78显著降低空肠紧密连接蛋白Claudin-1和ZO-1的基因表达(P<0.05),而ED1和甜叶菊绿原酸处理组(EC1、EC2、EC4)可增加大肠杆菌O78感染蛋雏鸡空肠紧密连接蛋白Claudin-1和ZO-1的基因表达(P>0.05),但各组之间差异不显著(P>0.05,图8、图9)。
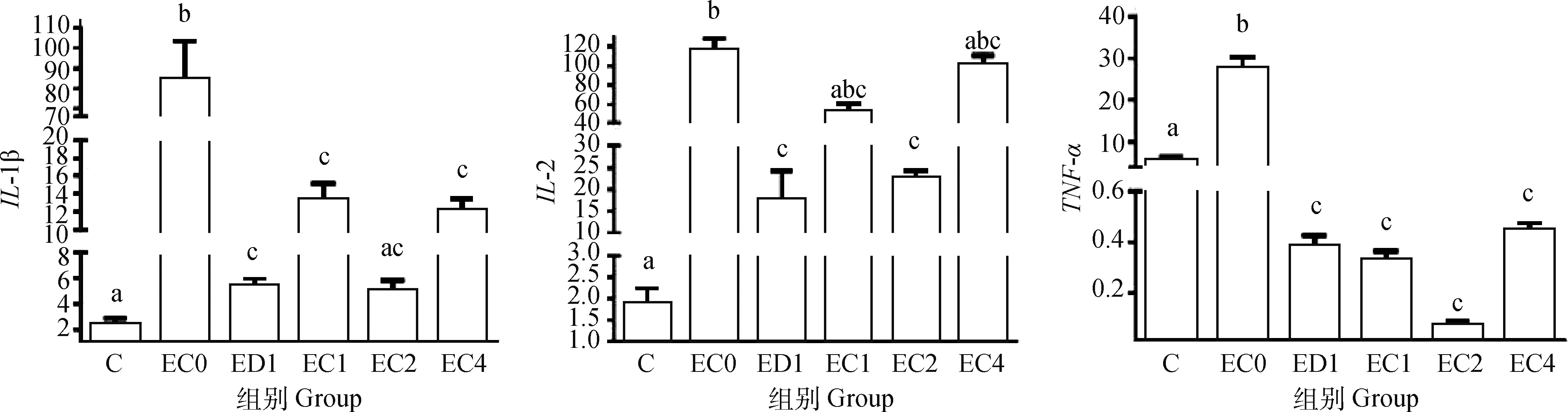
图6 甜叶菊绿原酸对腹气囊感染大肠杆菌蛋雏鸡回肠免疫相关基因表达的影响Fig.6 Effect of stevia chlorogenic acid on ileum immune-related gene expression of layers infected with E.coli by abdominal air sac
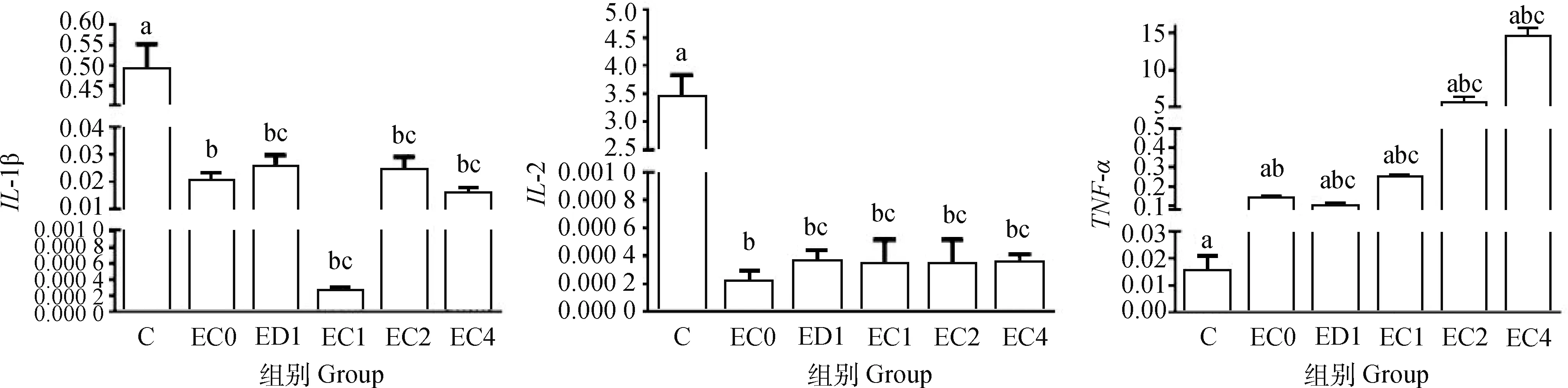
图7 甜叶菊绿原酸对腹气囊感染蛋雏鸡空肠免疫相关基因表达的影响Fig.7 Effect of stevia chlorogenic acid on jejunum immune-related gene expression of layers infected with E.coli by abdominal air sac
2.5 甜叶菊绿原酸对腹气囊感染大肠杆菌蛋雏鸡盲肠食糜微生物菌群的影响
2.5.1 肠道菌群丰度及多样性分析 经高通量测序结果分析,24个样品测序通过剪切过滤,平均每样品测得79 978条序列,经质控平均得到75 403条有效数据,质控有效率达94.36%。对各组样品OTU数量及多样性指数Shannon进行统计分析,结果见表4,EC2组OTU、Chao1显著高于C组(P<0.05),EC2组OTU、Shannon均高于EC0组,但OTU、Shannon、Chao1均低于ED1组(P>0.05)。PCA分析发现,各组微生物群落结构组内和组间变异较大,可看出大肠杆菌O78感染组与对照组之间有明显不同(图10)。由图11可知,大肠杆菌O78感染会导致鸡特有OTUs增加,大肠杆菌O78可能会影响盲肠微生物菌群组成。
2.5.2 门分类水平上试验蛋雏鸡肠道菌群分类学分析 结果如图12所示,正常蛋雏鸡盲肠微生物群落主要以厚壁菌门(Firmicutes)、拟杆菌门(Bacterooidetes)及变形菌门(Proteobacteria)为主,这3种微生物含量占到99%以上。与C组相比,腹气囊感染大肠杆菌O78(EC0组)增加了蛋雏鸡拟杆菌门、变形菌门和梭杆菌门(Fusobacteria)的相对丰度,降低了蛋雏鸡厚壁菌门的相对丰度。与EC0组相比,ED1组可提高大肠杆菌感染蛋雏鸡盲肠厚壁菌门的相对丰度,降低大肠杆菌感染蛋雏鸡盲肠变形菌门和梭杆菌门的相对丰度;EC2组可提高大肠杆菌感染蛋雏鸡盲肠厚壁菌门的相对丰度,降低大肠杆菌感染蛋雏鸡盲肠拟杆菌门、变形菌门和梭杆菌门的相对丰度,作用效果优于ED1组。
3 讨 论
3.1 甜叶菊绿原酸对腹气囊感染大肠杆菌蛋雏鸡的保护
大肠杆菌感染会导致蛋雏鸡大量死亡,不仅给家禽养殖业生产带来严重经济损失,并且还会威胁到人类食品安全[2]。当机体免疫力降低时,鸡大肠杆菌病还会继发于其他疾病引起极高死亡率。有研究报道,表没食子儿茶素没食子酸酯(多酚类提取物)可抑制大肠杆菌O157:H7[22];客家黄酒多酚(含有绿原酸)通过破坏细胞壁的完整性可抑制大肠杆菌的生长[23]。石榴和七叶树中的多酚提取物具有抗炎作用,能提高大肠杆菌感染鸡的存活率[24];黄酮(多酚类提取物)能够抑制大肠杆菌引起的炎症反应,并降低肉鸡死亡率[25]。本试验结果与当前研究报道一致,甜叶菊绿原酸(多酚类提取物)能够抑制大肠杆菌引起的炎症反应,可有效降低大肠杆菌O78感染蛋雏鸡的死亡率。

图8 甜叶菊绿原酸对腹气囊感染蛋雏鸡回肠紧密连接蛋白相关基因表达的影响Fig.8 Effect of stevia chlorogenic acid on expression of tight junction protein-related genes in ileum of layers infected with E.coli by abdominal air sac
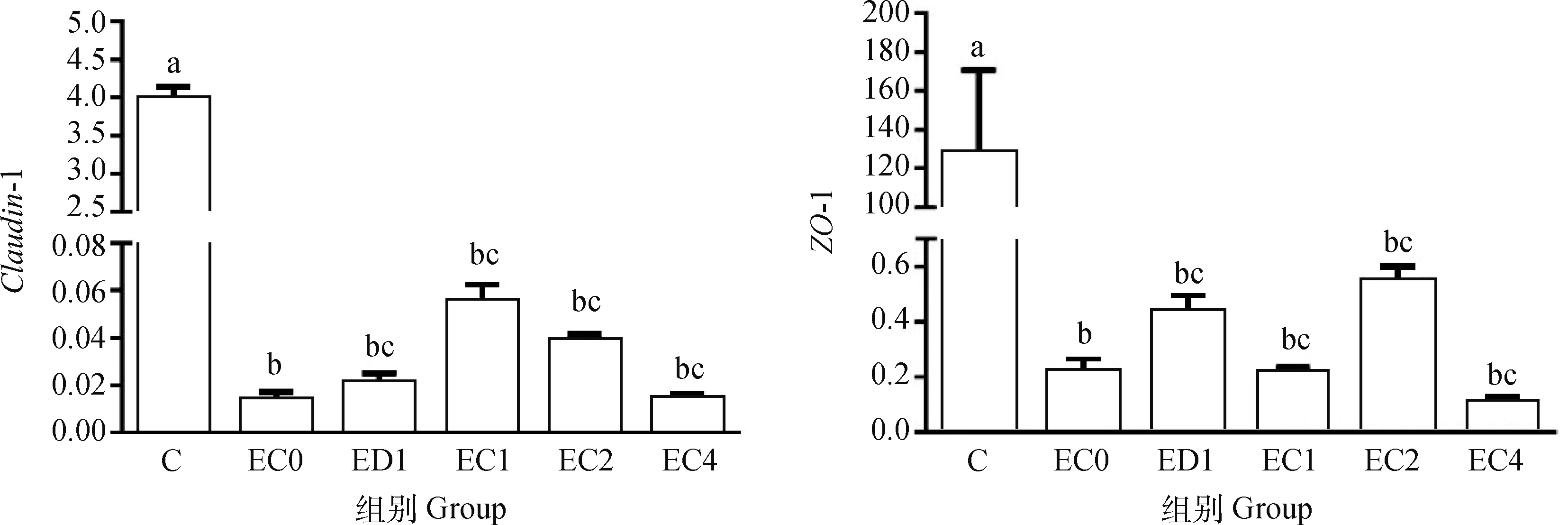
图9 甜叶菊绿原酸对腹气囊感染蛋雏鸡空肠紧密连接蛋白相关基因表达的影响Fig.9 Effect of stevia chlorogenic acid on expression of tight junction protein-related genes in jejunum of layers infected with E.coli by abdominal air sac

表4 各组样品的OTU数量及多样性分析的统计分析结果
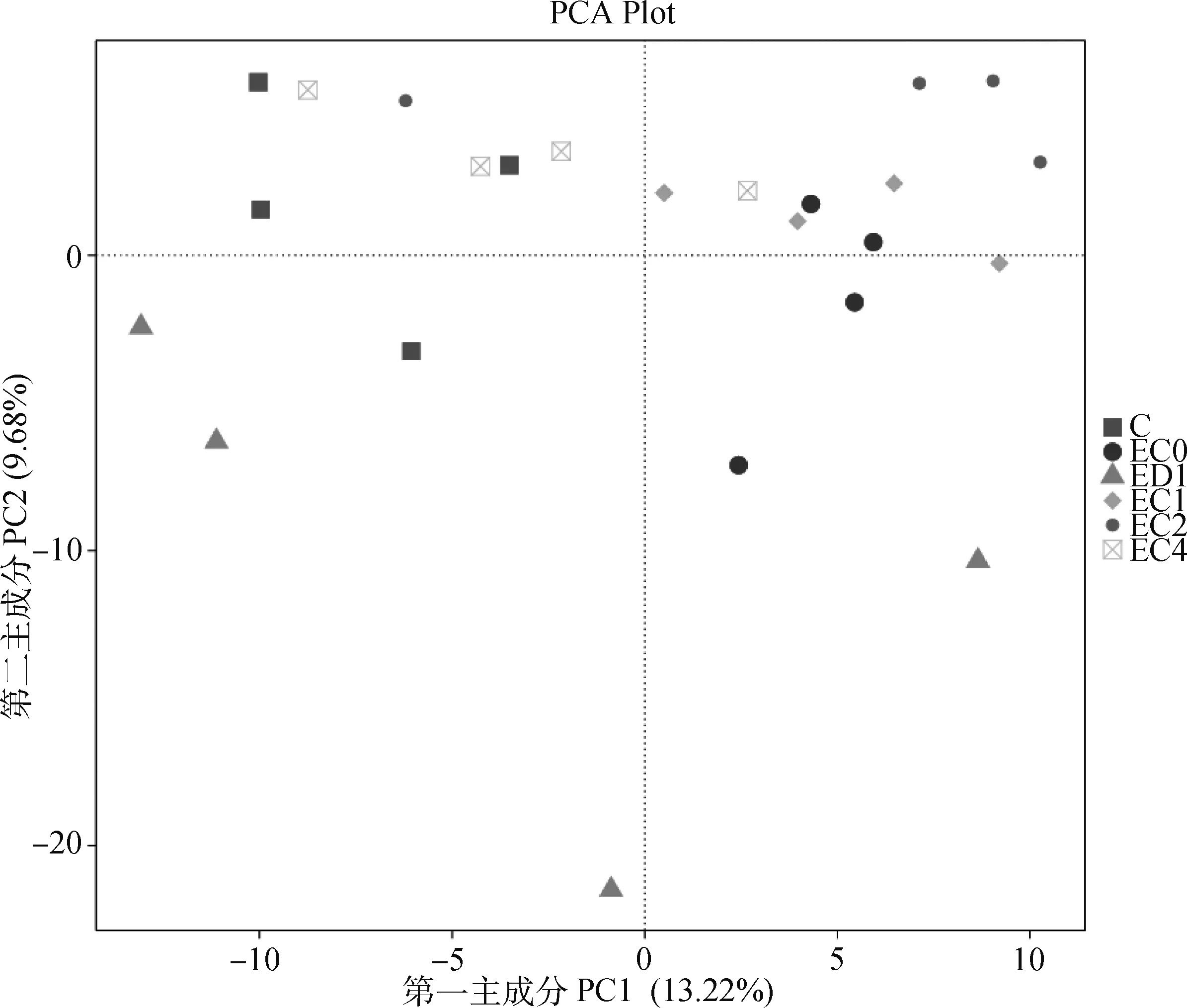
横纵坐标百分比则表示主成分对样本差异的贡献值;图中的每个点表示一个样本,同一个组的样本使用同一种图形表示The percentage of the abscissa and ordinate indicates the contribution of the principal component to the sample difference; each point in the graph represents a sample, and the samples in the same group are represented by the same graph图10 盲肠微生物相似性分析(n=4)Fig.10 Similarity analysis of cecum microbial community(n=4)

花瓣图中每个花瓣代表一个组的样本,中间的core数字代表的是所有样本共有OTUs数目,花瓣上的数字代表该样本组特有OTUs数目Each petal in the petal map represents a sample of a group, the core number in the middle represents the number of OTUs shared by all samples, and the number on the petal represents the number of unique OTUs in the sample group图11 各组样品的OTUs分布花瓣图(n=4)Fig.11 Petal map of OTUs of samples in each group(n=4)
3.2 甜叶菊绿原酸对腹气囊感染大肠杆菌蛋雏鸡免疫功能的影响
大肠杆菌感染导致动物机体免疫力急剧下降,抗病能力下降,而动物机体在生长发育过程中主要由免疫器官、免疫细胞及免疫分子来抵御病原微生物侵害[26]。研究报道称,大肠杆菌侵袭上皮细胞屏障后导致促炎因子和趋化因子产生,诱导法氏囊、胸腺、脾及盲肠扁桃体淋巴细胞耗损,抑制机体细胞免疫和体液免疫,从而致使鸡死亡[1]。有文献报道,APEC感染会激活TLR2、TLR4信号通路,提高细胞因子IL-1β表达[27],而杜仲提取物可降低血清IL-1β、IL-6和TNF-α含量,提高血清IgG含量,刺激空肠分泌IgA[11],显著提高肉兔血清总蛋白、白蛋白和球蛋白含量,可不同程度提高血清IgA含量;绿原酸可降低LPS诱导的TNF-α、IL-1β等促炎因子的表达[28]。本试验结果与当前报道一致,杜仲素和甜叶菊绿原酸均可通过提高大肠杆菌感染蛋雏鸡血清免疫球蛋白水平,降低血清炎性因子水平,抑制肠道促炎细胞因子基因表达,从而增强细胞免疫及体液免疫,诱导巨噬细胞和淋巴细胞到受感染组织并消除病原体,调节炎症反应。另外,本试验发现,甜叶菊绿原酸对血清炎性因子的调节效果略差于杜仲素,但对肠道炎性因子表达调节效果优于杜仲素,这可能与杜仲素除绿原酸外还含有黄酮、杜仲多糖等其他药理成分发挥作用有关,有研究表明,杜仲黄酮可增强小鼠非特异性免疫功能,修复免疫器官损害,提高铅中毒小鼠组织抗氧化酶活性;杜仲多糖可提高小鼠免疫器官指数,增加血清抗体含量和巨噬细胞吞噬能力。因此,甜叶菊绿原酸可能通过增加血清抗体含量、抑制血清和肠道炎性细胞因子表达,从而增强蛋雏鸡机体免疫力,有效改善腹气囊感染大肠杆菌O78对蛋雏鸡的侵袭。
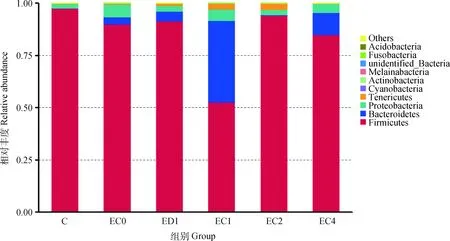
图12 门水平上的物种相对丰度柱形图(n=4)Fig.12 The relative abundance of main taxa in the cecum at phylum level (n=4)
3.3 甜叶菊绿原酸对腹气囊感染大肠杆菌蛋雏鸡肠道屏障功能的影响
肠道黏膜及结构的完整性决定着肠道的正常吸收功能以及机体的正常免疫功能。机体健康状态下,大分子化合物不能通过完整肠道屏障进入血液,当肠道紧密连接结构受损时,肠道上皮结构完整性被破坏,大分子化合物就会通过细胞间隙进入血液。有研究报道,APEC黏附定植于上皮细胞,影响肠上皮离子转运,并通过分泌毒素诱导肠道水肿,从而导致肠道上皮屏障功能受损[29]。紧密连接蛋白对机体抵御病原菌入侵,发挥屏障功能十分重要。本研究显示,甜叶菊绿原酸可通过增加空肠黏膜上皮紧密连接蛋白表达,降低蛋雏鸡肠道通透性,从而修复肠道结构损伤,调节肠道组织炎症反应,改善肠道屏障功能,这与目前报道一致[19,30]。
动物肠道微生态系统十分复杂,栖居着大量微生物,国内外大量研究表明,盲肠是畜禽肠道内微生物种类和含量最多的部位,肠道环境相对封闭,仅有部分微生物可在实验室条件下进行分离培养,因此,本试验采用高通量测序技术[31]比较并分析甜叶菊绿原酸对大肠杆菌O78感染蛋雏鸡盲肠食糜微生物菌群的变化情况。李立佳[32]研究指出,鸡肠道中主要优势菌是厚壁菌门,其次为拟杆菌门和变形菌门,本试验结果与其一致,蛋雏鸡盲肠微生物群落主要以厚壁菌门、拟杆菌门及变形菌门为主,且这3种微生物含量占99%以上。肠道细菌群落中优势菌群起主导作用,机体早期肠道优势菌群的变化会影响肠道细菌与肠黏膜宿主细胞之间的相互作用。研究报道称,早期使用益生菌和抗生素等进行饮食干预会影响肠道菌群与宿主黏膜细胞之间的相互作用,从而引起免疫功能改变。益生菌和草药可改善肉鸡肠道健康,控制有害细菌生长,其中多酚类物质有利于维持肠道微生物菌群稳定,抑制病原菌定植和促进益生菌繁殖[33]。有研究报道,杜仲提取物可提高小鼠厚壁杆菌门和变形菌门相对丰度,降低拟杆菌门相对丰度;绿原酸可显著抑制大肠杆菌和金黄色葡萄球菌活性,显著提高仔猪结肠乳杆菌数量并降低大肠杆菌数量,增加结肠微生物区系多样性,保护肠道微生态平衡[34]。本研究结果与目前报道一致,腹气囊感染大肠杆菌O78会增加蛋雏鸡拟杆菌门、变形菌门和无壁菌门的相对丰度,降低蛋雏鸡厚壁菌门的相对丰度,引起机体发生免疫反应,而1 g·L-1杜仲素和2 g·L-1甜叶菊绿原酸可提高大肠杆菌O78感染蛋雏鸡盲肠厚壁菌门的相对丰度,降低大肠杆菌O78感染蛋雏鸡盲肠拟杆菌门和变形菌门的相对丰度,且甜叶菊绿原酸作用效果要优于杜仲素。
大量研究证实,肠道变形菌门能反映肠道微生物菌落结构不稳定,预示肠道稳态失调,健康动物肠道含部分变形菌的共生细菌,当这些细菌数量较少时,表现为良性,但在某种肠道环境下,它们则会发展成为引发炎症的肠道微生物。本试验发现,大肠杆菌感染雏鸡的盲肠变形菌门相对丰度有所增加,预示此时肠道微生态失调。而诸多研究表明,中药会影响肠道细菌与肠黏膜宿主细胞之间的相互作用,显著改善肠道菌群的数量和结构,并通过增加有益菌数量、降低有害菌数量来预防和治疗疾病。甜叶菊绿原酸确实会影响肠道菌群稳定,增加有益菌数量、降低有害菌数量,有效改善感染带来的损伤。但甜叶菊绿原酸抵御大肠杆菌感染侵袭的具体作用机制并不清晰。有文献报道称,肠道细菌可将宿主营养成分代谢成多种产物,如短链脂肪酸、吲哚。肠道菌代谢产物又调控各种生理病理反应,在维持机体健康中起着重要作用,如短链脂肪酸可维持肠道和免疫稳态;吲哚-3-丙酸可改善肠道炎症反应。作为鸡肠道的主要优势菌,厚壁菌门中的柔嫩梭菌类和球状梭菌类是宿主肠道丁酸盐产生菌的主要来源,而丁酸盐产生菌对肠上皮细胞的发育具有重要作用。拟杆菌门作为肠道革兰阴性菌中数量最大的一类细菌,产降解植物细胞壁的酶参与植物细胞壁降解,影响肠道消化吸收功能;还与机体免疫机能密切相关,肠道拟杆菌的增加会导致机体发生自身免疫性疾病。本试验结果也显示,甜叶菊绿原酸可提高大肠杆菌O78感染蛋雏鸡盲肠厚壁菌门的相对丰度,降低盲肠拟杆菌门的相对丰度。因此推测,甜叶菊绿原酸主要通过调节肠道菌群稳态,抑制病原菌定植,促进益生菌增殖,从而影响肠道菌对宿主营养物质的代谢,影响肠道黏膜及结构的完整性、肠道微生物菌群的正常状态,来抵御腹气囊感染大肠杆菌O78对蛋雏鸡的侵袭。
4 结 论
腹气囊感染大肠杆菌O78后,蛋雏鸡肠道紧密连接功能受损,盲肠微生物菌群发生变化,导致蛋雏鸡免疫功能紊乱、机体免疫力下降;而甜叶菊绿原酸可通过抑制肠道促炎细胞因子基因表达,激活宿主细胞免疫及体液免疫,并通过增加肠道紧密连接蛋白基因表达和优化肠道食糜微生物菌群,从而抑制肠道组织炎症反应,改善肠道屏障功能,增强蛋雏鸡机体免疫力,阻止大肠杆菌O78对蛋雏鸡的侵袭,其中,应用剂量为2 g·L-1的甜叶菊绿原酸效果较好。提示,甜叶菊绿原酸增强大肠杆菌感染蛋雏鸡机体免疫力的积极作用可能是通过调控免疫相关基因,维持盲肠微生物菌群稳态达到的,而其抵御大肠杆菌感染的分子调控机制尚不清楚,仍需更进一步研究。

