绵羊羊角形态与遗传调控机制的研究进展
周李生,颜 硕,张 圆,贺建宁,潘庆杰*,董焕声*
(1.青岛农业大学动物科技学院,青岛 266109; 2. 济宁市畜牧业发展中心,济宁 272037)
我国是绵羊养殖大国,据联合国统计司(https://unstats.un.org/home/)公布的数据显示,近5年来,我国绵羊存栏量约占世界绵羊总存栏量的13.5%,远超美国(6.81%)和澳大利亚(5.79%),稳居世界第一位。同时,我国也是绵羊品种资源最丰富的国家:根据《中国养羊学》[1]记载,目前,我国拥有地方绵羊品种、培育绵羊品种和引入绵羊品种共计98种,是开展绵羊新品种培育的宝贵遗传资源。绵羊的种类除了根据其生长地区、体型大小、毛色和尾部形态来区分以外,还有一个重要的标识——角。甲骨文中的“羊”字明显带有物种特征,上部为一对倒“V”形羊角,下部为箭头状羊嘴。从字的创造和演变过程中可以看出,角作为其典型性状,一直倍受关注。
在野外或放养环境中,角对绵羊的种族延续具有重要意义。首先,角作为进攻性武器,有利于群体中的雄性个体通过争斗提高自己在种群内的地位并获取优先交配权;其次,羊角作为防御性工具,可有效提高绵羊群体在应对复杂环境下的生存能力,降低捕食者的威胁。在物种的进化过程中,过大的角和无角都不是最佳选择,因为生殖力和生存力之间存在动态平衡[2-3]。自然存活率与早期角生长的相关性微弱,狩猎死亡率与大角公羊的自然死亡率差异显著,从而导致角生长与生存率之间呈人为负相关关系[4-5]。
然而,随着畜牧业发展,绵羊养殖趋向规模化与集约化模式,在无防御天敌和争夺交配权的需求下,绵羊个体(特别是公羊)保留粗壮的角不仅会浪费能量、增加饲养成本,而且存在较高的打斗风险[6]。目前,普遍的管理做法是将有角绵羊羊角锯除,但这往往会对个体造成生理损伤,影响生产性能。只有通过遗传育种手段,将有角绵羊品种培育成无角绵羊品种,才能从根本上解决这一问题。
因此,研究绵羊羊角的形成及生长发育规律,在生产实践中具有重要的意义。本文通过总结我国现存绵羊羊角在不同品种中的形态特征,概述了羊角发育(或抑制)的遗传基础及调控机制,可为羊角性状的生长发育深入研究提供方向,同时还为我国绵羊新品种培育奠定理论基础。
1 羊角的形态特征
中国是世界上为数不多的羊遗传资源丰富的国家之一,经过不断地繁衍与进化,历史遗存下来的大量绵羊品种成为我们巨大的基因宝藏。因人类需求不同,我国绵羊在生产性能、繁殖力、耐受力和外表形态等细分方向各有优劣。在角的形态方面,不同品种在数量和外形上各具特色。
1.1 无角绵羊品种
据《羊志》[7]记载,我国现有无角绵羊品种24个,分别为地方品种6个,杂交培育品种6个,引进品种12个(表1)。常见无角绵羊品种有湖羊、杜泊羊、内蒙古半细毛羊、洼地绵羊和苏尼特羊等。绵羊的无角性状形成的原因较为复杂。自然选择因素使与环境相适应的遗传和变异被保留,国内无角绵羊品种多为培育品种和引入品种,地方品种呈零散分布,说明只有少数自然环境能进化出无角表型。苏尼特羊产区多为荒漠草原或半荒漠草原,生态环境较差,资源匮乏;湖羊产区地处江南,雨水充足,植物生长旺盛。对比两羊产区区别或可以小见大,进化出无角绵羊品种原因有两个:1)能量获取困难,进化过程中为节约能量,逐渐淘汰有角个体;2)产区食物充足、天敌较少,无需防御性工具,进化过程中无角个体得以生存并繁衍。
人工选择因素在新品种形成过程中的作用后来者居上,我国的培育品种和引入品种专门向细毛、多肉、无角方向选育或其父、母代本就为无角品种。因此,在培育品种和引入品种中,人为因素是无角性状产生的主要原因。自然进化既能产生无角品种,又能产生多角品种,但因人类育种工作的开展,无角绵羊新品种的产生速度明显提高。
上述无角绵羊品种广泛分布于我国北部、西北部、西南部等地区,并适应当地独有的气候环境。它们具有统一、稳定的无角性状,且在耐干旱、耐寒冷和耐高海拔等方面表现出较强优势,为现代化舍饲或大规模放牧提供便利,更成为各地培育无角绵羊新品种丰富而宝贵的遗传资源。
1.2 两角绵羊品种
我国两角绵羊品种数目众多,不同品种之间角的形态差异显著,总体可从4个方面加以区分:角的大小、角的生长方向、卷曲程度和角末端形状(表2)。草地型藏羊的两角从角基发出后,向两侧(左右)伸展螺旋生长,角尖处变细,呈扁平柳叶状(图1A)。欧拉羊的两角发出后先向下螺旋,后向两侧伸展生长,角尖扁平,角基粗壮(图1B)。多数的有角绵羊品种拥有大且粗壮的螺旋形角:双角根部紧贴脸部,角尖偏向两侧生长,代表品种有威宁绵羊、迪庆绵羊、昭通绵羊、岷县黑裘皮羊和新疆细毛羊等(图1C);双角全部紧贴脸部,角尖向前或向后生长,代表品种有广灵大尾羊、晋中绵羊、呼伦贝尔羊、和田羊和宁蒗黑绵羊等(图1D)。卷曲程度分为螺旋形、弯曲形或香蕉形和倒八字形;角尖多为圆锥状,其次为扁平柳叶状。综合来看,成年雄性个体羊角外观较为统一,而雌性个体羊角情况多样,两角、小角、有角基、无角等表型都可能出现。代表性两角绵羊品种的角部形态特征及其正面图,见表2和图1。

表1 无角绵羊品种及其原产地分布
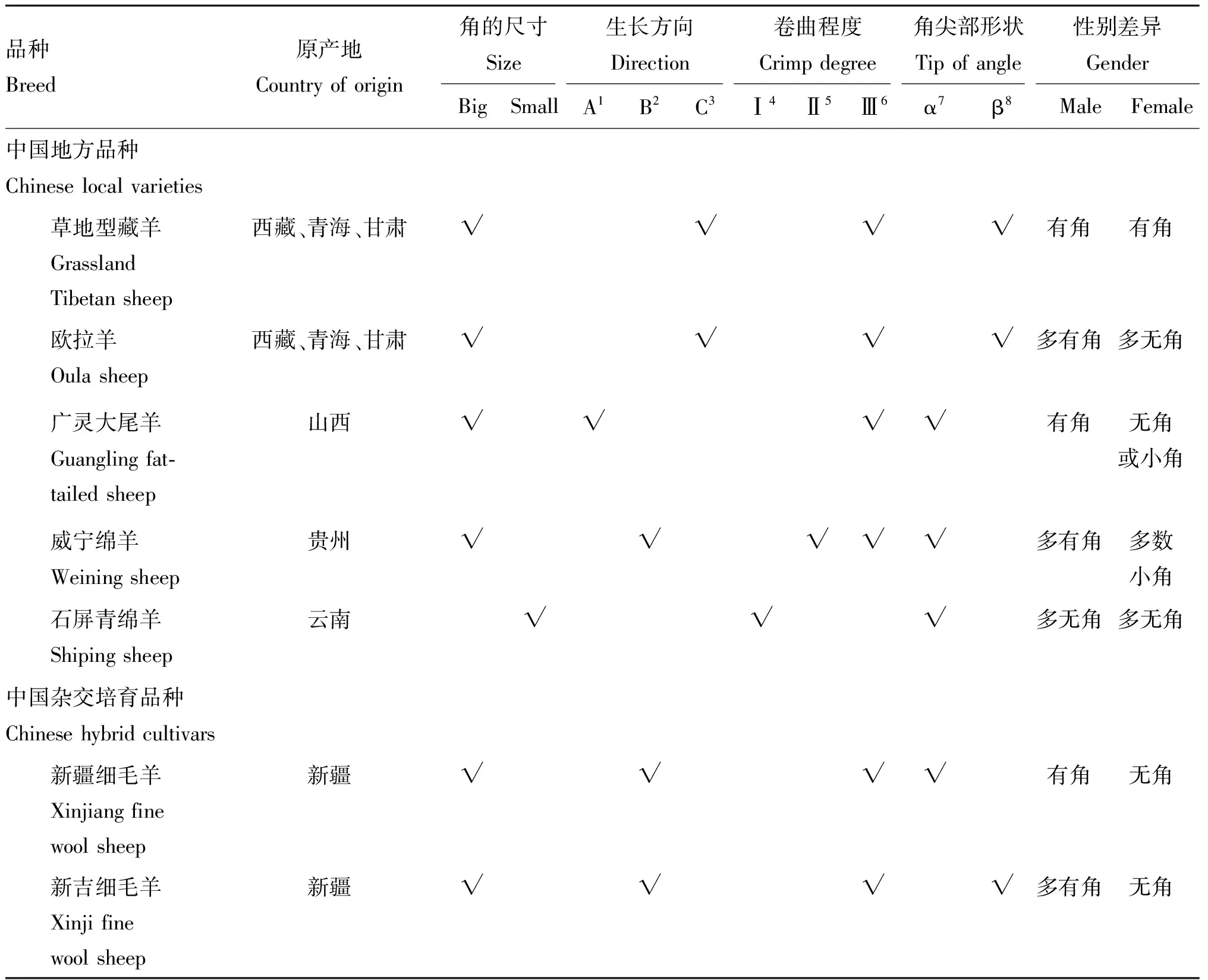
表2 代表性两角绵羊品种及其角的形态特征
1.3 多角绵羊品种
现存多角绵羊品种(部分个体羊角数量大于等于3)数量较少,有雅各布绵羊、马恩岛绵羊、冰岛绵羊、赫布里底绵羊、泗水裘皮羊、蒙古羊、阿勒泰羊、达玛拉羊和纳瓦霍-丘罗羊等,主要分布于欧洲、亚洲、非洲和北美洲[8-9]。多角绵羊种群内的不同个体之间角的形态与数目并不完全统一。以泗水裘皮羊为例,种群中零、二、三、四、五、六角绵羊个体均可能出现,且角的生长、弯曲方向存在个体表型分离现象,本文对多角绵羊品种的主要角型进行了梳理。泗水裘皮羊的顶部两角与正中矢状面呈30°~45°发出,并向左右两侧伸展生长;下部两角基本平行于眼眶发出,贴近脸部并向下向前生长(图1F)。蒙古羊的顶部两角粗壮,向上发出并向后弯曲生长;下部两角贴近脸部,向下向前生长(图1G)。马恩岛绵羊的顶部两角粗壮,向上发出并向前弯曲生长;下部两角贴近脸部,向下向前生长,末端变尖呈叶状(图1H)。赫布里底绵羊的顶部两角粗壮,似胡萝卜状,与正中矢状面呈30°~45°发出后,直立生长;下部两角左右发出,贴近脸部并向下向前生长(图1I)。多角绵羊品种中的五角个体多见于顶部其中一侧角基同时发出两角;三角个体多见于下部两角其中一侧缺失;两角个体与两角绵羊品种的角形相似。四角绵羊的典型角形如表3和图1 所示,非典型角形本文未列出。

表3 代表性四角绵羊品种及其角的形态特征
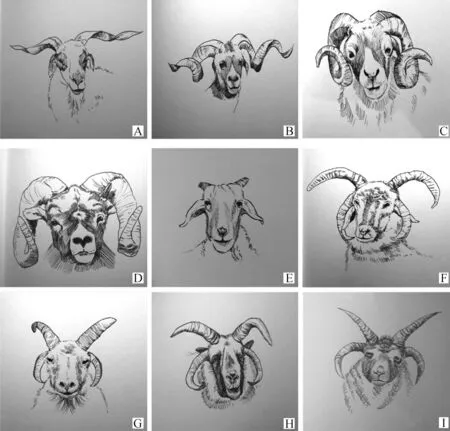
A.草地型藏羊;B.欧拉羊;C.威宁绵羊;D.广灵大尾羊;E.小尾寒羊(母);F.泗水裘皮羊;G.蒙古羊;H.马恩岛绵羊;I.赫布里底绵羊A. Grassland Tibetan sheep; B. Euler sheep; C. Weining sheep; D. Guangling Big Tail sheep; E. Small Tail Han sheep (female); F. Sishui Fur sheep; G. Mongolian sheep; H. Manx Loaghtan sheep; I. Hebridean sheep图1 代表性绵羊品种角的形态特征Fig.1 Morphological characteristics of horn in representative sheep breeds
2 绵羊羊角发育机制研究
绵羊羊角的生长发育涉及到大量基因和通路的调控,是个复杂的过程,目前,尚未有较为系统的研究报道。牛、羊、鹿同属反刍动物类别,其角的发育过程具有一定的相似性,特别是对鹿角的研究较为充分。鹿茸的生长是软骨内成骨的过程,中心位于头骨顶端的角柄,随着鹿茸的不断骨化和茸皮脱落而形成鹿角[10],具有强大增殖能力的间充质细胞为鹿茸快速生长提供保障[11-12]。生茸区骨膜(AP)细胞具有胚胎干细胞的部分特征:表达关键的胚胎干细胞标志物Oct4、Sox2、Nanog、CD9、端粒酶和核蛋白等[13-15]。鹿茸干细胞(ASCs)释放信号因子,通过纤维层扩散到结缔组织[16-17]等区域,最终到达并作用于真皮乳头细胞(DPCs)[18]。收到信号刺激的真皮乳头细胞既可以通过旁分泌等机制使表皮向鹿茸转变,又可以反馈调节于鹿茸干细胞,刺激其增殖和分化[19]。绵羊羊角生长发育时,是否有与间充质细胞[20]、鹿茸干细胞[21-22]、生茸区骨膜细胞[23-24]功能相似的细胞存在,其机制又是如何?值得进一步类比研究。
目前发现的相关基因与通路较多,Hughes等[25]证明,Otop1过表达后,通过嘌呤能受体对Ca2+浓度进行调节,Otop1指导生物矿化过程,Olig1/2为少突角质细胞转录因子1/2,与神经元和神经胶质生理活动有关[26]。草地型藏羊的RXFP2基因在软骨和角骨膜中表现出组织特异性表达的模式[27]。对比反刍动物角中的6个特异性表达基因(SOX10[28-29]、SNAI1[30]、SNAI2[31]、TFAP2A[32]、NGFR[33]、COL11A2[34])发现,SOX10、SNAI1和TFAP2A基因在胎儿时期的绵羊羊角中高度表达[35]。因此,OTOP3、OLIG1、RXFP2、B3GLCT、SOX10、SNAI1、TFAP2A等基因通过影响神经嵴细胞[36-38]的分化迁移从而调控绵羊羊角生长的生理过程。神经嵴细胞在形成颅颌面骨骼过程中的信号分子调控包括内皮素-1信号、FGF信号、Shh信号、TGF-β信号、Wnt信号等[39-42]。这些信号通路可能与绵羊羊角的生理发育有关。
3 绵羊羊角遗传机制研究
3.1 绵羊羊角产生的遗传机制
绵羊角的产生和发育受常染色体位点的控制[43-44]。Coltman和Pemberton[45]较早确立了可能与羊角形成有关的3个等位基因的遗传模型:H+代表有角,HL代表性别决定成角,HP代表无角。Beraldi等[46]提出,影响羊角产生机制基因位于10号染色体或AGLA226附近,但无法确定准确的图谱位置。为了确定羊角产生的准确的分子调控位点,Wiedemar和Drögemüller[47]对特克赛尔羊的RXFP2的最后一个外显子和3′-UTR(非编译区)进行基因测序,结果显示, OAR10:29456047 之后的1 833 bp片段(OAR10:29456047- OAR10:29457880)在有角羊中缺失。Kijas等[48]对主要来自非洲、亚洲和欧洲的74种绵羊的2 819个个体进行基因分型,获得49 034个SNPs,数据揭示了在10号染色体上检测到最高的选择信号,其最高等级的SNP(OAR10-29511510;FST= 0.682)位于29.54 Mb并在RXFP2附近,这可能与羊角的发育有关。Johnston等[49]对野生索厄羊进行全基因组关联研究,认为RXFP2基因是正常有角公羊中角大小的加性定量性状基因座,占该性状中遗传性遗传变异的76%。DNA片段插入无角羊10号染色体相应位置,抑制角性状的表达。Duijvesteijn等[50]在美利奴羊上发现,有角/无角的重要SNP位于ORA10-29546872.1和OAR10-29458450处,于10号染色体2.78 Mb附近有一1.78 kb基因片段的插入,基因关系矩阵中,雄性和雌性的准确度分别为0.620和0.713。因此,10号染色体中插入一片段大小约为1.78 kb的核苷酸序列是导致无角羊产生的关键因素。
3.2 绵羊多角性状产生的遗传机制
在全球范围内,只有少数品种绵羊有多角个体的出现,如雅各布绵羊、赫布里底绵羊和泗水裘皮羊等,其中两角和四角个体最为常见。对比24只两角和22只四角泗水裘皮羊发现,2号染色体的132.0~133.1 Mb位置被确认为多聚表型的强候选基因组区域,在该基因组区域内已注释了13个基因(Metaxin2、HOXD、EVX2等)[51]。Kijas等[52]对雅各布绵羊和纳瓦霍-丘罗羊的125个个体(0、2、4、5角均有)进行全基因组关联性分析,在绵羊2号染色体上观察到单个强缔结信号,表明影响多角性状的基因可能源于这里。10个最密切相关的SNPs都位于OAR2中131.9~132.6 Mb区域。与SNP峰值最接近的基因是Metaxin2,位于132.6~132.7 Mb上游约93 kb;其次是HOXD1,位于上游约251 kb。通过对绵羊二号染色体的研究和相关基因的挖掘,发现多角性状的遗传机制比较复杂,它可能受多个基因座的调控[53]。达玛拉羊的研究结果与其他多角羊相似,即ORA2是控制多角性状遗传和表达的关键[6]。
4 激素和环境因素对羊角发育的影响
激素对羊角的发育具有调控作用。野生成年雄性反刍动物表现出明显的睾丸活跃和不活跃的年内循环,包括完全停滞与活跃的精子发生之间的过渡[54]。雄性绵羊较雌性绵羊多大角和多角个体,因此,雄性激素可能是影响此种差异的因素之一:低水平的睾丸激素有利于角的生长,而高水平的睾丸激素则有抑制作用[55]。Santiago-Moreno等[56]通过对西班牙山羊和欧洲摩弗伦羊的追踪检测,发现在两个物种中,角的生长速率与睾丸活性均出现明显的季节性变化:西班牙山羊10月份血浆睾丸激素浓度增加,11月份表现出角的生长停滞;欧洲摩弗仑羊的角生长亦有停滞现象。这些结果支持以下假设:在发情期,外周血浆中睾丸激素水平较高可抑制羊角的生长。在褪黑素[57-58]和催乳素(PRL)[59]方面,高速率的角生长常伴随着高血浆PRL浓度;每日褪黑素振幅的变化,没有发现与角生长速率的相关性[60]。
羊角的生长亦受季节、气候、光照和空气湿度等外部因素影响。Loehr等[61]发现,天气因素可以解释羊角生长中的年度波动现象,羊角对春季敏感的原因可能是牧草的生长受温度和土壤水分的影响。光照强度对羊毛、羊角生长速度的影响是通过调节甲状腺活性进行介导的,个体体内甲状腺激素(T3、T4)浓度的峰值与羊毛和羊角的快速生长期吻合[62-63]。
5 小结与展望
本文通过归纳整理现有资料中无角绵羊、两角绵羊和多角绵羊的羊角形态与原产地等信息,梳理并区分了不同绵羊品种之间羊角类型的差异;而后总结前人对羊角发育机制和遗传机制的研究,理清了目前羊角性状的研究进展,概述了无角、两角和多角性状的发育机制及激素调控手段。目前,问题主要集中在:1)绵羊2号染色体(多角位点)和10号染色体(成角位点)的有关区域内存在较多基因,且具体功能并未逐一验证;2)遗传、激素、气候、季节等因素均能影响羊角的生长,发育网络复杂,基因-信号通路-靶细胞调控体系尚不明确;3)缺乏稳定、高效、可行的羊角发育调控手段和改良手段,且应用于实际生产中的技术较少。
因此,明晰相关基因、通路和调控因子的功能是未来研究羊角发育机制的重要方向,也是培育无角绵羊新品种、改良绵羊生产性能的关键所在。今后应结合多种手段深入研究,利用系统生物学和功能基因组学,更系统深入地探索绵羊多角和无角的形成机制与种质创制,为机制的探究以及技术的开发提供帮助,最终促进我国畜牧养殖业的发展。

