母体放牧经历对羊草克隆后代干旱敏感性的影响
郭丰辉,丁勇,马文静,李贤松,李西良*,侯向阳*
(1.中国农业科学院草原研究所,内蒙古呼和浩特010010;2.山西农业大学草业学院,山西晋中030801;3.内蒙古民族大学,内蒙古 通辽028000)
遗留效应是指环境干扰去除后,其对生态系统各组成要素及要素间关系、系统结构与功能、系统动态特征等的影响仍然可以长期存在的现象[1]。遗留效应不仅是植被群落组成、种间关系、土壤养分水平等生态学过程的重要维持机制,也是生态系统多样性的重要诱导途径之一[2-3]。例如,非洲草原的物种演替、土壤养分动态等过程的驱动途径可以追溯到几十年、甚至上百年前的土地利用历史、火灾等环境干扰因子[4]。环境干扰可以通过自然选择、代际效应、胁迫记忆等过程在植物层面产生遗留效应,Anderegg等[5]研究发现极端干旱事件停止4年后,森林生态系统树木生长依旧缓慢,遗留效应明显。遗留效应也是植物适应环境干扰的主要策略之一,大量研究表明,经历过环境干扰的植物在再次(或后代)经历同一干扰因子时可表现出相对较强的适应性[6]。
在草原生态系统中,放牧干扰可以在植物层面产生遗留效应,表现为株高降低、叶片变短、叶夹角和茎夹角增大等,且在放牧干扰去除的短时间内无法恢复。早在20世纪80年代,就有研究表明放牧样地植物移植到同质园环境中依旧表现出明显的矮化及匍匐型变的遗留效应[7-9]。我国典型草原优势植物羊草(Leymus chinensis),在过度放牧干扰下同样表现出明显的不依赖于土壤环境的遗留效应,即株高变矮、叶片缩短、单株生物量降低等[10-11]。同时,也有研究表明植物本身的矮化及匍匐型变可以提高植物对刈割(模拟放牧啃食)的抗性,增强其适应性[12-13]。
水分是草原生态系统中植物生长的主要限制因子,土壤水分状况很大程度上决定了草原的初级生产力及植被群落组成[14-15]。放牧干扰减少了植物地上现存量及地表枯落物,甚至形成地表空斑,从而增大土壤水分蒸发量,加剧了系统中水分的匮乏[16];放牧干扰也可以通过改变土壤物理性质(增大密度、减小孔隙度等)、减少土壤有机质等降低土壤的保水能力,加剧草原植物的干旱胁迫[17]。有研究表明,土壤水分状况的恶化是放牧干扰下植被生产力降低、群落退化演替的主要诱导途径之一[18]。因此,放牧干扰在植物层面的遗留效应可能部分归结于干旱环境的间接诱导,也极有可能改变了植物对干旱的适应能力。
虽然遗留效应在生态系统中的作用已经引起各领域研究学者的广泛关注,但是基于植物层面放牧遗留效应的研究还相对缺乏。水分是我国北方天然草原重要的环境因子,也是放牧干扰作用于生态系统的重要途径,但是目前尚不清楚放牧遗留效应是否影响了植物对干旱环境的响应。明确放牧遗留效应在植物应对干旱环境中的作用,有助于进一步认识和理解草原在放牧干扰或生态修复下的生态过程。本研究基于植物层面的放牧遗留效应,以我国内蒙古锡林郭勒盟典型草原的长期围封(自1983年开始)和长期过度放牧样地的羊草为研究对象,开展室内水分控制试验,从羊草单株性状、生物量积累及分配等角度探讨放牧遗留效应对羊草响应干旱环境的影响,试图解决以下科学问题:1)放牧遗留效应是否增强了羊草适应干旱环境的能力?2)羊草生物量分配对干旱环境的响应是否受放牧遗留效应的调控?
1 材料与方法
1.1 样地概况
锡林浩特市白音锡勒牧场(43°38′N,116°42′E),温带半干旱气候,年均温度-0.4℃,年均降水250 mm,土壤类型为栗钙土。该区域为典型草原类型,每年4月中旬返青,8月底枯黄,植物群落以羊草、大针茅(Stipa grandis)为建群种,伴生有冰草(Agropyron cristatum)、糙隐子草(Cleistogenes squarrosa)、黄囊苔草(Carex korshinskyi)、星毛委陵菜(Potentilla acaulis)等物种[19]。样地于1983年围封,面积26.67 hm2,围栏外为牧户自由放牧样地,放牧强度为3羊单位·hm-2。根据国家草畜平衡标准,该地区的适宜放牧强度为1.5羊单位·hm-2,因此该地区草原长期处于过度放牧状态,同时呈明显的植物矮小化、沙化、斑块化等退化现象[10]。
1.2 试验设计
2017年春季羊草刚刚返青、且放牧未开始时,从放牧样地[放牧羊草克隆后代(grazing,GZ)]和围封样地[围封羊草克隆后代(no grazing,NG)]分别采集生长状况基本相同的羊草幼苗(各50株)带回温室培养。羊草主要以根茎克隆繁殖为主,实生苗很少,幼苗大部分都是上一年的克隆后代。为保证试验材料的一致性,采集过程中排除掉可能的实生苗(单株生长、无根茎)。室内培养采用直径15 cm、高20 cm花盆进行土培,所用土壤从样地旁采集。首先将所用土壤过筛,去除石头、土块、粗根等杂质,然后风干,充分混匀,装盆,每个花盆2.5 kg。为减小围封和放牧样地羊草根茎、根系及根际土壤养分差异对试验结果可能造成的影响,移栽时将根茎全部修剪掉,同时将根系修剪至大小基本一致并用清水冲洗,然后移栽至花盆,每个花盆移栽1株。移栽的羊草在阴暗条件下缓苗1周后移入温室,光照为自然光照,白天温度25℃左右,夜间温度10℃左右。
移入温室1周后开始干旱处理,此时移栽的羊草幼苗基本恢复生长。两个样地来源的羊草(NG与GZ)各成活40株左右,从成活的幼苗中分别选择长势相同的20盆开展试验,10盆对照(CK),10盆干旱处理(drought treatment,DT)。每天19:00采用称重法浇水,CK每次浇水至含水量为40%,DT浇水至含水量为5%[20]。由于每盆仅有1株羊草,其生物量与浇水量相比很小,因此浇水时忽略植株生物量的影响。每周调整花盆的摆放次序以减小温室环境异质性对试验结果可能造成的影响。
1.3 取样与测定方法
于室内培养2个月左右后取样,此时植物进入成熟期,基本停止生长。1)选择每盆最高子株测量其垂直高度,然后将该子株用剪刀剪下,放入信封袋;2)统计每盆的子株数量,用剪刀剪下地上部分放入信封袋;3)打破花盆,将土壤及植物地下部分放入0.04 mm尼龙网袋,并用清水冲洗干净,然后对羊草的地下部分进行根系与根茎的分离,测定每条根茎长度并统计根茎节间数;4)将所有样品,包括单株及总地上部分、根系、根茎,65℃烘干48 h至恒重,称重。
1.4 数据分析
对符合方差齐性和正态分布的指标进行双因素方差分析,试验处理为材料来源(NG、GZ)与干旱处理(CK、DT),对存在显著交互作用的指标进一步进行每个处理在另一处理每个水平下的独立样本T检验;对不符合方差齐性和正态分布的指标直接进行每个处理在另一处理每个水平下的独立样本T检验;除了双因素方差分析,对比两种材料对环境的差异性响应还有其他方法,且每种方法的最终结果会有所不同,同时采用几种方法可以更清楚、更全面的比较不同来源羊草对干旱的差异性响应[21],为此,计算了NG与GZ下羊草各指标在干旱环境下的可塑性指数(plastic indicator,PI)和绝对变化量(∆),计算公式如下:

式中:CK为对照处理;DT为干旱处理;i为指标。
2 结果与分析
2.1 单株性状及子株数
干旱胁迫显著降低了NG和GZ的单株株高、单株生物量及子株数(P<0.05)。相较于NG,GZ单株株高、单株生物量受干旱处理影响较小(图1),双因素分方差分析表明,材料来源与干旱处理对羊草单株株高、单株生物量交互作用显著(P<0.05);在干旱胁迫下,NG单株株高、单株生物量分别降低了17.71 cm,0.25 g,可塑性指数分别为48.92%、74.70%,而GZ分别降低了6.69 cm,0.14 g,可塑性指数分别为24.53%,56.44%。由于方差不齐,无法判断材料来源与干旱处理对羊草子株数是否具有交互作用,但是通过对比NG与GZ子株数在干旱胁迫下减少的绝对量(∆)发现NG子株数受影响较小,减少了10.00株,而GZ减少了14.59株(图1)。相关分析表明羊草个体株高、生物量与子株数均存在显著负相关关系(P=0.002,0.023)(图2)。
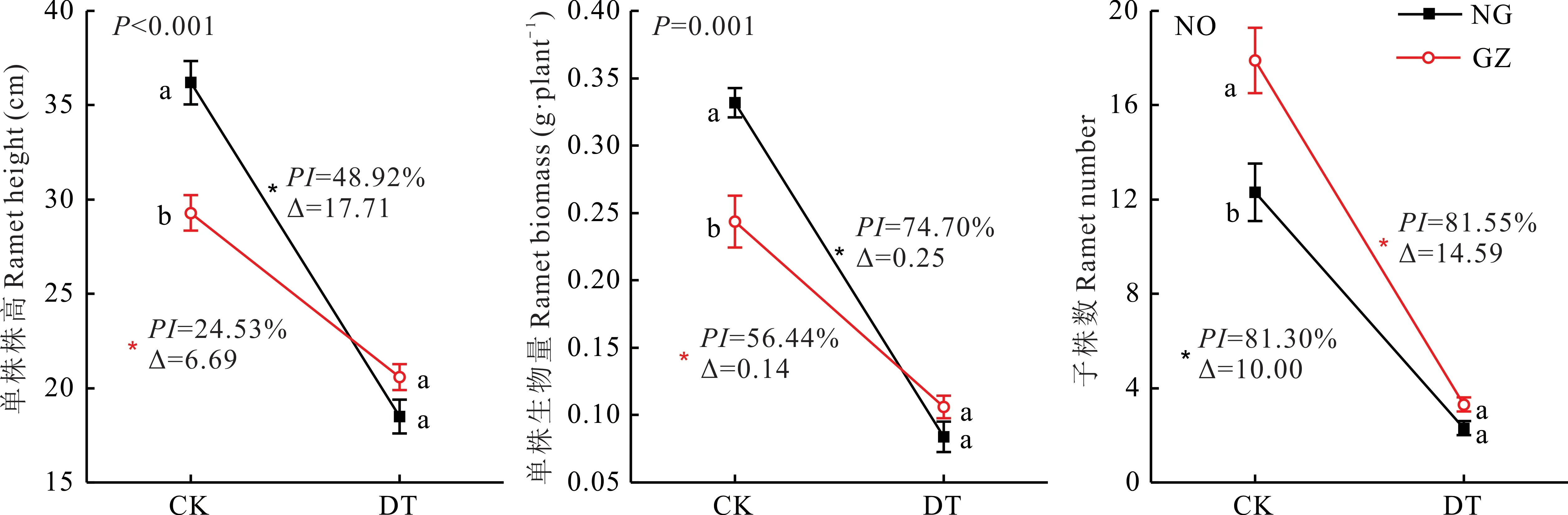
图1 放牧与围封羊草单株性状及子株数对干旱的响应Fig.1 The responses of GZ and NG to drought treatment in terms of individual characters and ramet number

图2 羊草子株数与单株株高、单株生物量间的相关分析Fig.2 Relationships between r amet number and r amet height and r amet biomass,r espectively
2.2 生物量
干旱胁迫显著降低了羊草地上、根系、根茎及总生物量(P<0.05)(图3)。对羊草地上生物量、根系生物量、总生物量的双因素方差分析表明,材料来源与干旱处理交互作用不显著(P=0.640,0.640,0.758);NG与GZ在干旱胁迫下地上生物量、根系生物量、总生物量的PI和∆也相对比较接近,GZ的减少量分别为1.81、0.84、3.23 g,NG的减少量分别为1.67、0.66、3.07 g;GZ的PI分别为88.84%、90.24%、90.36%,NG的PI分别为92.06%、84.10%、89.84%(图3)。没有对羊草根茎生物量进行双因素方差分析(方差不齐),通过对比根茎生物量在干旱处理下的∆发现,NG受干旱干扰较大,∆为0.74 g,而GZ为0.58 g,同时NG与GZ根茎生物量在对照处理下存在显著差异(P<0.05),但是在干旱处理下差异不显著(P>0.05)(图3)。
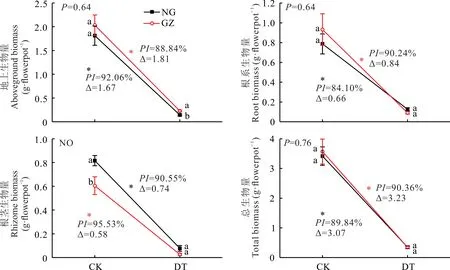
图3 放牧与围封羊草生物量累积对干旱的响应Fig.3 The responses of GZ and NG to drought treatment in terms of biomass accumulation
2.3 根茎性状
干旱处理显著降低了羊草的总根茎长度、总根茎节间数、最长根茎长度、最长根茎节间数及节间长(P<0.05)(表1)。双因素方差分析表明材料来源与干旱处理对羊草总根茎长度及总根茎节间数存在显著交互作用(P<0.001,P=0.05),GZ在干旱处理下的总根茎长度及总根茎节间数的∆分别为99.51 cm和35.71个,而NG分别为150.79 cm和49.50个;在对照处理下,NG的总根茎长度、总根茎节间数皆显著大于GZ,但是在干旱处理下都无显著性差异(表1)。材料来源与干旱处理对羊草最长根茎长度和最长根茎节间数交互作用未达到显著水平(P=0.24,0.73),GZ具有更大的PI,分别为94.38%和90.08%,而NG分别为82.21%和75.00%(表1)。由于方差不齐没有对羊草节间长进行双因素方差分析,放牧来源羊草在干旱处理下节间长的PI与∆分别为44.88%和1.27 cm,而NG分别为31.48%和0.96 cm。

表1 放牧与围封羊草根茎性状对干旱的响应Table 1 The responses of GZ and NG to drought treatment in terms of rhizome characters
2.4 生物量分配
干旱处理对NG与GZ的生物量分配具有不同的影响,其显著增加了GZ生物量的地上分配(P<0.05),而降低了NG的地上生物量分配,但差异没有达到显著水平(P>0.05)(图4),双因素方差分析表明交互作用显著(P=0.01)(表2)。干旱处理显著增加了NG的根系分配(P<0.05),PI和∆分别为-68%和-15%,但对GZ的根系分配无显著影响(P>0.05)(图4和表2)。干旱处理降低了羊草的根茎分配,虽然NG差异不显著,但是PI和∆分别达到了27%和7%;材料来源与干旱处理对羊草的根茎分配无显著交互作用(P=0.621),NG与GZ的∆基本相同,但是GZ具有更大的P(I50%),NG为27%(图4)。
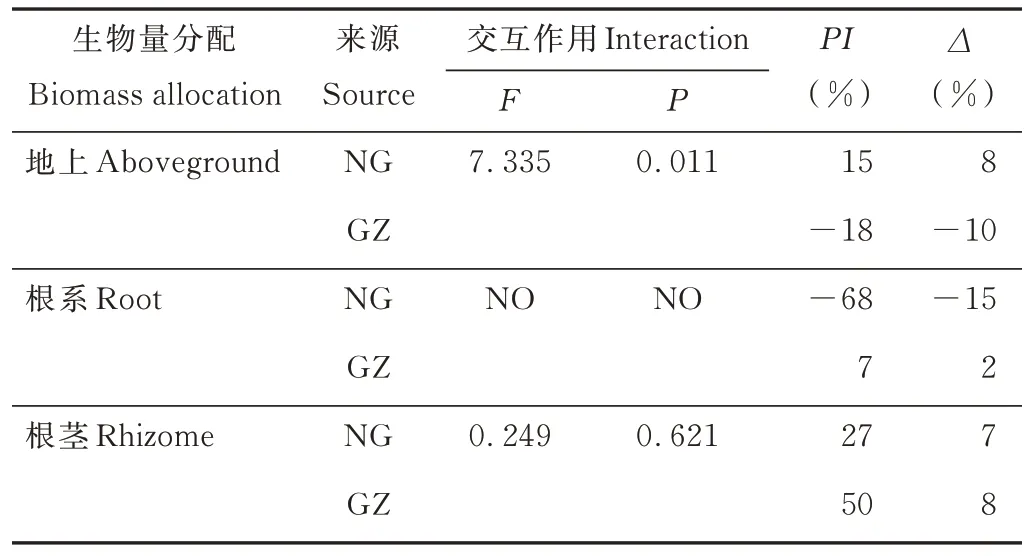
表2 羊草生物量分配双因素方差分析Table 2 Two-way ANOVA of L.chinensis biomass allocation
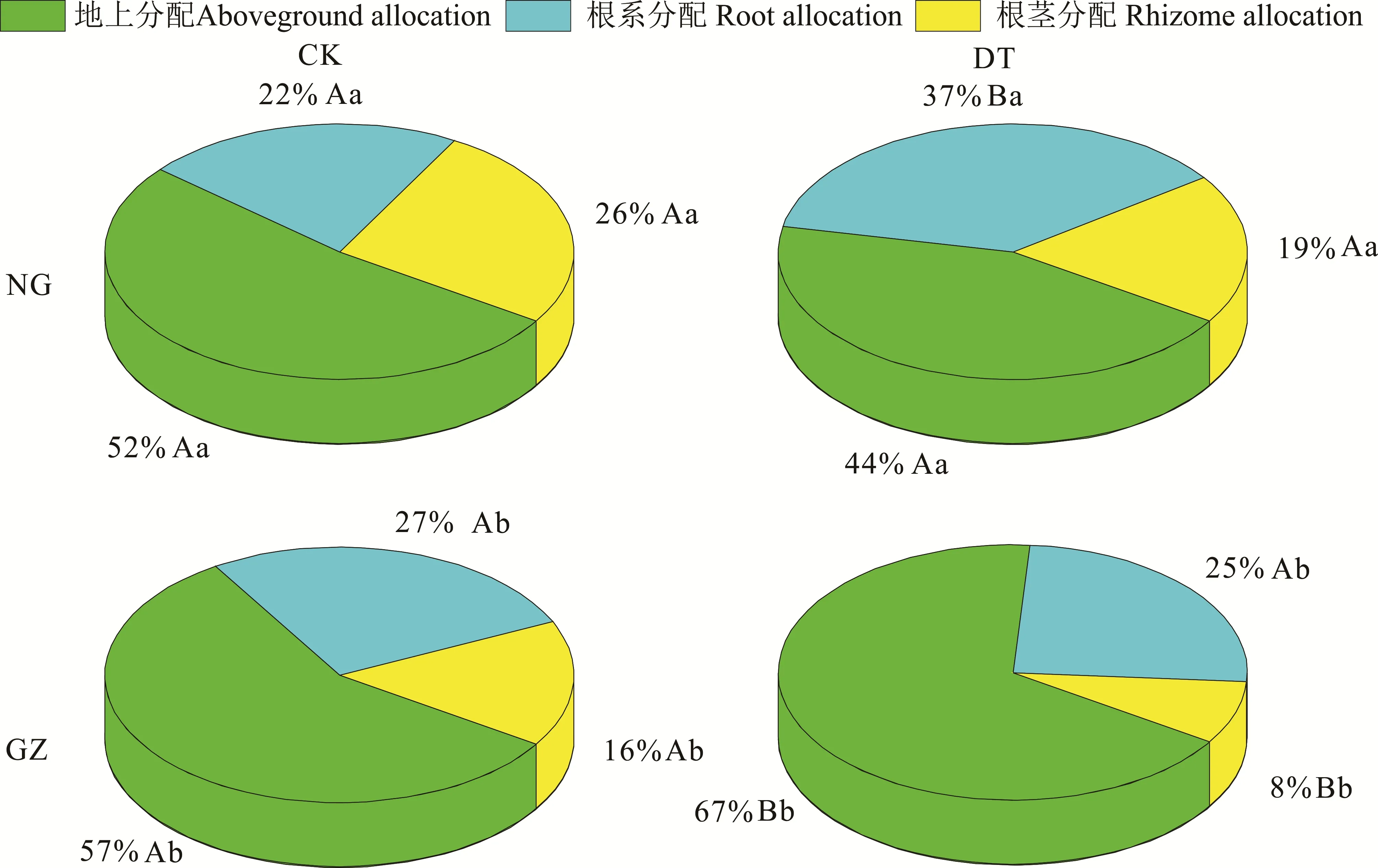
图4 放牧和围封羊草生物量分配对干旱的响应Fig.4 The responses of GZ and NG to drought treatment in terms of biomass allocation
3 讨论
GZ个体株高、生物量对干旱环境的抵抗力更强,但是子株数的抵抗力比NG低,这可能是放牧遗留效应与干旱环境对羊草具有相同的调节途径所致。由于羊草个体株高、生物量与子株数均存在显著的负相关关系,推测在对照处理下GZ具有较弱的顶端优势,因而其单株个体较小,子株数较多[22]。放牧遗留效应对羊草的影响在对照处理下对GZ和NG均具有一定的适应意义,GZ较弱的顶端优势可以通过增加子株数提高其耐牧性,也可以通过较矮的个体提高其避牧性[23],而NG较强的顶端优势可以提高其个体的光竞争能力[24]。植物的顶端优势一般通过生长素和细胞分裂素调节[25],而生长素、细胞分裂素也是植物在干旱环境下的主要调节方式[26-28]。羊草在干旱环境下生长素、细胞分裂素的调节可能掩盖了放牧遗留效应对两种激素的影响,因此干旱环境对顶端优势较强的NG单株株高、生物量影响更大,而对顶端优势较弱的GZ子株数的影响更大。
植物可以通过增加根系生物量分配增大吸水面积,同时减少地上部水分的蒸腾散失来适应干旱环境[29],NG可以通过减少地上及根茎分配,增加根系分配适应干旱环境。从总生物量角度来看,GZ与NG对干旱环境具有相同的抵抗能力,但是GZ在干旱处理下并没有增大根系生物量分配。除了增大根系生物量之外,植物还可以通过改变气孔特性、酶活性及渗透调节物质等方式适应干旱环境[30]。有关植物“干旱胁迫记忆”的研究表明母代经历过干旱的植物往往可以“记住”某些应对干旱环境的生理及分子响应,如较小的气孔导度、活性更高的保护酶系统及浓度更高的渗透调节物质等,在子代经历干旱环境时表现出更快速地生理响应[31]。羊草在放牧过程中会遭受更加严重的干旱干扰,因此GZ可能“记住”了其母代的干旱响应,更依赖于气孔、保护酶系统、渗透调节物质等生理性状的方式来适应干旱环境。
资源储存和觅食是根茎两个重要的功能,植物既可以通过根茎快速逃离养分匮乏区域或竞争区域[32],也可以在资源匮乏时增大根茎分配,待养分资源丰富时用于子株生长[33]。本研究表明,GZ与NG在干旱环境下均减小根茎分配,将更多的资源分配给吸收或光合器官,说明羊草在遭遇干旱环境时趋向于“对抗”策略,而非“逃避”策略,相对于寻找水资源丰富区域(根茎觅食)或等待水资源的改善(根茎资源储存),其更倾向于提高干旱环境下的水分吸收能力和光合能力。虽然GZ与NG根茎分配对干旱环境具有相同的响应趋势,但是地上和根系分配的响应却不同,NG减少地上分配,增大根系分配,而GZ增加地上分配,根系分配则保持不变。NG的原生环境(围封样地)在未遭遇干旱时,光资源是种内及种间的主要环境竞争因子[24],个体通过增加地上分配提高光竞争能力,而遭遇干旱时,光资源竞争因子消失,植物个体转向水分因子适应,增大根系分配以增加根系水分吸收能力[29];GZ的原生环境中(放牧样地),放牧啃食、践踏等是其生长的限制因子,当遭遇干旱时,限制因子依旧存在,此时植物增加地上分配是为了补充可能因放牧啃食而导致的光合面积的损失,水分吸收能力可能更主要的通过生理、根系形态等方式来维持;因此,GZ与NG地上、根系分配对干旱环境的不同响应是其在原生环境下对不同环境限制因子长期适应的结果。
4 结论
1)放牧与围封羊草对干旱环境的适应方式不同,围封羊草通过增加根系分配适应干旱环境,放牧羊草可能更依赖于生理过程适应干旱环境;
2)放牧与围封羊草总生物量对干旱环境具有相同的抵抗能力,但是地上部对干旱环境的响应模式不同,围封羊草单株株高、单株生物量响应更为敏感,放牧羊草子株数响应更为敏感;
3)放牧与围封羊草生物量分配对干旱环境的响应模式不同,放牧羊草在干旱环境下增加地上分配,围封羊草则增加根系分配。

