稳定过表达TFF1对MHCC97H细胞增殖、侵袭、转移及EMT发生的影响①
李亚光 邓同兴 赵克芳 马广耀 郭文涛(漯河医学高等专科学校解剖教研室,漯河462000)
原发性肝癌是世界上常见的恶性肿瘤,具有高发病率和高死亡率的特点,每年约有84万新诊断病例[1-2]。肝细胞肝癌(hepatocellular carcinoma,HCC)为主要的原发性肝癌,约占原发性肝癌的75%~85%[3]。由于大多数患者无法早期诊断,很多HCC患者确诊时已经是中晚期。HCC的恶性程度高、进展快、侵袭性强、确诊病程晚、整体预后差等特征使其成为肿瘤防治工作的难点。早期准确诊断肝癌可显著提高临床疗效,减轻患者痛苦。然而,临床技术如影像学和组织学方法只能检测相对晚期的HCC患者[4]。因此,迫切需要新的、可靠的生物标志物为临床诊治提供依据。
哺乳动物三叶因子(trefoil factor,TFF)家族由3个7~12 kD蛋白酶抗性肽组成,该家族蛋白具有6个半胱氨酸残基的独特高度保守基序,即所谓的三叶结构域[5]。目前三叶因子1(trefoil factor 1,TFF1)在肿瘤中的作用仍存在争议。TFF1最初在乳腺癌细胞中被发现,在不同的肿瘤组织(结肠癌、胰腺和卵巢)中,TFF1的异常表达与刺激细胞增殖、迁移、侵袭性和肿瘤扩散相关[6-9]。最近研究报道显示在胃癌中TFF1可以作为一种肿瘤抑制基因[10]。这些结果提示TFF1可能是一种新的肿瘤标志物。然而TFF1在肝癌中的表达情况及其过表达后对HCC细胞MHCC97H生物学行为的影响目前未见报道。本研究利用慢病毒载体使HCC细胞MHCC97H中TFF1过表达,进一步探讨细胞生物学行为的变化,以期为肝癌的诊断和治疗提供新的靶点。
1 材料与方法
1.1 材料 人HCC细胞系MHCC97H购自中国科学院上海生命科学研究院细胞资源中心;DMEM培养液和胎牛血清购自美国Gibco公司;慢病毒载体LV5-GFP购自上海吉玛制药技术有限公司;TRIzol试剂购自美国Sigma-Aldrich公司;CCK-8试剂盒购自日本Dojindo公司;反转录试剂盒和SYBR Premix Ex TaqⅡ试剂盒购自日本TaKaRa公司;Matrigel胶购自美国BD Biosciences公司;PCR引物为广州华大基因公司设计合成;TFF1、E-钙黏蛋白、N-钙黏蛋白、波形蛋白、GAPDH抗体购自美国ProteinTech Group公司;BCA蛋白浓度测定试剂盒、HRP标记的二抗、ECL发光试剂购自上海碧云天公司。
1.2 方法
1.2.1 TFF1与肝癌的临床关联分析 肝癌组织中TFF1表达的临床数据来源于癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库(https://tcgadata.nci.nih.gov/tcga),利用该数据库分析TFF1在肝癌组织和正常组织中的表达。另取来源于漯河医专第一附属医院32例肝癌组织和癌旁正常组织样本,样本收集于2017年1月至2019年8月,患者术前未经放、化疗和免疫治疗。荧光定量PCR(quantitative real time polymerase chain reaction,qRT-PCR)检测不同组织中TFF1 mRNA的表达。
1.2.2 细胞培养和慢病毒感染 将MHCC97H细胞培养在含10%FBS的DMEM中。细胞在37℃、5%CO2培养箱中培养。将TFF1的cDNA序列克隆到慢病毒载体LV5-GFP中。使用293T细胞进行慢病毒包装,72 h后收集病毒上清,经0.45 μm过滤器过滤用于感染MHCC97H细胞。收集处于对数生长期的MHCC97H,制备成5×104个/ml的悬液。将细胞以2 ml/孔接种到6孔板中。24 h后用慢病毒(1×108TU/ml)感染,感染后用嘌呤霉素(2 μg/ml)处理细胞72 h以筛选阳性克隆,用荧光显微镜观察阳性细胞。感染TFF1慢病毒的细胞为过表达组(overexpression TFF1 group,oe-TFF1组);同时用不含TFF1的慢病毒感染细胞作为阴性对照组(negative control group,NC组);用未转染的细胞作为空白组(Blank组)。
1.2.3 qRT-PCR检测TFF1表达 使用TRIzol试剂提取肝癌组织和细胞中的总mRNA。紫外可见分光光度法确定浓度后,使用PrimeScript RT试剂将RNA反转录为cDNA。用获得的cDNA作为模板,使用SYBR Premix Ex TaqⅡ(Tli RNaseH Plus)试剂盒进行实时荧光定量PCR检测。引物序列为:TFF1上游引物:5'-TGGGTTTTGGTTAGGGTGTT-3';TFF1下游引物:5'-CTCATCCCTAACTCAAAATCA-3';GAPDH上游引物:5'-CGAGATCCTCAACCAATCAA-3',下 游 引 物:5'-GGTGGTCCAGGGTCGTTACT-3'。PCR反应条件:95℃20 s,60℃30 s,72℃30 s,重复40个循环。以GAPDH为内参,采用相对定量(2-ΔΔCt法)计算靶基因相对表达量。
1.2.4 Western blot分析 收集细胞,提取各组细胞总蛋白,用PBS洗涤,在含有蛋白酶和碱性磷酸酶抑制剂的蛋白裂解缓冲液中裂解30 min。提取各组总蛋白,用BCA法进行定量。蛋白质通过10%SDSPAGE电泳分离,转移到PVDF膜上,5%脱脂牛奶封闭1 h,用稀释的一抗(TFF1 1∶1 000、E-cadherin 1∶1 000、N-cadherin 1∶1 000、Vimentin 1∶1 000、GAPDH 1∶2 000)在4℃孵育过夜。TBST洗涤3遍后,将膜与辣根过氧化物酶(horseradish peroxidase,HRP)偶联的二抗孵育1 h。TBST洗膜3遍,将膜与增强的化学发光(electrochemiluminescence,ECL)试剂一起孵育,X光片曝光成像。使用ImageJ软件分析灰度值,并根据目标蛋白条带与GAPDH条带的灰度值之比计算目标蛋白相对表达水平。
1.2.5 迁移实验 用胰蛋白酶消化细胞,PBS洗涤2遍,用无血清培养基将细胞制备成悬浮液,密度调整为1×105个/ml。将150 μl细胞悬液添加到Transwell顶端腔室中,并将500 μl含20%血清的培养基添加到基底外侧腔室中。48 h后,将腔室移出并用无菌PBS洗涤。用棉签小心地擦拭微孔膜内层中的细胞,95%乙醇固定6 min,然后用4 g/L结晶紫溶液染色。在倒置显微镜下计数。
1.2.6 侵袭试验 将Matrigel胶用DMEM以1∶9的比例稀释并加入上室中。凝胶凝固后,将含有10%FBS的500 μl DMEM加入到24孔板中,并将细胞密度调整为1×105个/ml,按照迁移实验方法进行后续实验。
1.2.7 CCK-8试验 将细胞在96孔板(3×103个/孔)中培养24 h、48 h、72 h和96 h。除去培养基,向各孔中加入100 μl含10%FBS的DMEM和10 μl CCK-8测定缓冲液。孵育4 h后,在450 nm处测定吸光度(OD)值。绘制细胞生长曲线。
1.2.8 集落形成实验 将细胞500个/孔接种到6孔板中。37℃、5%CO2培养箱培养14 d,用PBS轻轻洗涤孔2次。75%乙醇固定后在室温下用0.1%结晶紫染色10 min。PBS洗涤并使其自然干燥,然后拍摄集落并计数。
1.3 统计学方法 采用SPSS20.0软件进行统计分析,数据用±s表示,t检验和单因素方差用于分析实验结果和生物信息学数据。P<0.05为差异具有统计学意义。
2 结果
2.1 TFF1在肝癌患者中的表达 根据TCGA中的临床信息,发现与正常组织相比,肝癌组织中TFF1的表达降低,差异具有统计学意义(图1A,P<0.05)。通过qRT-PCR分析临床样本,结果发现与癌旁正常组织相比,TFF1 mRNA的表达水平在肝癌组织中显著降低,差异有统计学意义(图1B,P<0.05)。
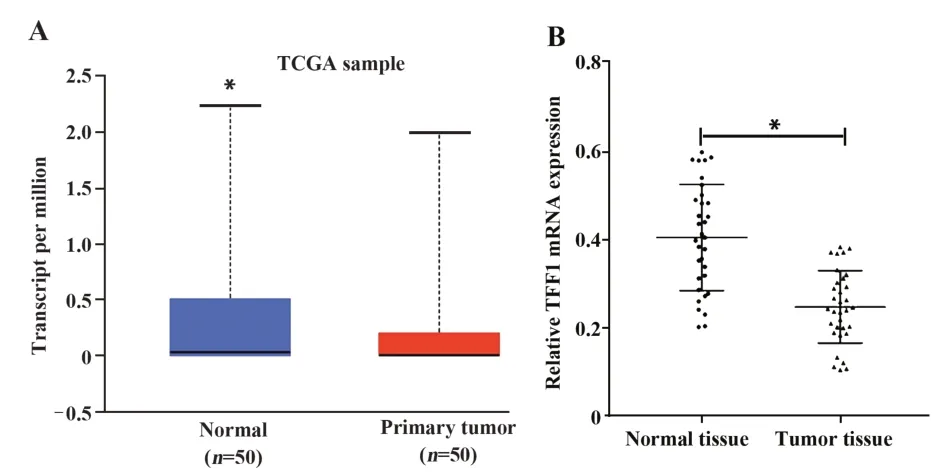
图1 TFF1在肝癌组织和正常组织中的表达Fig.1 Expression of TFF1 in human hepatoma and normal tissues
2.2 慢病毒介导TFF1在MHCC97H细胞中高表达为了研究TFF1在肝癌中的作用,通过将慢病毒介导的TFF1转染到MHCC97H细胞中。感染后3 d通过荧光显微镜观察到超过90%的细胞表达GFP,这表明慢病毒载体成功感染了MHCC97H细胞(图2A)。qRT-PCR结果表明与用空载体转染的细胞相比,TFF1转染成功的细胞中TFF1 mRNA的表达水平显著增加(图2B,P<0.01)。Western blot结果显示与对照相比,TFF1转染成功的细胞中TFF1蛋白表达水平也显著升高(图2C、D,P<0.01)。结果表明成功获得了稳定高表达TFF1的MHCC97H细胞。
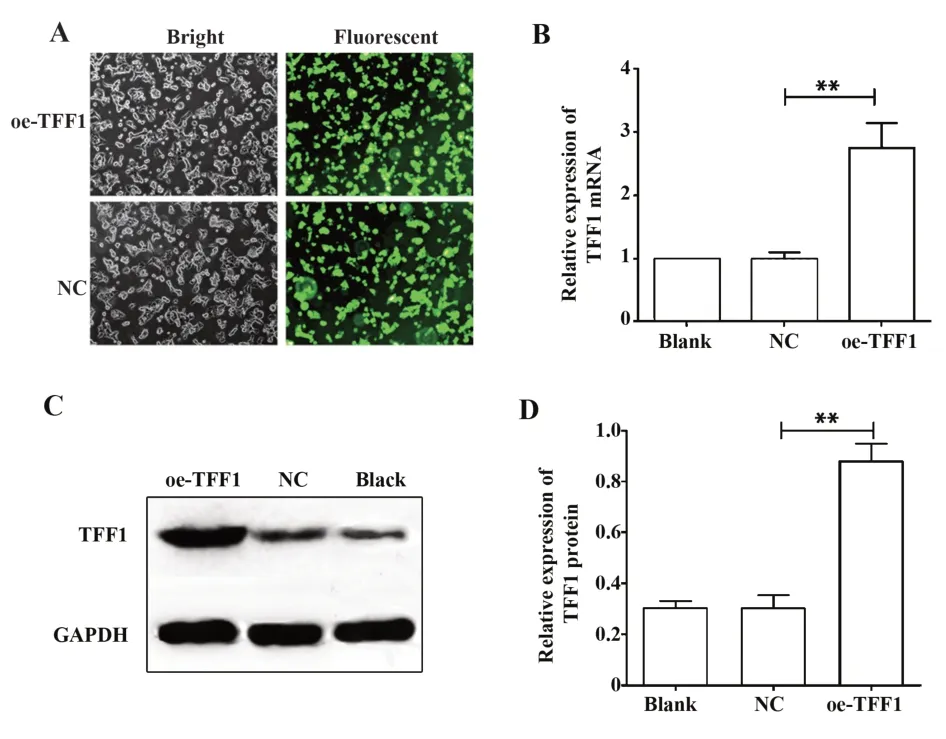
图2 慢病毒介导外源性TFF1在MHCC97H细胞中过表达Fig.2 Establishment of TFF1-overexpression MHCC97H cell line
2.3 TFF1过表达对MHCC97H细胞增殖和集落形成能力的影响 慢病毒介导TFF1过表达后,CCK-8检测发现与对照组相比,oe-TFF1组细胞的增殖明显受到抑制(图3A)。集落形成实验表明,在慢病毒感染MHCC97H细胞14 d后,oe-TFF1组细胞集落形成降低(图3B、C,P<0.01)。这提示TFF1的过表达抑制了MHCC97H细胞的增殖和集落形成能力。

图3 TFF1过表达对MHCC97H细胞增殖的影响Fig.3 Effect of TFF1 overexpression on cell proliferation
2.4 TFF1过表达对MHCC97H细胞迁移与侵袭能力的影响 迁移实验表明,接种48 h后,与对照组相比,oe-TFF1组MHCC97H细胞迁移穿膜的数量为101.67±4.087,与对照组(135.83±3.87)相比显著减少(图4A、B,P<0.01),表明TFF1过表达能抑制MHCC97H细胞的迁移能力。侵袭实验表明与对照组相比,TFF1的过表达可以减少MHCC97H细胞通过Matrigel胶的细胞数量(图4C、D,84.5±1.87 vs 109.5±4.28,P<0.01)。说明过表达TFF1表达能抑制MHCC97H细胞的侵袭能力。
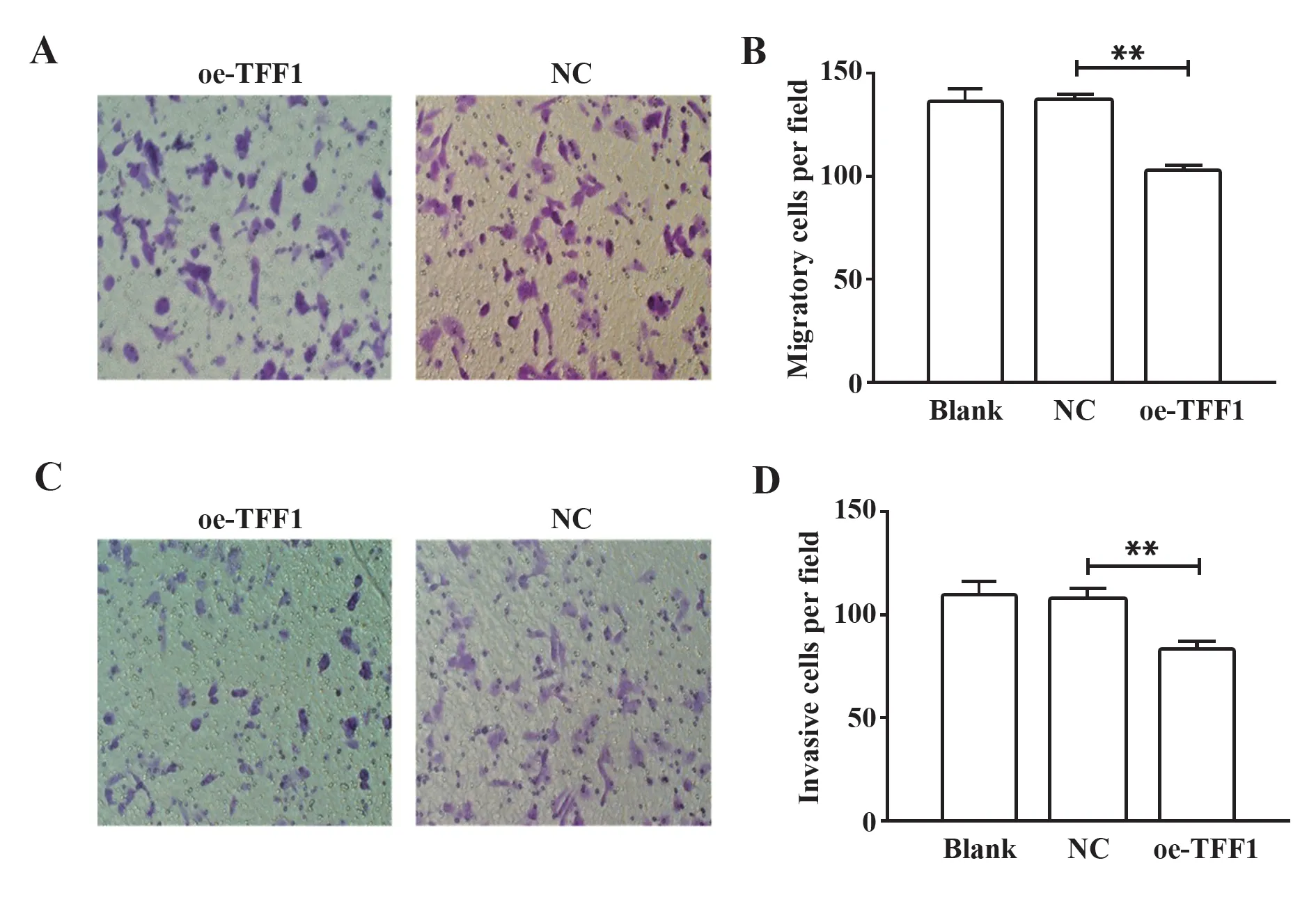
图4 TFF1过表达抑制MHCC97H细胞迁移和侵袭Fig.4 Overexpression of TFF1 attenuated migration and invasion of MHCC97H cells
2.5 TFF1过表达对MHCC97H细胞EMT的影响Western blot检测TFF1过表达后上皮-间质转化(epithelial-mesenchymal transition,EMT)相关蛋白E-钙黏蛋白(E-Cadherin)、N-钙黏蛋白(N-Cadherin)和人波形蛋白(Vimentin)的表达水平。结果显示与对照组相比TFF1过表达组细胞中E-Cadherin表达增高,与之相反,Vimentin和N-Cadherin则在oe-TFF1组表达下降(图5)。这提示细胞EMT进程因TFF1过表达而被抑制,进而抑制HCC细胞的侵袭与迁移能力。
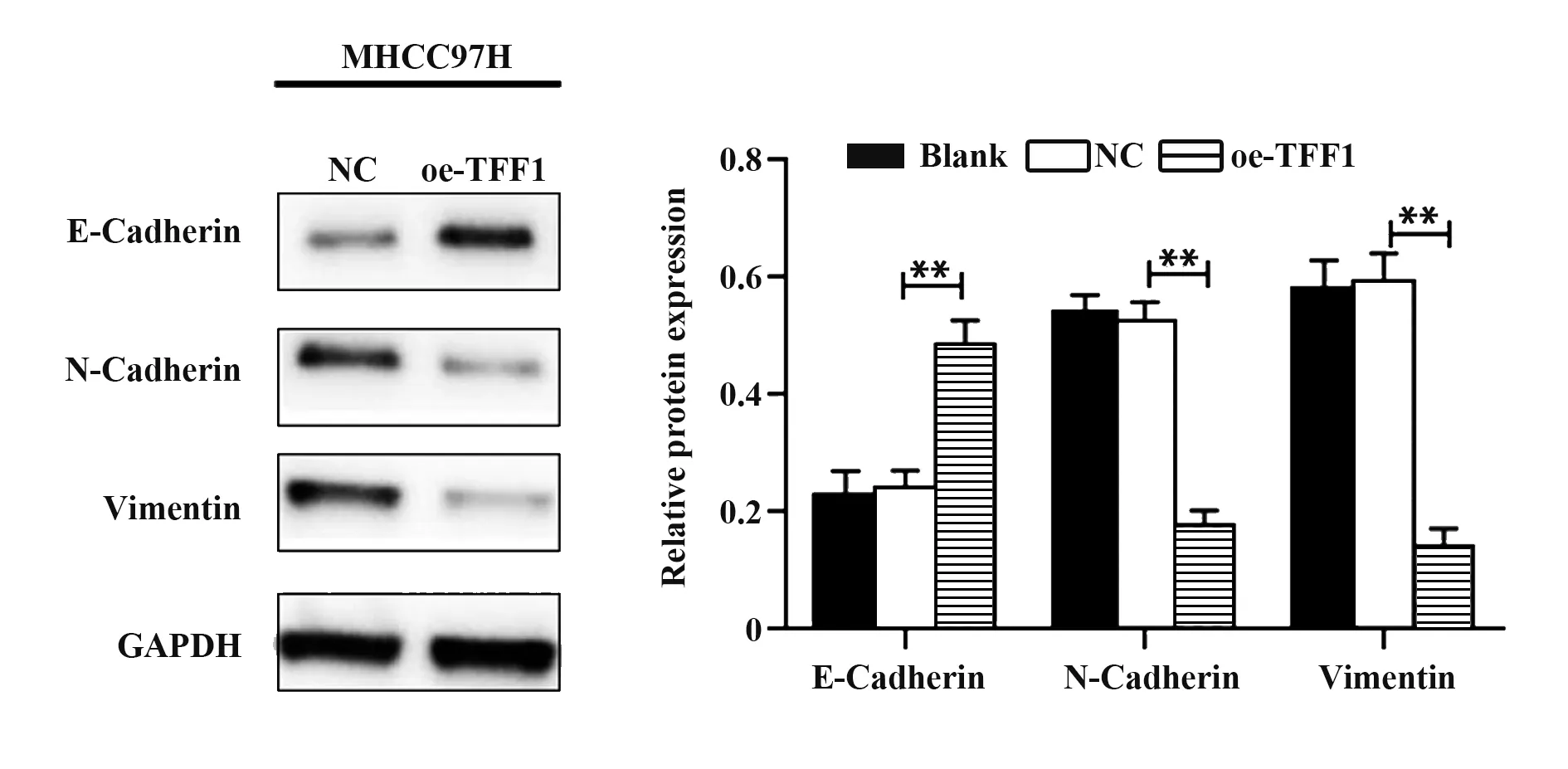
图5 TFF1过表达对EMT蛋白表达的影响Fig.5 Effect of TFF1 overexpression on expressions of EMT-related proteins
3 讨论
TFF基因定位21号蛋白,该家族蛋白均含有一个或几个三叶因子结构域,该结构域结构特殊、稳定性强,使得TFF家族蛋白有着耐热、耐酸和耐蛋白酶水解的理化特质。TFF1是三叶因子之一,作为一种分泌蛋白,在多种组织中均有表达,但主要高表达于胃肠道内,发挥着胃肠道黏膜屏障和修复的生理功能[11]。TFF1能够与黏蛋白结合发挥保护胃肠道的功能,同时还能够促进黏膜重建。TFF1在其他器官如回肠、结肠、唾液腺、胰腺、呼吸道、乳房和肝脏中均有表达,在其他部位的组织再生中发挥作用[12-13]。
最近的研究发现TFF1在肿瘤形成过程中发挥作用。研究发现TFF1在胃癌中表达水平降低,TFF1敲除后小鼠更容易发生胃癌[14-15]。胃作为TFF1的主要表达器官,在发挥促进组织再生的同时也作为一种肿瘤抑制因子存在。但是在结肠、乳腺、胰腺和前列腺肿瘤组织中发现TFF1表达水平升高,能够刺激细胞存活、迁移、侵袭性以及肿瘤扩散,表明TFF1是一种潜在的肿瘤标志物[7-9]。在肝脏中发现受损肝细胞TFF1表达较弱。大多数肝癌是在肝炎和肝硬化基础上发生的,而肝炎和肝硬化都是需要再生的肝损伤,肝细胞中的TFF1在肝癌发生的早期可能具有促进肝再生或者抑制肝癌发展的作用,TFF1在肝癌中的功能有待进一步研究。
肝癌是一种高发病率和高死亡率的恶性肿瘤,TFF1在肝癌中的作用和功能报道较少。本研究根据TCGA中的临床信息,发现与正常组织相比,肝癌组织中TFF1的表达降低。利用慢病毒介导使TFF1在MHCC97H细胞中过表达,CCK-8实验和克隆形成实验发现,TFF1的过表达抑制了MHCC97H细胞的增殖和集落形成能力。迁移和侵袭实验表明过表达TFF1能抑制MHCC97H细胞的迁移、侵袭能力。这些结果提示TFF1可能也是肝癌的一种潜在肿瘤标志物,参与了肝癌的发生、发展过程。
EMT是细胞失去其上皮特性而获得间充质特征的过程,已被证明是癌症进展的重要步骤。在EMT期间,上皮细胞失去细胞极性以及与基底膜链接等上皮表型,改变细胞骨架结构并增加其运动性,所有这些均导致侵袭性表型[16-17]。EMT后的肿瘤细胞可以离开肿瘤块并迁移到周围的正常组织中,从而导致这些肿瘤的局部进展[18]。此外,EMT会增加肿瘤细胞侵袭血管以及向新组织中上皮层的迁移,导致远处转移的发生率更高,肿瘤患者的预后更差[19]。EMT的特征是上皮标志物的表达降低同时间充质相关蛋白的表达升高,其中E-钙黏蛋白的下调和N-钙黏蛋白和/或波形蛋白的上调为EMT的典型标志[20]。本研究发现TFF1过表达后引起HCC细胞中E-Cadherin表达增高,与之相反,Vimentin和N-Cadherin则表达降低。结果提示EMT进程因TFF1过表达而被抑制,进一步导致HCC细胞侵袭与迁移能力的降低。TFF1在HCC的侵袭、转移过程中可能发挥了重要作用。
综上所述,通过使TFF1在人HCC细胞MHCC97H中过表达,能够抑制细胞增殖、侵袭、迁移以及EMT的能力。这表明TFF1可能是HCC发生的一种抑制因子,可作为一种新的肿瘤标志物。鉴于TFF1作为一种分泌蛋白,利用TFF1治疗肝癌有可能成为一种新的肝癌治疗策略。