mTOR抑制剂雷帕霉素对黑色素瘤肝转移的影响①
周加宁 张 毓(锦州医科大学基础医学院,锦州121000)
黑色素瘤是一种起源于神经嵴黑素细胞的具有高度侵袭性的恶性肿瘤,黑痣短期内迅速增大、颜色加深为其典型表现,恶性度极高。黑色素瘤细胞能够渗透至组织、淋巴、血管,早期即能转移到肝脏,且转移后预后较差,致死率较高,近50年来,针对转移性黑色素瘤的治疗效果并不明显,五年存活率不足5%[1-3]。缺乏有效的药物靶点是黑色素瘤药物化疗过程中的关键问题,且黑素瘤对药物的敏感性下降,易产生耐药性限制了黑素瘤患者长期疗效,相关研究表明,耐药性的产生与PI3K/AKT/mTOR作用于黑素瘤细胞息息相关[4-7]。
雷帕霉素(rapamycin,RAPA)是一种mTORC1特异性抑制剂,属于新型大环内酯类药物,可与细胞内他克莫司结合蛋白-12(FKBP12)形成rapamycin-FKBP12复合物。该复合物对mTORC2不敏感,但可破坏mTORC1中mTOR和Raptor之间的联系从而抑制mTOR活性[8]。目前,RAPA已被批准用于肾癌的治疗,同时它还被扩展用于胃癌、淋巴瘤、肝癌、乳腺癌、肺癌和神经内分泌肿瘤等的实验治疗[9-20]。相关研究表明,RAPA可以阻断mTOR信号通路,抑制黑色素瘤的血管生成和淋巴管生成[21]。尽管如此,人们对RAPA抗肿瘤作用的认知仍不全面,尤其不足的是它对黑色素瘤转移的影响。根据上述研究,认为RAPA可能具有抑制黑色素瘤转移的作用。此外,肿瘤转移研究多使用尾静脉注射模型,短期内大量肿瘤细胞进入血液循环其实不能很好模拟肿瘤患者体内的真实过程。在黑色素瘤肝转移模型中,肿瘤细胞直接进入体循环,具有转移快的优点。该模型具有高重复性及高成功率,能够控制引入循环中的肿瘤细胞的数量[22-23]。使用更贴近病理过程的模型探索RAPA对转移的影响将有助于拓展它在肿瘤治疗中的应用潜能。本实验通过脾脏注射构建小鼠肝转移模型,通过腹腔给药的方式观察RAPA对肿瘤肝转移的作用。此外,本研究还利用体外培养体系考察了RAPA对肿瘤细胞增殖、迁移、侵袭及凋亡的影响。
1 材料与方法
1.1 材料6~8周龄SPF级雄性C57BL/6小鼠(维通利华公司)饲养于锦州医科大学实验动物中心;小鼠黑色素瘤细胞(B16-F10)由北京大学医学部实验室馈赠,本实验室冻存储存;光学显微镜购自日本Olympus公司;二氧化碳培养箱、台式高速冷冻离心、多功能酶标读数仪机购自美国Thermo公司;-20℃冰箱购自中国Haier公司;流式细胞仪购自美国BD公司;DMEM培养基、胎牛血清、盘尼西林抗生素、非必需氨基酸、2-Mercaptoethanol、0.25%胰蛋白酶、DMSO购自美国Gibco公司;MTT、结晶紫染料购自上海碧云天生物科技有限公司;Transwell小室购自美国BioCoat公司;凋亡试剂盒Annexin VFITC/PI购自江苏凯基生物技术公司;6孔板、24孔板、96孔板购自美国CORNING公司。
1.2 方法
1.2.1 细胞培养 黑色素瘤细胞B16-F10接种于含有10%胎牛血清、1%盘尼西林抗生素、1%非必需氨基酸、0.1%2-Mercaptoethanol的DMEM培养基中,在5%CO2、37℃恒温、恒湿培养箱中培养传代。
1.2.2 给药剂量与分组 将肝转移模型小鼠随机分为4组,空白对照组、0.5 mg/kg RAPA组、0.75 mg/kg RAPA组、1.0 mg/kg RAPA组,每组5只小鼠,术后10 h给药,连续给药7 d。将不同浓度雷帕霉素处理的B16-F10细胞分为:对照组(0 μmol/L RAPA);1 μmol/L RAPA处理组;3 μmol/L RAPA处理组;5 μmol/L RAPA处理组;10 μmol/L RAPA处理组(凋亡实验)。
1.2.3 黑色素瘤肝转移模型 将对数生长的B16-F10细胞调整为2.5×106个/ml的细胞悬液。将小鼠左侧肋下毛发剃除干净,以暴露出皮肤为宜,腹腔注射1%三溴乙醇对C57BL/6小鼠进行麻醉后,将小鼠呈右侧位固定于无菌操作单上,在小鼠左侧腋中线和腋后线之间,切开5 mm的切口,盖上无菌洞巾,用镊子轻拉出脾脏置于切口外,提起脾脏,钝性分离脾脏周围组织,用一条可吸收缝线在脾脏中间位置穿过,打一活结,在脾脏下级1/3处进针,缓慢注入100 μl细胞,用棉签轻轻按压,将活结系牢,离断下级脾脏及脾脏系膜,将上级脾脏送回腹腔,用无菌棉签轻轻擦拭腹腔内残留的细胞和血液,逐层关腹。将小鼠置于电热垫上进行术后恢复。
1.2.4 一般情况观察 每日观察小鼠状态,包括活动量、饮食饮水量、毛色、排泄物以及腹部情况。饲养14 d后,颈椎脱臼法处死所有小鼠。解剖小鼠观察腹腔内各器官的情况,包括肝转移癌结节及其他脏器受累情况,腹腔转移情况以及有无腹腔积液;最后取出肝组织称重。
1.2.5 组织病理学 将肝转移模型小鼠肝组织用4%多聚甲醛溶液固定,石蜡包埋切片,切片厚度为4 μm,按照HE染色步骤进行烤片、脱蜡、梯度乙醇溶液水化、HE染色、脱水及封固。
1.2.6 细胞划痕实验 将6孔板反扣在无菌操作台上,用记号笔在6孔板背面等距画3条平行线,将B16-F10细胞消化离心,DMEM培养基重悬后接种于6孔板中,培养24 h,待呈单层细胞时,用200 μl枪头均匀在每个孔内划痕,PBS清洗3遍,清洗掉脱落细胞,更换成无血清培养基继续培养,不同浓度的RAPA进行给药处理,每个组设置3个平行孔,分别在0 h、24 h时拍照,用Image J软件对图片进行处理,计算每个图片中细胞的划痕面积,该实验重复3次,按照下式计算细胞愈合率:细胞愈合率(%)=(0 h划痕面积-24 h划痕面积)/0 h划痕面积×100%。
1.2.7 Transwell实验 将不同浓度RAPA处理过的B16-F10细胞消化离心,无血清培养基进行重悬,以1×105个/孔的细胞数接种于上室,下室中加入0.75 ml 10%FBS的完全培养基,置于培养箱中培养约20 h。次日取出小室,弃去上室内的培养基。向新的孔中加入600 μl-20℃预冷好的甲醇,把小室放到孔内,在上室内加入150 μl预冷甲醇,置于4℃固定15 min以上。将甲醇吸干,用棉签擦拭室内的液体及细胞。用结晶紫染液进行避光染色30 min。在新的孔中加入600 μl PBS,室温静置3~5 min,重复该步骤3~5次,至镜下观察背景无色即可,镜下拍照计数,实验重复3次。
1.2.8 MTT检测细胞增殖 将B16-F10细胞以5×103个/(100 μl·孔)接种于96孔板中,待细胞贴壁后,给药组加入不同浓度的RAPA溶液,每组设置6个复孔,对照组和调零孔中加入同体积的培养基,培养箱继续培养24 h后,每孔加10 μl MTT,4 h后弃掉实验孔中的培养基,每孔中加入150 μl DMSO。低速振荡至紫色结晶溶解消散,在波长490 nm处检测各孔的光密度值,根据数值绘制细胞增殖活力曲线,实验重复3次。
1.2.9 Annexin V-FITC法检测细胞凋亡 将对数生长期的B16-F10细胞按照5×104个/孔接种于6孔板中,细胞贴壁后除去旧培养基替换为含有RAPA的无血清培养基,处理24 h,每组3个复孔。弃掉原有培养基,胰酶消化后2 000 r/min离心5 min,弃上清液,PBS清洗2次,加入500 μl Binding buffer悬浮细胞,加入5 μl Annexin V-FITC混匀后,加入5 μl Propidium iodide,混匀。室温避光孵育10 min,流式细胞仪分析细胞凋亡情况,实验重复3次。
1.3 统计学处理 数据采用GraphPad Prism 7软件进行统计学分析,P<0.05为差异具有统计学意义。并采用Image J 180软件进行细胞划痕实验、侵袭实验的图片处理,采用FlowJo软件进行凋亡数据分析。
2 结果
2.1 雷帕霉素抑制黑色素瘤肝转移 解剖小鼠肝脏,肉眼检视可见肝组织中有多个大小不一的黑色结节,各剂量药物处理组结节分布密度明显比对照组低(图1A)。显微镜下,肿瘤灶呈巢状排列,细胞的形态呈现多样性,异型性明显,黑色素含量多少不一,细胞核大而深染,可见细胞核分裂相(图1B)。鉴于结节难以准确计数,本研究转而通过肝脏称重评估转移灶形成的整体状况。与对照组肝组织重量(1.79±0.12)g相比,0.5 mg/kg RAPA、0.75 mg/kg RAPA、1.0 mg/kg RAPA处理组肝组织重量分别为(1.32±0.09)g、(1.28±0.09)g、(1.25±0.07)g,均显著降低,差异具有统计学意义(P<0.05),结果表明,雷帕霉素能够抑制小鼠黑色素瘤细胞肝转移(图1C)。
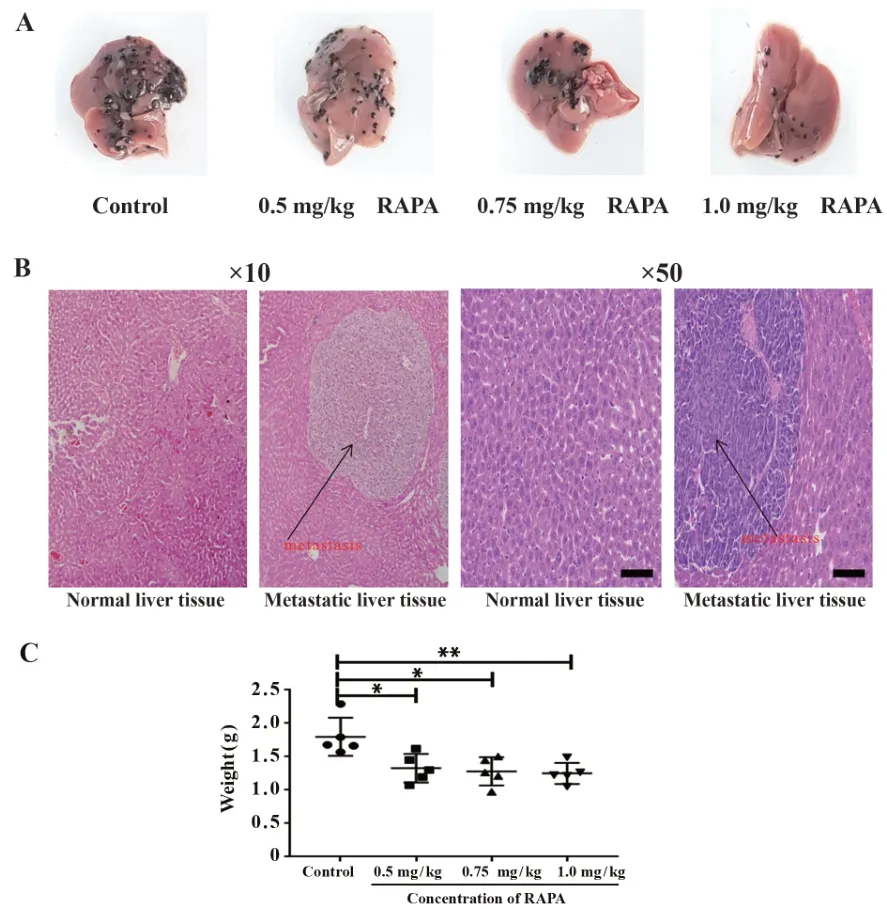
图1 RAPA对小鼠黑色素瘤肝转移的影响Fig.1 Effects of RAPA on liver metastasis of melanoma cells in mice
2.2 不同浓度的雷帕霉素对黑色素瘤迁移能力的影响 划痕实验结果(图2)显示,与对照组(79.9±1.8)%相比,RAPA 1 μmol/L、RAPA 3 μmol/L、RAPA 5 μmol/L给药组细胞迁移能力均降低,愈合率分别为(67.4±3.3)%、(59.4±3.5)%、(50.8±3.4)%,差异具有统计学意义(P<0.05),说明雷帕霉素可以抑制黑色素瘤细胞迁移。
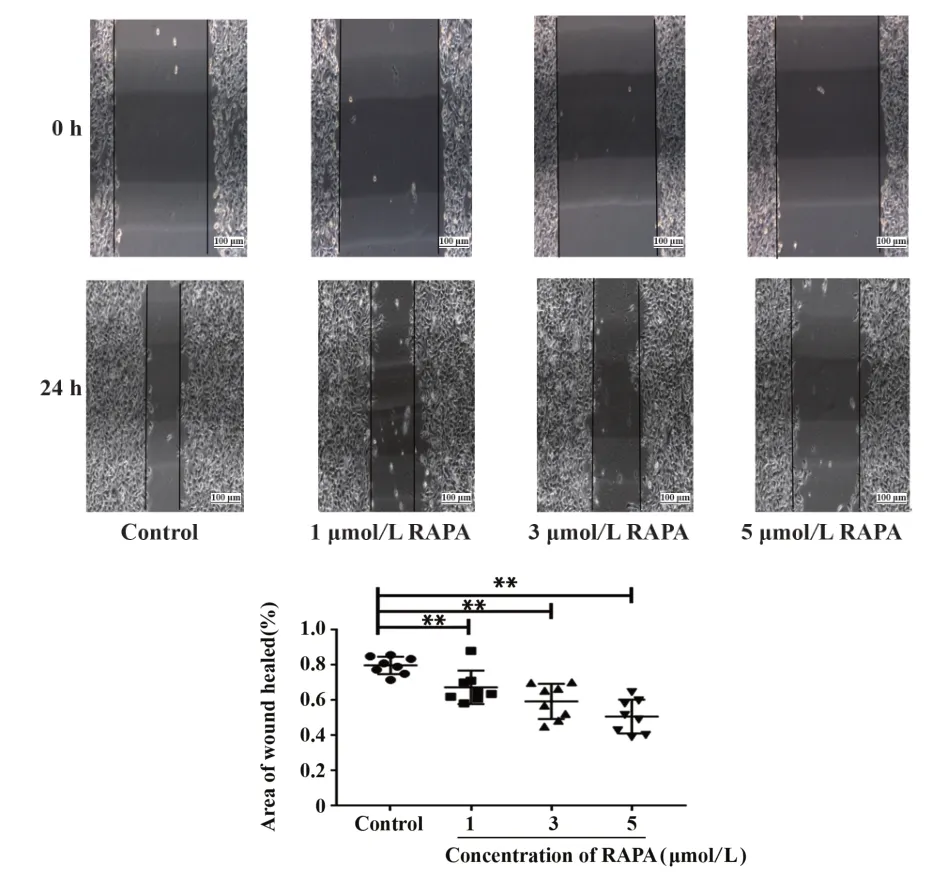
图2 雷帕霉素抑制小鼠黑色素瘤细胞的体外迁移能力(普通显微镜,×10)Fig.2 RAPA suppresses melanoma cell migration in vitro(common microscope,×10)
2.3 不同浓度的雷帕霉素对黑色素瘤侵袭能力的影响Transwell实验结果(图3)显示,与对照组侵袭到小室膜底侧细胞数(338.8±25.71)比较,3 μmol/L RAPA、5 μmol/L RAPA处理组侵袭到小室膜底侧细胞数分别为244.8±23.49、117.4±22.68,细胞数明显减少,差异具有统计学意义(P<0.05),说明雷帕霉素可以抑制黑色素瘤细胞侵袭。
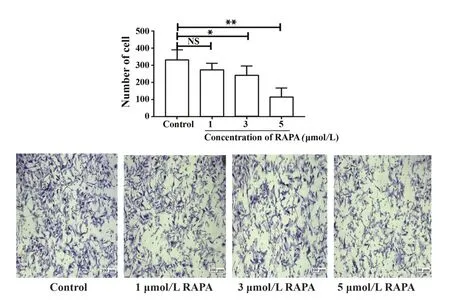
图3 雷帕霉素抑制小鼠黑色素瘤细胞的体外侵袭能力(倒置显微镜,×10)Fig.3 RAPA suppresses B16-F10 invasion in vitro(inverted microscope,×10)
2.4 不同浓度的雷帕霉素对黑色素瘤增殖能力的影响MTT实验结果(图4)显示,与对照组OD值(1.28±0.06)比较,1 μmol/L RAPA、3 μmol/L RAPA、5 μmol/L RAPA处理组细胞增殖活性显著降低,OD值分别为1.02±0.04、1.01±0.08、0.99±0.04,差异具有统计学意义(P<0.05),因1 μmol/L RAPA、3 μmol/L RAPA处理组内未见显著的差异(P>0.05),所以后续凋亡实验将雷帕霉素浓度调整为3 μmol/L RAPA、5 μmol/L RAPA、10 μmol/L RAPA。

图4 雷帕霉素抑制小鼠黑色素瘤细胞的体外增殖能力Fig.4 RAPA suppresses B16-F10 proliferation in vitro
2.5 不同浓度的雷帕霉素对黑色素瘤凋亡的影响 用不同浓度的雷帕霉素干预小鼠黑色素瘤细胞,流式细胞仪检测细胞凋亡水平,结果(图5)显示,对照组未见明显凋亡,凋亡率为(2.67±0.15)%,雷帕霉素干预的小鼠黑色素瘤细胞凋亡数显著增加(P<0.05),凋亡率分别为(10.45±0.16)%、(18.53±0.10)%、(37.21±0.42)%,且随着雷帕霉素浓度增加凋亡率显著提高(P<0.05),说明雷帕霉素可以诱导黑色素瘤细胞发生凋亡,且呈浓度依赖性。
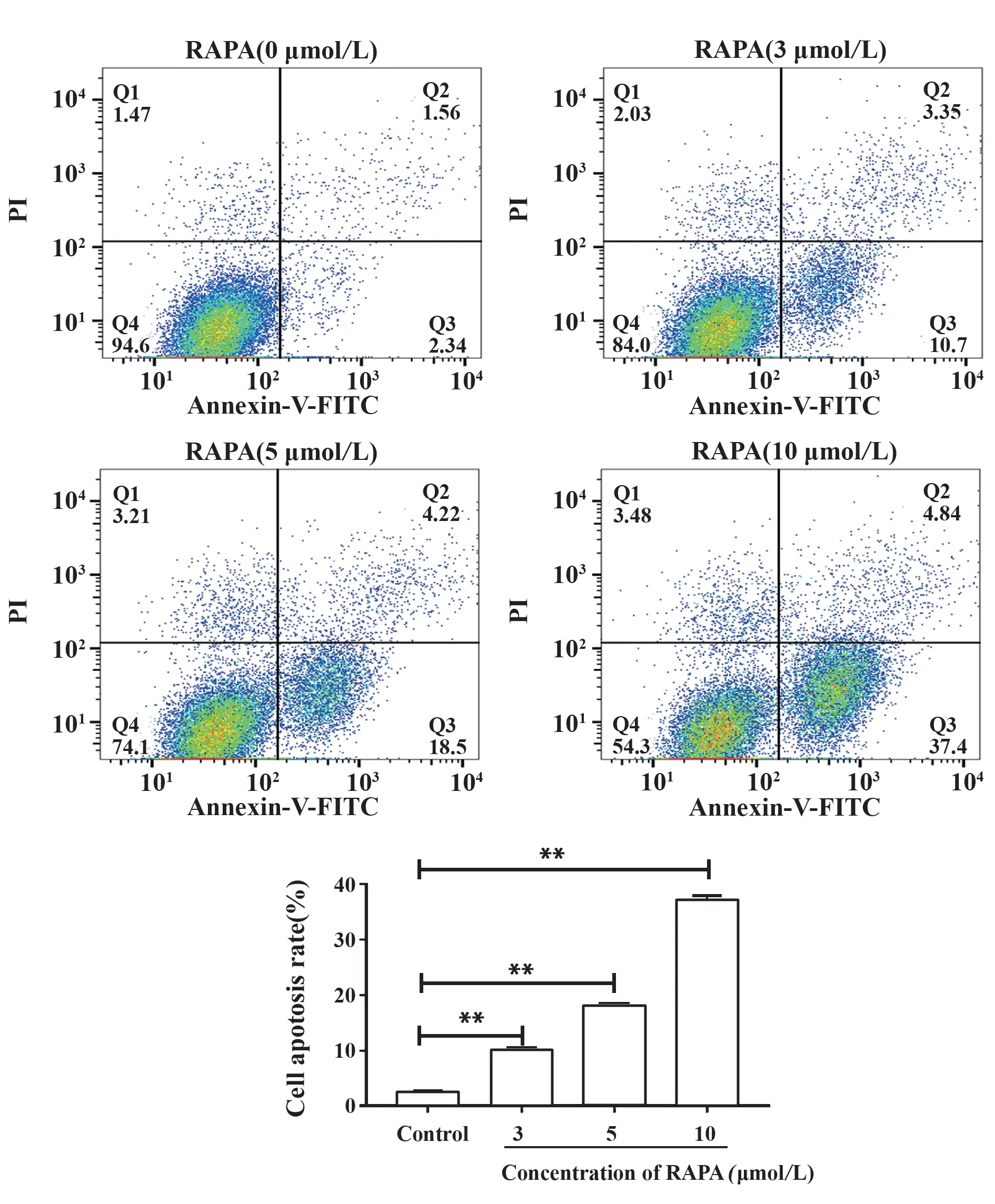
图5 雷帕霉素促进小鼠黑色素瘤细胞的体外凋亡Fig.5 RAPA promotes B16-F10 apoptosis in vitro
3 讨论
人类皮肤黑色素瘤是一种恶性的皮肤肿瘤,在各种皮肤癌类型中发生率低,但死亡率高。尽管目前人类对于晚期黑色素瘤的探索已经在分子分型以及免疫治疗等方面取得了重大突破,在全球范围内发表的探索性科研成果也日益增多,但患者短期内耐药复发的情况依旧不容乐观。由于黑色素瘤细胞具有较强的侵袭和迁移能力,因此能够快速扩散,且治疗后易复发,其根本原因在于靶向杀伤黑色素瘤细胞的相关调控机制尚未清晰,制约了防治的进程[1]。随着相关研究的不断深入,人们发现PI3K-AKT-mTOR信号转导途径在肿瘤的产生和发展过程中地位显著[24-25]。mTOR作为平衡细胞生长的重要调节因子,在维持细胞生理状态和应对外部环境压力的过程中起着至关重要的作用,mTOR的抑制剂可以通过mTOR相关信号通路对肿瘤细胞的生长发挥调控作用[26]。因此雷帕霉素已被视为抑制细胞过度增殖甚至逆转癌变的关键[27-29]。据报道,雷帕霉素及其衍生物具有抗肿瘤特性,其机制包括抑制肿瘤生长和抗血管生成[30-32]。体内或体外研究显示雷帕霉素对乳腺癌、胰腺癌、小细胞肺癌、肝癌等的生长有剂量依赖性影响。本研究成功构建小鼠黑色素瘤细胞肝转移模型,发现雷帕霉素组小鼠肝转移瘤的大小和数量明显少于空白对照组,提示雷帕霉素在小动物水平上可以抑制黑色素瘤细胞B16-F10的肝转移过程,这与雷帕霉素的抗血管生成作用相关。为了进一步检测该药处理后肿瘤相关生物学特性(迁移、侵袭、增殖、凋亡等)的改变,本研究进行了细胞实验,应用不同浓度的雷帕霉素处理黑色素瘤细胞,发现雷帕霉素有抑制黑色素瘤细胞增殖、迁移、侵袭及促进凋亡的作用。至此,从体内实验与体外试验两个方面证明了预测:mTOR信号通路抑制剂雷帕霉素能够抑制黑色素瘤细胞的增殖、迁移和侵袭,促进凋亡,进而能在黑色素瘤肝转移过程中发挥抑制作用。
本研究只初步鉴定了雷帕霉素能够在细胞水平上抑制黑色素瘤细胞的增殖、迁移、侵袭及凋亡能力,而对其在分子水平上是如何调控黑色素瘤细胞迁移及转移的机制尚未阐明。下一步研究将探寻黑色素瘤细胞增殖、迁移、侵袭及凋亡能力的改变是由于哪些信号分子改变引起的。对于mTOR信号通路不断的深入研究和mTOR特异性抑制剂的持续研发,将为临床黑色素瘤患者提供一种新的治疗途径,具有一定的转化医学价值。
——雷帕霉素