黄芪多糖对实验性自身免疫性脑脊髓炎小鼠脾细胞的免疫调节作用研究①
刘建春 张红珍 李俊莲 樊慧杰 柴 智 尉杰忠 于婧文 肖保国 马存根⑤
(山西中医药大学神经生物学研究中心,晋中030619)
多发性硬化(multiple sclerosis,MS)是一种主要发生于青壮年人的中枢神经系统(central nervous system,CNS)的慢性、进展性、致残性的自身免疫性疾病。氧化应激、炎症加重和随后引发的髓鞘脱失、神经元变性是MS的重要特征[1-2]。近年来,据MS国际基金会的统计在全球范围内约有300万MS患者,且发病率有逐年上升的趋势。西医治疗MS多采用抗炎和免疫调节等方法,但预后差,且药物价格昂贵,需长期使用,带来的副作用也将日趋加重,这给患者的家庭和社会带来了巨大的精神和经济压力[3]。因此,有效防治神经炎症病变MS的社会需求越来越迫切。
在延缓MS疾病进程方面,中医药与西药相比,具有辨证论治、整体调节等特点,理应在MS的预防和治疗中发挥其独特优势[4]。中医学,根据临床表现不同,分别归属“痿证”“内障”“眩晕”等不同的病名。辨证分型中临床常见证型之一是气虚血瘀证,依据病机辨证论治,治疗则应以补气活血兼以祛瘀通络为主[5-6]。
山西省道地药材之一黄芪,在古代医书中有“补药之长”的美誉,具有补气升阳、生津养血等功效。药理研究发现,黄芪中的主要有效成分黄芪多糖(astragalus polysaccharides,APS),具有增强免疫、抗氧化、抗炎、抗衰老等多种作用,能够有效治疗和改善多种神经系统相关疾病及神经损伤的症状[7]。本研究发挥中医药优势,应用APS干预免疫后第9天多发性硬化实验动物模型——实验性自身免疫性脑 脊 髓 炎(experimental allergic encephalomyelitis,EAE)小鼠的脾细胞,探讨APS对致脑炎症脾细胞的免疫调节作用及机制,以期为临床开发和应用APS治疗多发性硬化等神经系统变性疾病提供药理学理论基础。
1 材料与方法
1.1 材料
1.1.1 实验动物8~10周龄SPF级C57BL/6雌性小鼠,实验前小鼠自由饮食喂养1周。
1.1.2 试剂APS(上海爱必信生物科技有限公司);小鼠髓鞘少突胶质细胞糖蛋白多肽35-55(myelin oligodendrocyte glycoproten,MOG35-55,上海强耀生物科技有限公司);百日咳毒素(pertussis toxin,PTX,Sigma公司);结核分枝杆菌(tuberculosis mycobacter ium,TB,Becton Dickinson公司);完全弗氏佐剂(complete freund's adjuvant,CFA,Alexis公司);流式抗体LAP(TGF-β)Antibody、PE Anti-mouse CD25 Antibody、PE Anti-mouse-IL-12、FITC Anti-mouse CD4 Antibody(Biolegend公 司);Flour-488-CD11b、PE-CD16/32和PE-CD206(Becton Dick-inson公司);IFN-γ、IL-12及IL-10 ELISA试剂盒(R&D公司);荧光素染料(carboxyfluoresceinsuccinimidyl amino ester,CFSE,碧云天公司);Cell Counting Kit-8(CCK-8)试剂盒(Dojindo公司);DMEM高糖培养基(Gibco公司);胎牛血清(HyClone公司)。
1.1.3 仪器CO2培养箱及全波长酶标仪(Thermo公司);多用途低温高速离心机(德国Eppendorf公司);FACS Calibur流式细胞仪(BD公司)。
1.2 方法
1.2.1 EAE小鼠模型制备MOG35-55抗原乳剂的配制和注射的方法均严格按照文献[8]进行。用生理盐水配制MOG35-55水剂,在完全弗氏佐剂中加入TB配制油剂,将水剂和油剂按等体积的比例混合,反复抽推混合液制备油包水样抗原混悬液。在每只小鼠腰骶膨大处脊柱两侧皮下分4点注射抗原乳剂0.1 ml,将注射的当天记为免疫后的第0天。于免疫的当天和48 h后,每只小鼠腹腔注射PTX 300 ng以增强小鼠的免疫应答[9]。
1.2.2 取材及脾细胞制备 在免疫后的第9天,麻醉小鼠,无菌操作条件下剪开腹部,取出脾,然后放入预冷的DMEM高糖培养液中,在超净工作台中采用注射器针芯研磨脾脏,直至组织发白,过滤后,1 500 r/min离心10 min,倒掉上清液,重悬细胞,加入灭菌的双蒸水4 ml,45 s后加入2 ml 2.7%NaCl溶液恢复到等渗状态,去除破碎的细胞膜,1 500 r/min离心10 min后,倒掉上清,拍打重悬细胞,制备成单个核细胞的悬液,细胞计数后备用。
1.2.3 脾细胞培养 实验分3组:EAE组、APS低剂量组及APS高剂量组。每组取2个50 ml离心管向其中加入含相同数量脾细胞(5×106个/ml)的完全培养液5 ml,加入MOG35-55,使其含量为10 μg/ml。APS低剂量组、APS高剂量组加入相同体积相应浓度的APS,使其终浓度分别为0.1 mg/ml、0.2 mg/ml,EAE组加入相同体积的PBS,37℃、5%CO2培养箱常规培养48 h,收集上述细胞及上清液。
1.2.4 流式细胞术检测脾中T淋巴细胞及巨噬细胞表型的表达 将EAE组、APS低剂量组及APS高剂量组收集的脾细胞悬浮于1% BSA中,分装于流式管中,每管50 μl,分别加相应的流式抗体,室温避光20 min。PBS洗涤2次各加400 μl PBS,用流式细胞仪检测CD4+CD25+、CD4+TGF-β+、CD4+IFN-γ+、CD11b+CD206+及CD11b+CD16/32+细胞的变化。
1.2.5 ELISA法测定脾上清中IL-10、IL-12、IFN-γ的水平 取EAE组、APS低剂量组及APS高剂量组收集的脾细胞上清液,按照ELISA试剂盒说明书操作,用酶标仪检测各组细胞上清液中IL-10、IL-12和IFN-γ的吸光度值,根据直线回归方程计算所测细胞因子的含量。
1.2.6 CCK-8检测细胞增殖 分别取EAE组、APS低剂量组及APS高剂量组培养48 h后的脾细胞悬液铺96孔板,每组设3个复孔,每孔加样量为100 μl。按照说明书,在每孔加入10 μl CCK-8溶液,在37℃培养箱内孵育4 h。用酶标仪检测在450 nm处的吸光度值。
1.2.7 CFSE检测细胞增殖 从制备好的单个核脾细胞悬液中取出含6×106个的脾细胞悬液置于4 ml离心管中,2 000 r/min离心5 min,弃上清,PBS洗涤3次,加入2 ml PBS重悬细胞,用CFSE标记,置于37℃、5%CO2培养箱中培养15 min,然后加入等体积胎牛血清终止反应,1 500 r/min离心5 min,PBS洗涤2次,加入含10 μg/ml MOG35-55的完全培养液2 ml重悬细胞。铺96孔板,分EAE组、APS低剂量组及APS高剂量组,每组3个复孔,每孔加200 μl。EAE组加PBS,APS低剂量组、APS高剂量组加APS,使其终浓度分别为0.1 mg/ml、0.2 mg/ml。置于37℃、5%CO2培养箱中培养72 h,上流式细胞仪检测CFSE的荧光强度。
1.3 统计学分析 采用Graph Pad Prism 5.0统计分析软件进行相关数据处理,计量数据用±s表示,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 APS对CD4+T细胞亚群及巨噬细胞表型表达的影响 与EAE组比较,APS高剂量、低剂量均可上调CD25+、TGF-β+的CD4+T细胞的表达(P<0.001,P<0.05);APS高剂量可下调IL-12+的CD4+T细胞的表达(P<0.01),APS低剂量也下调IL-12+的CD4+T细胞的表达,但无统计学意义(图1)。与EAE组相比,APS低剂量可显著增加M2型巨噬细胞表面标志CD206的表达(P<0.001),APS高、低剂量均可显著抑制M1型巨噬细胞表面标志CD16/32+的表达(P<0.001,图2)。

图1 APS调节CD4+T细胞比例Fig.1 APS regulated polarization of CD4+T cells
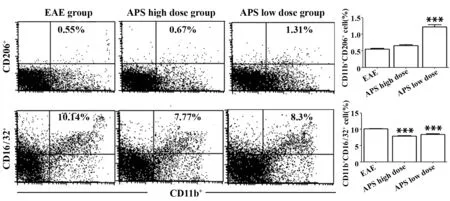
图2 APS调节脾中M1型和M2型巨噬细胞比例Fig.2 APS regulate proportion of M1 and M2 macrophages in spleen
2.2 APS对脾上清中细胞因子表达水平的影响 与EAE组比较,APS低剂量可使脾细胞上清液中IL-10分泌增高,IL-12分泌降低(P<0.05);APS高剂量有使IL-12、IFN-γ分泌降低,IL-10分泌增加的趋势(图3)。
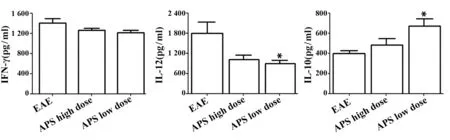
图3 APS对脾上清中细胞因子表达水平的影响Fig.3 Effect of APS on cytokine expression in spleen supernatant
2.3 APS对脾细胞增殖率的影响 分别用CCK-8法和CFSE法检测APS对脾细胞增殖率的影响,结果显示,与EAE组比较,APS高、低剂量均可使脾细胞增殖率明显上升(P<0.01,P<0.001,图4)。
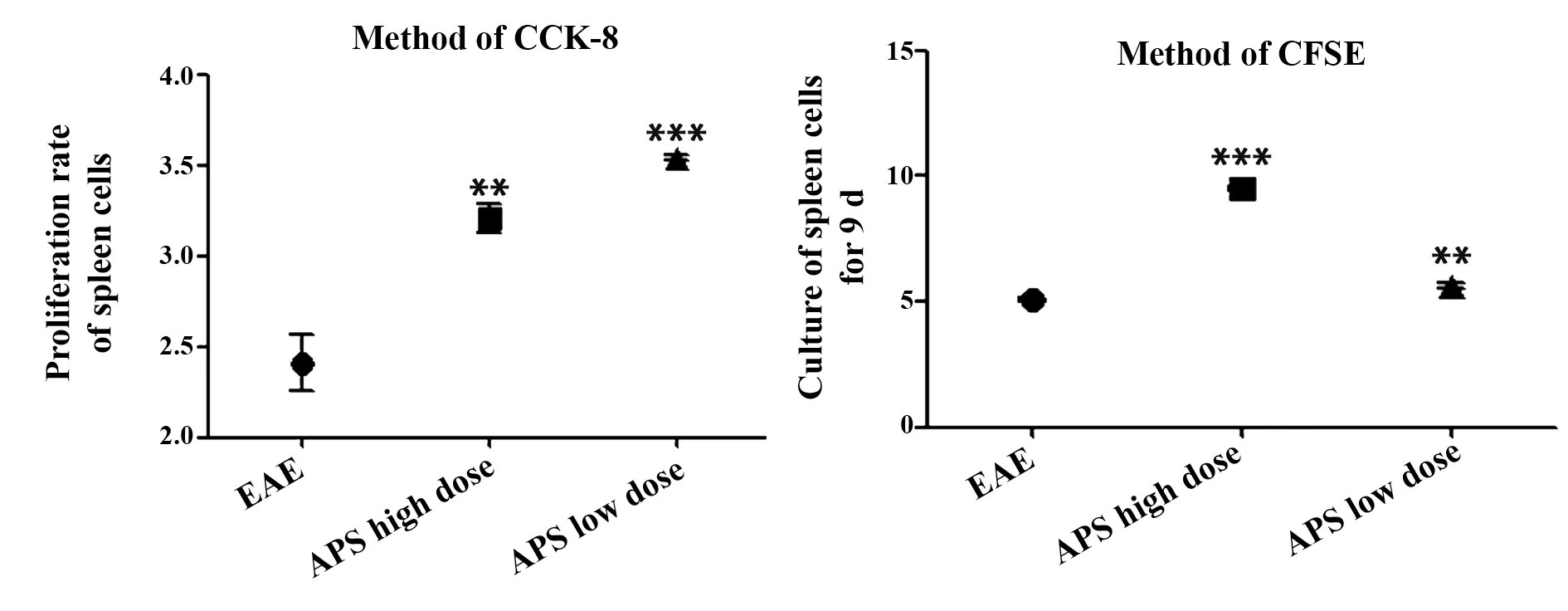
图4 APS对脾细胞增殖率的影响Fig.4 Effect of APS on proliferation rate of spleen cells
3 讨论
MS是一种自身免疫性疾病。免疫失衡是MS最主要的发病机制[10-11]。由于免疫紊乱,反应性T细胞,特别是CD4+T细胞进入中枢神经系统,通过释放细胞因子如IL-6、IL-1β等,趋化B淋巴细胞和巨噬细胞,B淋巴细胞分泌抗体标记在髓鞘上,巨噬细胞利用抗体标志吞噬摧毁少突胶质细胞,导致髓鞘脱失,这种免疫攻击是发作式的,长期下去,轴突变性,中断神经元之间的交流,最终导致认知、运动等障碍[12-13]。
在MS/EAE中,中枢神经系统炎症浸润主要由反应性T细胞和活化的巨噬细胞引起。脾是两种细胞的蓄水池,它们首先在脾中被激活和增殖。随后,通过血循环进入脊髓[14]。初始CD4+T细胞在受到抗原的刺激后,在不同的条件下可分化成Th1、Th2和调节性T细胞(Treg)等不同的亚群,分泌不同的细胞因子,执行不同的功能[15]。Th1细胞主要分泌IFN-γ,TNF-α,IL-12,介导针对细胞内病原微生物的细胞免疫,被称为炎症T细胞,IFN-γ,IL-12促进Th1分化,而IL-4、IL-10和TGF-β抑制Th1分化。在EAE中,Th1细胞在CNS内通过促进炎症介质的释放,诱发脱髓鞘,使EAE加重。Th2细胞可通过分泌IL-4、IL-5、IL-13,促进机体的体液免疫。Th2细胞有拮抗Th1细胞的作用,呈现出与免疫调节、减轻炎症反应相关的作用,在EAE的脱髓鞘病变过程中发挥保护作用[16-18]。Th1/Th2细胞间的动态平衡可能在MS疾病转归过程中起着重要的作用。实验研究采用体内注射MOG35-55后第9天获得一群致脑炎症脾细胞,在细胞水平上研究APS的免疫调节作用。结果表明,APS能显著增加CD25+、TGF-β+的CD4+T细胞亚群的比例,下调IL-12+的CD4+T细胞的表达,使脾细胞上清液中IL-10分泌增高,IL-12分泌降低,表明APS可以调节Th1和Th2细胞介导的免疫再平衡。
巨噬细胞来源于血液中的单核细胞,在维持组织器官内环境稳态,抗病原体感染等方面起着重要的作用[19]。巨噬细胞在生理和病理条件下均表现出极大的异质性。在不同的微环境下可极化为M1型和M2型[20]。M1型巨噬细胞可分泌大量炎症介质IL-1β、IFN-γ、TNF-α以促进继发性损伤过程[21-22];而M2型巨噬细胞通过分泌抗炎因子IL-10、IL-13和TGF-β等对抗受损区域的炎症反应,重新建立稳态,同时可产生一系列生长因子,促进少突胶质细胞损伤后的髓鞘修复[23-25]。可见,巨噬细胞的极性对EAE疾病的改善或进展具有很大的影响。实验发现,APS可显著抑制M1型巨噬细胞表面标志CD16/32+的表达,增加M2型巨噬细胞表面标志CD206+的表达,使M1型向M2型转化,改善EAE的炎症反应的微环境。
综上所述,APS对致脑炎症脾细胞可通过调节抗炎和致炎免疫细胞的比例,调整细胞因子的含量,发挥免疫调节作用,提示APS具有治疗EAE的潜能。