基于JAK/STAT通路EFhD2蛋白对肺癌大鼠T淋巴细胞免疫功能的调节作用研究①
翟占强 江立群 朱 佳 张典钿 汤灵玲(浙江省荣军医院胸部疾病诊疗中心,嘉兴314000)
肺癌是呼吸系统常见恶性肿瘤,近年来随着环境恶化发病率不断升高,已成为21世纪严重威胁人类生命健康的疾病[1]。目前肺癌起病隐匿,早期症状不典型,患者确诊时多数已致中晚期,手术及放化疗效果不佳,治疗期间器官功能受损、肿瘤耐药等不良反应导致病死率居高不下[2-3]。因此,探讨肺癌发生发展机制,寻找有效治疗靶点提高机体免疫力、抑制肿瘤生长有积极意义。螺旋-环-螺旋拓扑结构域蛋白D2(helix-loop-helix topology protein D2,EFhD2)又称Swiprosin-1,主要存在于人淋巴细胞、B细胞及其他免疫细胞[4]。近年来研究表明,EFhD2在免疫细胞激活、细胞毒作用、癌细胞增殖及迁移等多种生物学活动中发挥重要调控作用,但具体调控机制不明[5]。为此,本研究通过建立大鼠肺癌模型,观察抑制或激活EFhD2蛋白的表达对肺癌大鼠T淋巴细胞免疫功能的调控作用,并探讨其调控机制,为临床中肺癌靶向治疗提供参考依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 清洁级Wistar大鼠,75只,雌雄各37只、38只,8周龄,体重(180±20)g,购自北京华阜康生物科技股份有限公司,生产许可证号SCXK(京)2019-0008,使用许可证号SYXK(京)2019-0022。饲养于12 h/12 h明暗交替、60%湿度、23~25℃温度条件下,自由进食和饮水,实验开展前适应性饲养1周,实验过程中符合减少、替代和优化的3R原则。实验动物伦理审批号:IACUC-20190101-02。
1.1.2 主要试剂与仪器 含EFhD2基因短发卡样RNA(shRNA-EFhD2)和模拟物RNA(mimic-EFhD2)的重组腺病毒载体(病毒滴度1×1010PFU/ml,由上海英骏生物技术有限公司测序及病毒包装);三甲基胆蒽、二乙基亚硝胺(美国Sigma公司);碘化油注射液(烟台鲁银药业有限公司,国药准字H37022398,规格10 ml);CD3+、CD4+、CD8+细胞检测试剂盒(杭州安捷伦生物有限公司);兔抗大鼠EFhD2、Janus激酶2(Janus kinase 2,JAK2)、磷酸化JAK2(phosphorylated JAK2,p-JAK2)、信号转导与转录激活子3(signal transduction and transcription activator 3,STAT3)、p-STAT3单抗(美国Abcam公司);辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔二抗(美国Thermo Fisher公司);FACSCalibur分析型流式细胞仪(美国BD公司)。
1.2 方法
1.2.1 肺癌模型建立75只大鼠随机取60只采用气管内灌注致癌碘油液法建立大鼠肺癌模型,参考文献[6]肺癌模型建立大鼠肺癌模型:造模前3 d肌注2万单位青霉素、50 mg链霉素预防肺部感染;60只Wister大鼠腹腔注射戊巴比妥那麻醉后,仰卧位固定于手术台,额镜直视下左肺支气管灌注0.1 ml致癌碘油液(1.2 g三甲基胆蒽、1.6 ml二乙基亚硝胺与6.4 ml碘油混合后取0.1 ml),对照组同法灌注0.1 ml碘油。灌注结束后分笼饲养,自由进食和饮水。
1.2.2 分组及干预 大鼠灌注成功后随机分为模型 组、sh-EFhD2组、EFhD2组、EFhD2-AG490组,15只/组。其余15只大鼠采用同法灌注碘油,设为对照组。灌注成功后次日开始干预:sh-EFhD2组、EFhD2组分别尾静脉注射shRNA-EFhD2、mimic-EFhD2重组腺病毒载体(病毒滴度1×1010PFU/ml)100 μl,10 min后尾静脉注射100 μl生理盐水;EFhD2-AG490组尾静脉注射100 μl mimic-EFhD2重组腺病毒载体后10 min,尾静脉注射0.25 mg JAK2抑制剂AG490 100 μl;模型组和对照组尾静脉注射等量生理盐水;每周干预1次,共干预8周。干预期间观察大鼠一般情况。本研究所有大鼠均进行病理组织学检查明确肺癌建模成功,未建模成功大鼠予以剔除。
1.2.3 外周血T淋巴细胞亚群检测 末次干预后24 h,2%戊巴比妥那腹腔麻醉各组大鼠,腹主动脉采 血1 ml,取50 μl抗 凝 血,加 入 含10 μl CD3+、CD4+、CD8+单抗的离心管中,冰上孵育30 min,加入红细胞裂解液,混匀,避光冰上继续孵育10 min,加入PBS洗涤3次,3 000 r/min离心8 min,取沉淀,用2%多聚甲醛固定,PBS重悬后,1 h内采用流式细胞分析仪分析T淋巴细胞亚群CD3+、CD4+、CD8+占比,并计算CD4+/CD8+。
1.2.4肺指数、脾脏指数计算及组织取材 各组于采血前称取体重,采血结束后立即脱颈处死,解剖大鼠取肺、脾脏,以组织质量/体重为肺指数和脾脏指数。各组取5只大鼠肺肿瘤组织置于10%中性甲醛固定备用,另取5只大鼠肺肿瘤组织置于-80℃保存备用。
1.2.5 肺组织病理观察 取置于10%中性甲醛固定24 h的肺肿瘤组织,梯度乙醇脱水、二甲苯固定后,进行石蜡包埋及常规连续切片(厚度为5 μm),进行常规HE染色,中性树胶封片后于光学显微镜下观察肺组织病变情况。
1.2.6 EFhD2、JAK2、p-JAK2、STAT3、p-STAT3蛋白表达量检测 取保存于-80℃的肺肿瘤组织约50 mg,加入液氮研磨,转移至离心管,加入1 ml细胞裂解液,冰上孵育25 min,12 000 r/min离心15 min,离心半径为10 cm,取上清液进行BCA蛋白定量;取40 μg待测蛋白与等量上样缓冲液混匀,沸水浴8 min使蛋白变性,再次离心后取上清液,进行SDS-聚丙烯酰氨凝胶电泳,电转仪将蛋白转印至硝酸纤维素膜,将膜置于5%脱脂奶粉中室温封闭2 h,TBST洗涤10 min×3次,加入封闭液稀释一抗[EFhD2(1∶500),JAK2、p-JAK2(1∶300),STAT3、p-STAT3(1∶500)],4℃孵育过夜,TBST洗涤10 min×3次,加入封闭液稀释的HRP标记的二抗(1∶5 000),室温继续孵育1 h,于暗室中曝光、显影,各条带扫描拍照后,采用图像分析软件Image J软件进行灰度值分析,目的蛋白相对表达量=目的蛋白灰度值/β-actin灰度值。
1.3 统计学处理 采用SPSS21.0统计软件分析数据,计量资料以±s表示,多样本资料比较采用单因素方差分析,两样本比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 大鼠造模一般情况观察 对照组大鼠试验期间进食、饮水、活动等一般情况均正常;模型组于建模次日开始进食、饮水减少,喜卧、毛发无光泽等表现,随时间延长逐渐出现呼吸加快、咳嗽增多并伴呼吸困难;EFhD2组上述症状和体征较模型组更为严重,至实验结束时多数处于垂死状态;sh-EFhD2组上述症状和体征较模型组明显减轻;EFhD2-AG490组上述症状和体征较模型组严重,但较EFhD2组减轻。
2.2 肺组织病理形态观察 模型组、sh-EFhD2组、EFhD2组、EFhD2-AG490组各有13、10、15、11只诱发肺鳞状细胞癌,纳入后续实验。模型组剩余2只为非典型增生,sh-EFhD2组剩余3只非典型增生、2只增生,EFhD2-AG490组剩余3只均非典型增生,1只增生。
对照组大鼠肺组织结构正常,未见明显病变;模型组支气管黏膜上皮细胞磷状化生,肿瘤细胞排列紊乱,伴有较多炎症细胞浸润;sh-EFhD2组较模型组明显减轻;EFhD2组上述病变较模型组更为严重,伴有肺泡囊扩张,气管黏膜充血,组织肿胀等;EFhD2-AG490组上述病变较EFhD2组减轻。见图1。

图1 肺组织病理学染色(HE,×400,n=5)Fig.1 Pathological staining of lung histopathology(HE,×400,n=5)
2.3 外周血T淋巴细胞亚群CD3+、CD4+、CD8+占比及CD4+/CD8+比较 外周血T淋巴细胞亚群CD3+、CD4+、CD8+占比及CD4+/CD8+组间比较差异有统计学意义(P<0.05)。与对照组相比,模型组、sh-EFhD2组、EFhD2组及EFhD2-AG490组CD3+、CD4+占比及CD4+/CD8+均降低,且CD3+、CD4+占比EFhD2组<EFhD2-AG490组<模型组<sh-EFhD2组,CD4+/CD8+EFhD2组<模型组和EFhD2-AG490组<sh-EFhD2组,差异均有统计学意义(P<0.05);与对照组相 比,模 型 组、sh-EFhD2组、EFhD2组 及EFhD2-AG490组CD8+占比升高,且EFhD2组>模型组和EFhD2-AG490组>sh-EFhD2组,差异均有统计学意义(P<0.05)。见表1。
表1 外周血T淋巴细胞亚群CD3+、CD4+、CD8+占比及CD4+/CD8+比较(±s,%)Tab.1 Comparison of peripheral blood T lymphocyte subsets CD3+,CD4+,CD8+ratio and CD4+/CD8+(±s,%)

表1 外周血T淋巴细胞亚群CD3+、CD4+、CD8+占比及CD4+/CD8+比较(±s,%)Tab.1 Comparison of peripheral blood T lymphocyte subsets CD3+,CD4+,CD8+ratio and CD4+/CD8+(±s,%)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05;compared with sh-EFhD2 group,3)P<0.05;compared with EFhD2 group,4)P<0.05.
Groups Control Model sh-EFhD2 EFhD2 EFhD2-AG490 n 15 13 10 15 11 CD3+64.16±2.90 48.30±1.781)57.24±2.211)2)43.02±2.351)2)3)46.37±2.621)2)3)4)CD4+45.80±2.11 31.25±1.801)40.71±2.321)2)27.20±2.071)2)3)29.44±1.951)2)3)4)CD8+21.33±2.35 30.06±2.171)25.69±2.101)2)32.87±2.821)2)3)30.44±2.921)3)4)CD4+/CD8+2.15±0.13 1.04±0.091)1.58±0.111)2)0.83±0.091)2)3)0.97±0.101)3)4)
2.4 肺指数、脾脏指数比较 肺指数、脾脏指数组间比较差异有统计学意义(P<0.05)。与对照组相比,模型组、sh-EFhD2组、EFhD2组及EFhD2-AG490组肺指数较高,且EFhD2组>模型组和EFhD2-AG490组>sh-EFhD2组,差异均有统计学意义(P<0.05);与对照组相比,模型组、sh-EFhD2组、EFhD2组及EFhD2-AG490组脾脏指数较低,且EFhD2组<模型组和EFhD2-AG490组<sh-EFhD2组,差异均有统计学意义(P<0.05)。见表2。
表2 肺指数、脾脏指数比较(±s,mg/g)Tab.2 Comparison of lung index and spleen index(±s,mg/g)
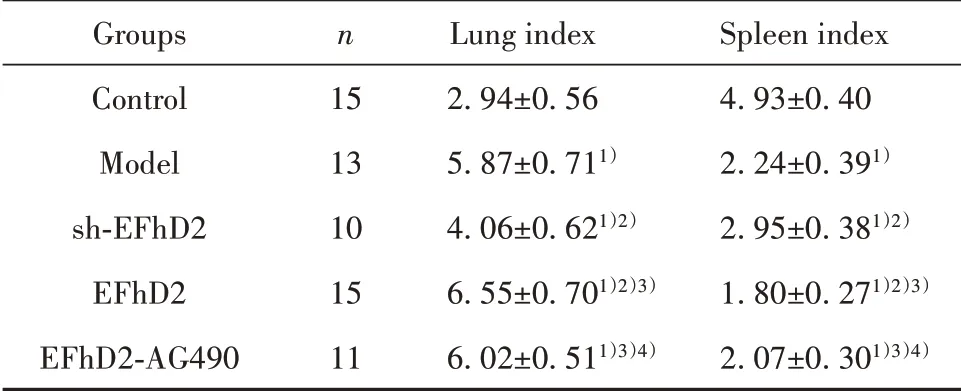
表2 肺指数、脾脏指数比较(±s,mg/g)Tab.2 Comparison of lung index and spleen index(±s,mg/g)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05;compared with sh-EFhD2 group,3)P<0.05;compared with EFhD2 group,4)P<0.05.
Groups Control Model sh-EFhD2 EFhD2 EFhD2-AG490 n 15 13 10 15 11 Lung index 2.94±0.56 5.87±0.711)4.06±0.621)2)6.55±0.701)2)3)6.02±0.511)3)4)Spleen index 4.93±0.40 2.24±0.391)2.95±0.381)2)1.80±0.271)2)3)2.07±0.301)3)4)
2.5 肺 组 织EFhD2、JAK2、p-JAK2、STAT3、p-STAT3蛋白相对表达量比较 肺组织EFhD2、p-JAK2、p-STAT3蛋白相对表达量组间比较差异有统计学意义(P<0.05);JAK2、STAT3蛋白相对表达量组间比较差异无统计学意义(P>0.05)。与对照组相比,模 型组、sh-EFhD2组、EFhD2组及EFhD2-AG490组EFhD2、p-JAK2、p-STAT3蛋白相对表达量均升高,且EFhD2组>EFhD2-AG490组>模型组>sh-EFhD2组,差异均有统计学意义(P<0.05)。见图2。
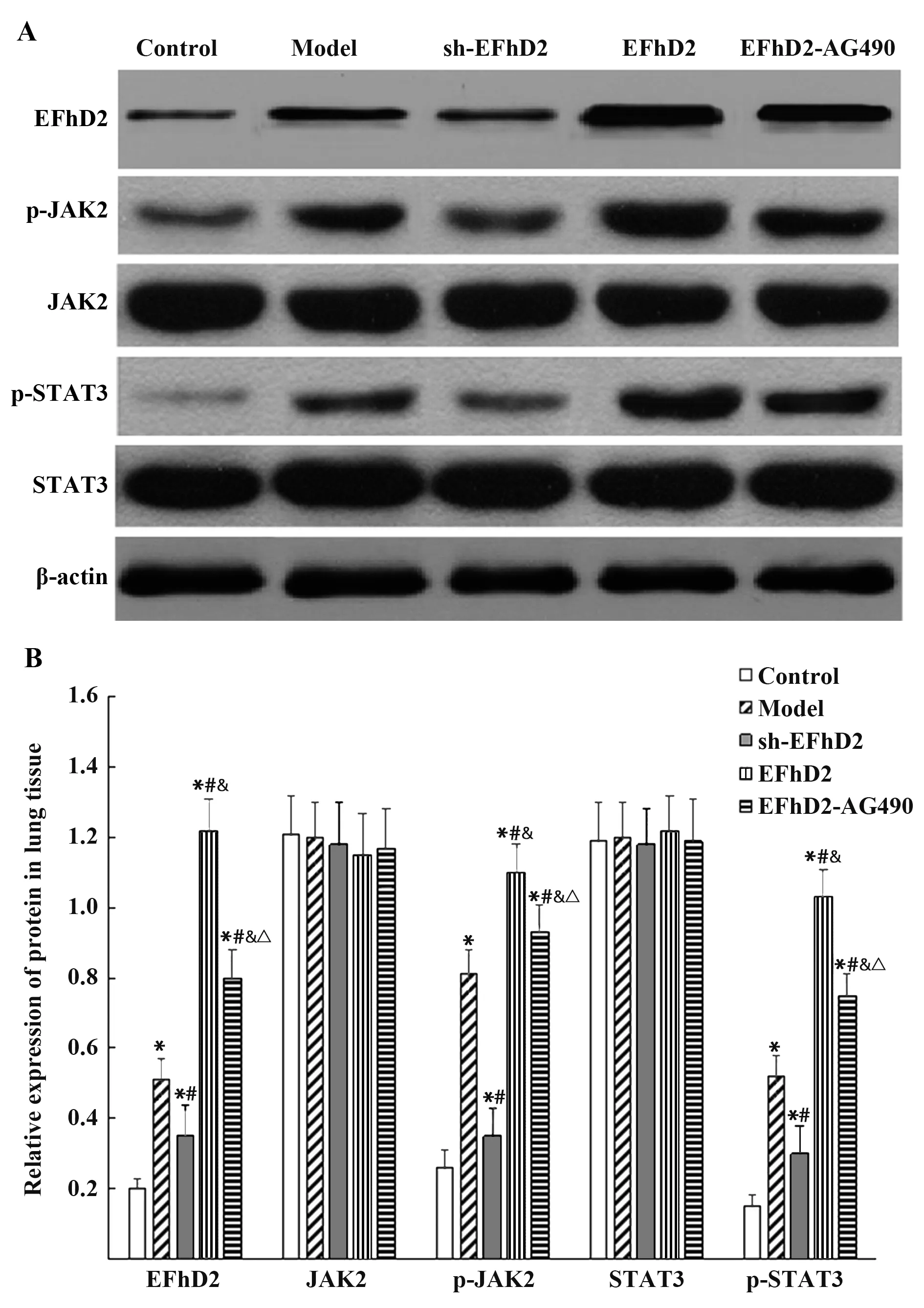
图2 肺组织EFhD2、JAK2、p-JAK2、STAT3、p-STAT3蛋白表达情况(±s,n=5)Fig.2 Lung tissue EFhD2,JAK2,p-JAK2,STAT3,p-STAT3 protein expressions(±s,n=5)
3 讨论
肺癌发病因素较多,与年龄、环境暴露或肿瘤家族史等因素关系密切,随着我国肺癌发病率和病死率的升高,对人们的健康危害逐渐加大,肺癌已被列为我国重点防治的癌症之一[7-8]。近年来,尽管手术及放化疗综合治疗手段已有长足进步,肺癌治疗成功率有所提升,但仍有部分患者长期预后不佳,寻找新的治疗靶点有重要临床意义。动物实验研究表明,注射过表达EFhD2的黑色素瘤B16F10细胞小鼠肺结节数量和大小较对照组增多,而注射低表达EFhD2基因的B16F10细胞小鼠肺结节数量和大小较对照组显著减少[9],提示EFhD2基因下调有助于抗肿瘤,但对EFhD2在抗肿瘤过程中作用的机制研究尚少。
本研究显示,模型组支气管黏膜上皮细胞磷状化生,伴有较多炎症细胞浸润,模型组外周血CD3+、CD4+占比、CD4+/CD8+及脾脏指数较对照组降低,CD8+占比及肺指数升高(P<0.05),说明大鼠肺癌建模成功,且存在明显免疫功能紊乱现象。本研究分别应用低表达和过表达EFhD2的重组腺病毒载体干预后,sh-EFhD2组外周血CD3+、CD4+占比、CD4+/CD8+及脾脏指数升高,CD8+占比及肺指数降低(P<0.05),而EFhD2组上述指标较模型组更为严重,说明低表达EFhD2可有效改善肺癌大鼠机体免疫功能。机体免疫反应的激活受体或抑制受体对体内外信号均有反应,免疫细胞通过调控大量基因表达,导致细胞因子、组织重塑酶等大量表达[10-11]。研究显示,EFhD2在单核细胞系、小胶质细胞等细胞中均有表达,外源性刺激单核细胞可增强其抗原递呈能力,进而增强CD8+免疫应答反应[12]。KIM等[13]研究显示,多种免疫细胞中,EFhD2在CD8+T细胞中表达量最高,EFhD2可能通过调节抗原激发T细胞活化的晚期发挥免疫调控作用。
本研究显示,模型组大鼠肺组织EFhD2、p-JAK2、p-STAT3蛋白相对表达量均升高,提示肺癌大鼠JAK2/STAT3信号通路激活,与WANG等[14]的研究结果一致。本研究进一步应用低表达和过表达EFhD2的重组腺病毒载体干预后,sh-EFhD2组EFhD2、p-JAK2、p-STAT3蛋白降低,EFhD2组较模型组更高(P<0.05),提示抑制EFhD2表达可抑制JAK2/STAT3通路蛋白磷酸化激活;而应用JAK2通路抑制剂AG490干预后,EFhD2及JAK2/STAT3信号通路较EFhD2组降低,且机体免疫功能得到改善,提示EFhd2可能通过JAK2/STAT3信号通路发挥调控机体免疫功能的作用。JAK/STAT信号通路在多种肿瘤中被激活,参与肿瘤发生、发展等生物学过程,是目前研究的热点肿瘤信号传导通路[15-16]。研究表明,JAK/STAT信号通路与癌细胞免疫逃避关系密切,STAT高表达可抑制机体免疫系统对癌细胞的应答,从而介导机体先天性或获得性免疫反应[17-18]。LIU等[19]研究表明,抑制JAK2/STAT3信号通路可通过降低肿瘤微环境中的髓源性抑制细胞抑制癌细胞免疫逃逸作用,从而减少肿瘤血管生成,发挥抗肿瘤作用。上述研究均说明JAK2/STAT3信号通路在介导肿瘤免疫逃逸过程中发挥重要作用。ZHANG等[20]研究显示,EFhD2可通过调节巨噬细胞γ-干扰素受体的表达调控JAK2/STAT3信号通路的激活,从而在脓毒症巨噬细胞免疫反应中发挥调控作用,与本研究中EFhD2参与肺癌大鼠免疫功能的调控机制相符,而本研究进一步采用JAK2通路抑制剂开展挽回实验,验证了本研究的结论,提示EFhD2可能通过JAK2/STAT3信号通路发挥调控机体免疫功能的作用。
综上所述,抑制EFhD2蛋白表达可增强肺癌大鼠T淋巴细胞免疫功能,可能通过抑制JAK2、STAT3蛋白磷酸化发挥调控作用,为临床中肺癌细胞免疫反应的调节提供了潜在的治疗靶点。