沉默GRP78表达增强HOS细胞对MPPα-PDT敏感性的研究①
左 强 欧云生 余浩洋 钟申熹 张木子(重庆医科大学附属第一医院骨科,重庆400016)
骨肉瘤是青少年常见的骨原发恶性肿瘤之一,伴随着医疗技术的进步及新辅助治疗出现,患者的总体生存率有所提高,但骨肉瘤复发和转移仍是治疗的难题[1-2]。光动力疗法(photodynamic therapy,PDT)作为一种治疗时间窗短、毒副反应小、可重复治疗的新型治疗恶性肿瘤的方法,已广泛运用于临床相关恶性肿瘤的治疗[3-4]。
葡萄糖调节蛋白78(glucose regulated protein 78,GRP78)是一种关键的内质网管腔内分子伴侣,具有强大的抗凋亡特性,在多种恶性肿瘤中高表达,与肿瘤的增殖和存活密切相关[5-7];此外,有研究表明,GRP78也是肿瘤细胞抗性的关键调节因子,与肿瘤的耐药、复发及转移密切相关[8-9]。在乳腺癌及结肠癌研究中发现,沉默GRP78表达可增强肿瘤细胞对放化疗的敏感性[10-11],但GRP78在PDT治疗骨肉瘤中的研究较少。本研究将运用siRNAGRP78干扰人骨肉瘤细胞HOS中GRP78的表达,并探讨其对焦脱镁叶绿酸-α甲酯介导的光动力疗法(MPPα-PDT)作用下HOS细胞增殖活性、凋亡水平及Wnt通路的影响。
1 材料与方法
1.1 材料
1.1.1 细胞与试剂 人骨肉瘤HOS细胞株购自中国科学院上海细胞库。焦脱镁叶绿酸-α甲酯(pyropheophorbide-α methyl ester,MPPα)购于美国Sigma公司;胎牛血清、高糖DMEM细胞培养基等均购自美国Gibco公司;胰蛋白酶、Lipo8000TM转染试剂及Hoechst凋亡试剂盒均购于上海碧云天生物技术有限公司;Annexin V-PI双染检测试剂盒购于江苏凯基生物技术股份有限公司;CCK-8试剂盒购自上海MedChemExpress公司;PCR引物由上海生物工程有限公司合成;RNA提取试剂购自北京天根生化科技有限公司;逆转录试剂盒购自上海东洋纺生物科技公司;PCR检测试剂盒购自美国应用生物系统公司;干扰GRP78基因(siRNA-GRP78)由上海汉恒生物科技有限公司合成,序列如下:正义链5'-CCAAAGACGCUGGAACUAUTT-3',反 义 链5'-AUAGUUCCAGCGUCUUUGGTT-3',siRNA阴性对 照,序列如下:正义链5'-UUCUCCGAACGUGUCACGUdTdT-3',反义链5'-ACGUGACACGUUCGGAGAAdTdT-3'。兔抗人GRP78多克隆抗体、兔抗人βactin多克隆抗体、辣根过氧化物酶标记的山羊抗兔抗体均购自中国武汉三鹰公司;兔抗人Cleaved-PARP、Cleaved-Caspase 3单克隆抗体均购自美国CST公司;兔抗人Ki67、兔抗人PCNA、兔抗人PKT、兔抗人GSK3β、兔抗人β-catenin多克隆抗体购自中国武汉赛维尔生物科技有限公司;兔抗人P-AKT、兔抗人P-GSK3β均购自中国博士德生物工程有限公司;Cy3标记的羊抗兔IgG购自北京博奥森生物技术有限公司。
1.1.2 仪器 光动力治疗仪购自重庆京渝激光生物研究所;流式细胞仪购自美国B&D Biosciences公司;倒置荧光显微镜、正置荧光显微镜均购自日本Nikon公司。
1.2 方法
1.2.1 人骨肉瘤HOS细胞的培养 人骨肉瘤HOS细胞株用含有0.1 mg/ml链霉素、100 U/ml青霉素与10%胎牛血清的高糖DMEM完全培养基培养,置于37℃、5%CO2的孵箱中避光培养,待细胞密度达60%~70%时,常规传代。
1.2.2 PDT处理HOS细胞 取对数生长期的人骨肉瘤HOS细胞,常规胰酶消化,按实验分组传代。待细胞生长密度为50%~60%时,避光加终浓度为0.15 μmol/L的光敏剂MPPα,继续避光培养20 h,经波长630 nm、40 mW/cm2的连续输出方式,光照120 s,继续在37℃、体积分数为5%CO2的培养箱中根据实验分组进行避光孵育[12]。
1.2.3 Hoechst染色检测细胞凋亡 取对数生长期的人骨肉瘤HOS细胞,常规胰酶消化,6孔板中按Control组、MPPα组、LED组、MPPα-PDT 24 h组分组。MPPα-PDT处理后,根据操作说明每孔加入Hoechst固 定 液 固 定15 min,PBS洗 净,每 孔 加 入Hoechst33342染料1 ml染色5 min,PBS洗净残余染料,倒置荧光显微镜观察各组细胞细胞核变化。
1.2.4 脂质体介导siRNA-GRP78转染HOS细胞取对数生长期的HOS细胞,接种于6孔板,分组如下:Control组、siRNA-NC组、siRNA-GRP78组,取15 ml离心管,每孔HOS细胞加入125 μl DMEM培养基,加入100 pmol siRNA,混匀,加入4 μl Lipo8000TM转染试剂,室温静置20 min,最后每孔加入125 μl上述混合液,轻轻摇匀,转染6 h,更换为完全培养基,72 h后可行下一步实验。
1.2.5 qPCR法检测GRP78 mRNA的表达水平细胞转染siRNA-GRP78 72 h后,Trizol法提取RNA,逆转录cDNA,采用10 μl上样体系依次上样,运用以下上机程序:95℃、30 s,共1个循环;90℃、5 s,60℃、30 s,65℃、5 s,共40个循环。以β-actin为内参,引物序列分别为:β-actin上游:5'-CTCCATCCTGGCCTCGCTGT-3',下游:5'-GCTGTCACCTTCACCGTTCC-3';GRP78上游:5'-CACGCCGTCCTATGTCGC-3',下 游:5'-AAATGTCTTTGTTTGCCCACC-3'。采用2-ΔΔCt法进行标准化,并计算GRP78基因mRNA的相对表达量。
1.2.6 CCK-8法检测细胞增殖活性 取对数生长期的细胞,按5 000个/孔接种于96孔板。分为Control组、siRNA-GRP78组、siRNA-GRP78+MPPα-PDT组及MPPα-PDT组,分别于处理后0 h、3 h、6 h、12 h、24 h检测HOS细胞增殖活性。根据CCK-8检测试剂盒操作说明按每孔加入10 μl CCK-8溶液和90 μl DMEM培养液混合液,孵育箱中反应1 h。用酶标仪于波长为450 nm处测定各孔的OD值。每组设置5个复孔,重复3次,取平均值计算各组细胞的存活率。细胞存活率(%)=(实验组平均OD值-调零孔OD值)/(空白组平均OD值-调零孔OD值)×100%。
1.2.7 Western blot检测GRP78蛋白、凋亡相关蛋白及Wnt通路相关蛋白表达 取对数生长期的骨肉瘤HOS细胞,按1.2.6中方法对细胞进行分组,行相关处理后提取细胞蛋白。BCA试剂盒检测蛋白浓度,Western blot检测相关蛋白(β-catenin、AKT、p-AKT、GSK3β、p-GSK3β)表达。Image Lab 5.2.1软件分析目的条带,以目标蛋白与β-actin灰度值比值作为目标蛋白相对表达量。
1.2.8 流式细胞术检测HOS骨肉瘤细胞凋亡率取对数生长期的HOS细胞,按1.2.6中方法对细胞进行分组,行相应处理后,PBS缓冲液洗3次,胰酶消化,离心,弃上清液,收集细胞沉淀,每组收集3个批次细胞样本,Annexin V-PI试剂双染,流式细胞仪检测凋亡率。
1.2.9 免疫荧光检测GRP78蛋白荧光强度 取对数生长期的HOS细胞,接种于6孔板中25 mm细胞爬片,按1.2.6中方法对细胞进行分组,按1.2.1中方法相应处理,继续避光孵育12 h。4%多聚甲醛固定细胞30 min,PBS洗3次,0.1%TritonX-100破膜15 min,山羊抗兔血清封闭40 min,兔多克隆GRP78抗体稀释后(1∶100)4℃过夜孵育。避光条件下加入Cy3标记的羊抗兔IgG荧光二抗室温下孵育40 min,PBS洗3次,DAPI染核5 min,PBS洗净残余DAPI,封片,正置荧光显微镜观察。采用Image J 1.52e软件进行荧光强度分析。
1.3 统计学分析 采用SPSS23.0软件统计分析实验数据。每组实验均独立重复3次,数据用±s表示。组内两两比较采用t检验,多组间均数的比较采用方差分析;P<0.05表示差异有统计学意义。
2 结果
2.1 MPP α-PDT可诱导HOS细胞发生凋亡Hoechst凋亡染色(图1A)提示,与Control组、LED组、MPPα组相比,MPPα-PDT-24 h组中HOS细胞核可见高亮蓝色以及核碎裂、固缩等细胞凋亡形态学变化。流式细胞术(图1B、C)提示MPPα-PDT 3 h、6 h、12 h、24 h组中凋亡率随时间增加而升高(P<0.01)。
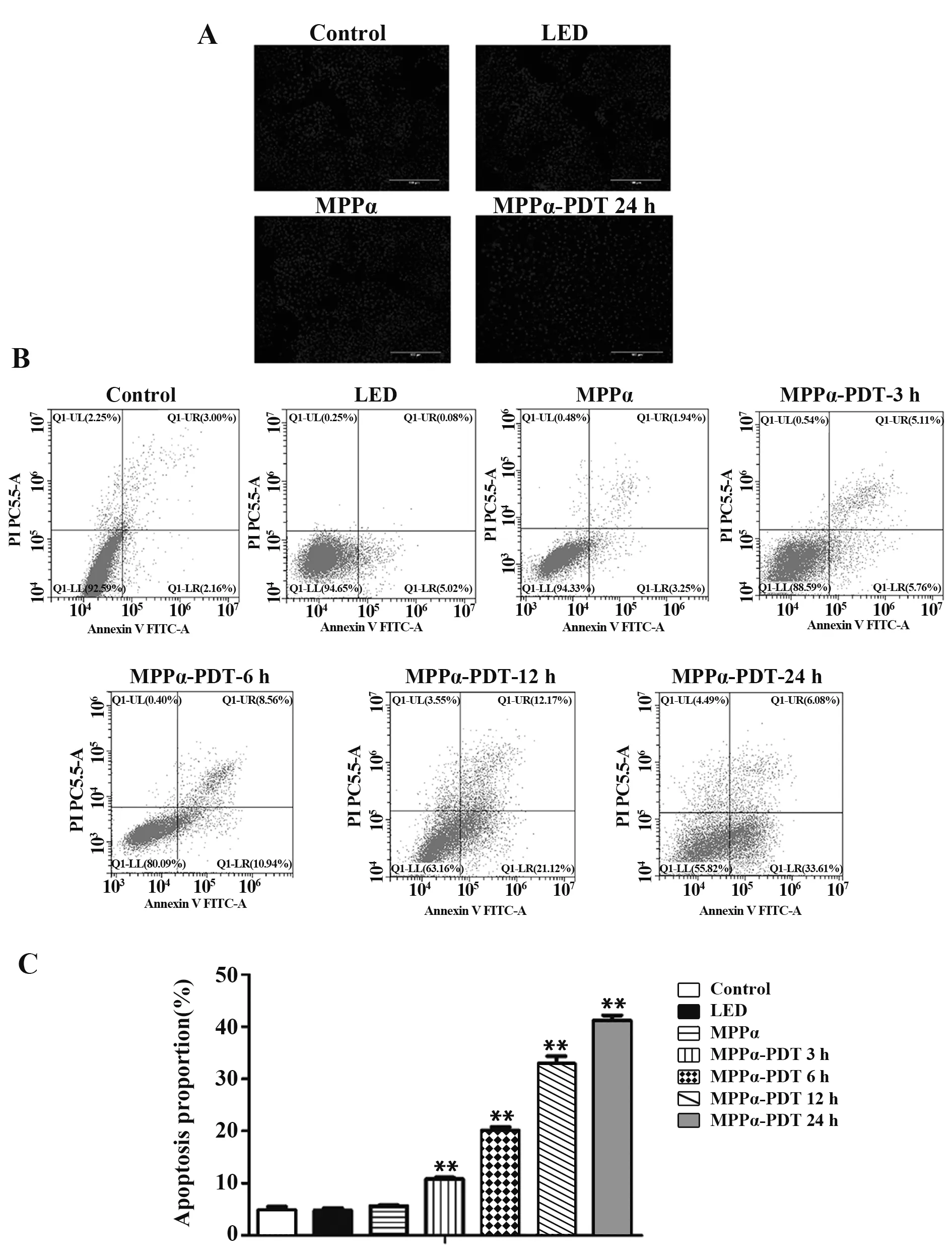
图1 HOS细胞凋亡形态变化(A)及凋亡率检测(B、C)Fig.1 Detection of morphological changes of HOS cell apoptosis(A)and apoptosis rate(B,C)
2.2 MPPα-PDT可 诱 导HOS细胞GRP78表达增高Western blot(图2)显示,与Control组比较,MPPα-PDT处 理HOS细 胞3 h、6 h、12 h、24 h组GRP78表达水平增高,差异具有统计学意义(P<0.05);并且12 h表达量最高,差异具有统计学意义(P<0.05)。Western blot结果提示,在骨肉瘤HOS细胞中,经过MPPα-PDT处理后,GRP78在12 h表达水平最高。故选用12 h时间点进行下一步实验。
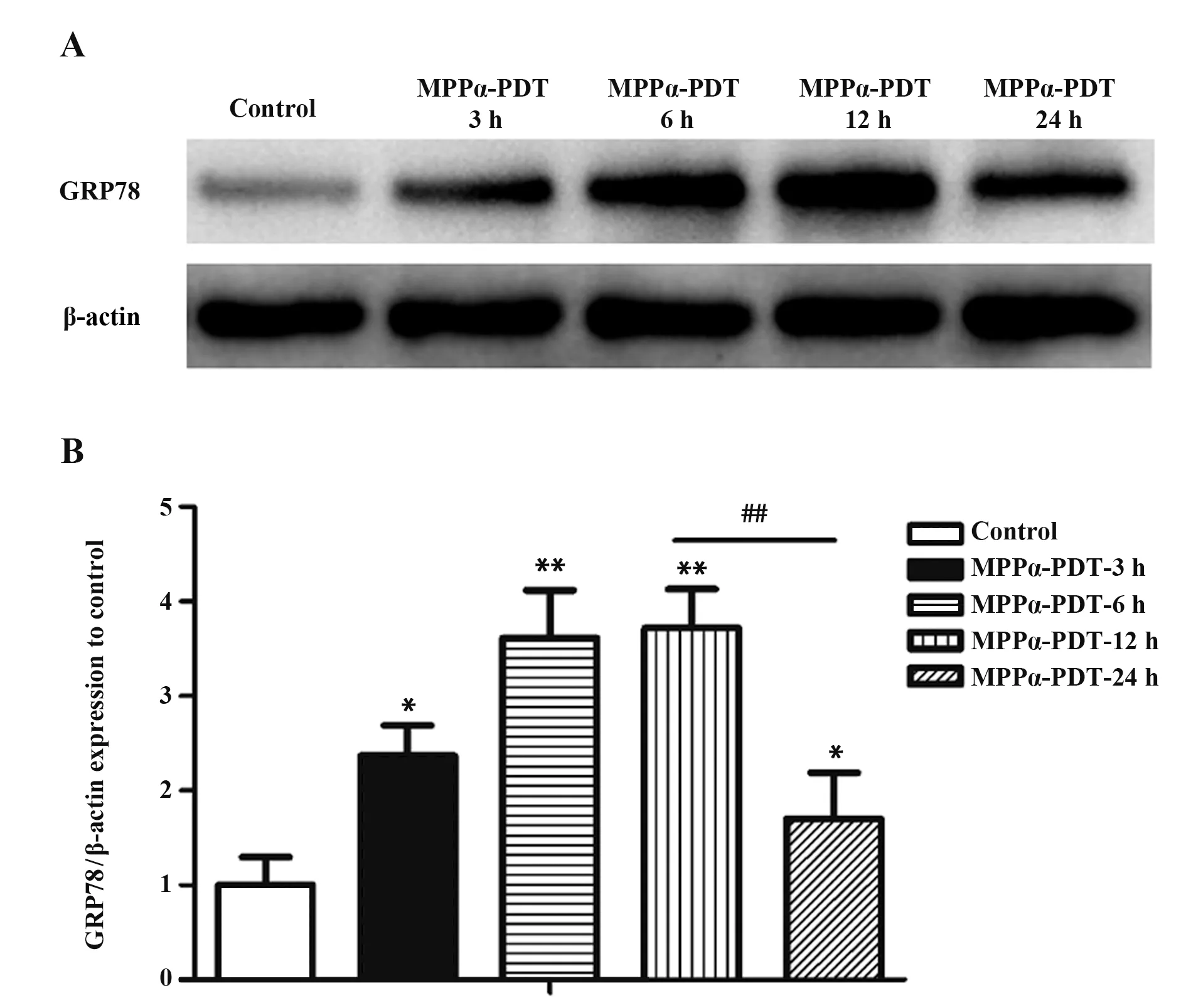
图2 Western blot检测MPPα-PDT处 理后HOS细胞 中GRP78蛋白表达Fig.2 GRP78 protein expression level in HOS cells after MPPα-PDT treatment was detected by Western blot
2.3 siRNA-GRP78有效沉默人骨肉瘤HOS细胞中GRP78的表达Western blot(图3A、B)显示,与Control组比较,siRNA-GRP78组骨肉瘤HOS细胞中GRP78蛋白的表达水平降低(P<0.05),siRNA-NC组GRP78蛋白表达差异无统计学意义(P>0.05)。qPCR法(图3C)显示,与Control组相比,siRNAGRP78组骨肉瘤HOS细胞中GRP78 mRNA的表达水平降低,干扰率约为74.60%(P<0.05),siRNA-NC组与Control组之间相比,差异无统计学意义(P>0.05)。骨 肉 瘤HOS细 胞 中siRNA-GRP78组 对GRP78 mRNA的干扰率约为74.60%。以上结果表明,siRNA-GRP78有效地干扰了HOS细胞中GRP78的表达。
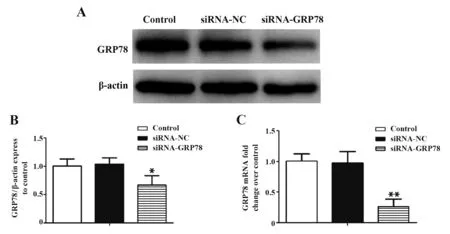
图3 siRNA-GRP78对HOS细胞 中GRP78蛋白和mRNA表达的影响Fig.3 Effect of siRNA-GRP78 on expression of GRP78 protein and mRNA in HOS cells
2.4 沉默GRP78表达降低人骨肉瘤HOS细胞的增殖活性GRP78蛋白免疫荧光(图4A、B)显示,与Control组比 较,siRNA-GRP78组 及siRNA-GRP78+MPPα-PDT组中GRP78平均荧光强度均降低(P<0.05),MPPα-PDT组中GRP78平均荧光强度增加(P<0.05);与MPPα-PDT组比较,siRNA-GRP78+MPPα-PDT组GRP78平均荧光强度降低(P<0.05)。
CCK-8法(图4C)检测结果表明,与Control组比较,siRNA-GRP78组、MPPα-PDT细胞增殖活性随时间延长而下降,差异具有统计学意义(P<0.05);与MPPα-PDT组相比,siRNA-GRP78+MPPα-PDT组细胞活性显著降低(P<0.05)。
Western blot(图4D、E)检测显示,与Control组比较,siRNA-GRP78组、siRNA-GRP78+MPPα-PDT组及MPPα-PDT组中增殖蛋白PCNA、Ki67表达均下降,差异具有统计学意义(P<0.05);与MPPα-PDT组比较,siRNA-GRP78+MPPα-PDT组中PCNA、Ki67蛋白表达下降,差异具有统计学意义(P<0.05)。以上结果提示,siRNA-GRP78可降低HOS细胞的增殖活性,同时可增强MPPα-PDT对细胞增殖活性的抑制作用。
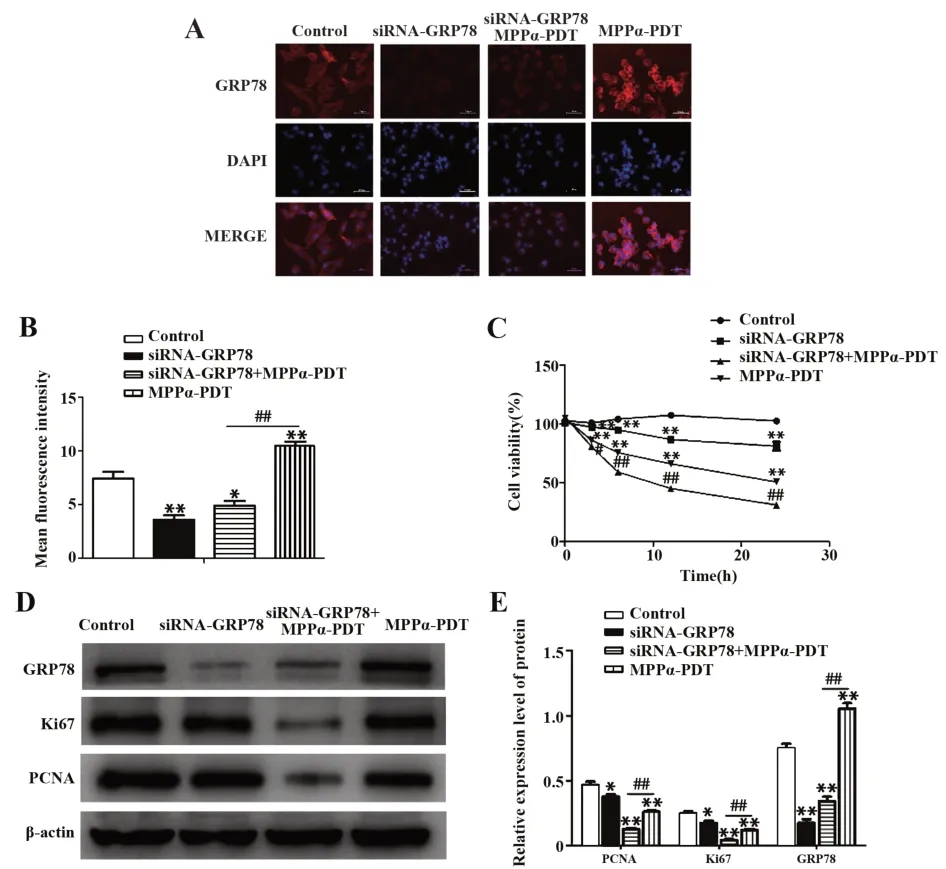
图4 GRP78表达对HOS细胞增殖活性的影响Fig.4 Effect of expression of GRP78 on proliferation activity of HOS cells
2.5 沉默GRP78表达上调人骨肉瘤HOS骨肉瘤细胞的凋亡水平Western blot(图5A、B)检测显示,与Control组比较,siRNA-GRP78组、MPPα-PDT组及siRNA-GRP78+MPP-PDT组Cleaved-PARP、Cleaved-Caspase 3凋亡相关蛋白表达上调(P<0.05);与MPPα-PDT组相比,siRNA-GRP78+MPPα-PDT组凋亡相关蛋白Cleaved-PARP、Cleaved-Caspase 3表达都明显上升(P<0.01)。
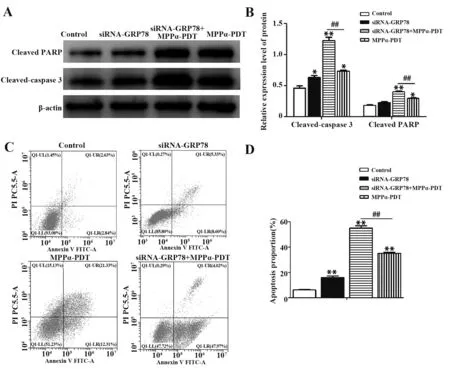
图5 各组HOS细胞凋亡相关蛋白的表达及凋亡率检测Fig.5 Detection of expression of apoptosis-related proteins and apoptosis rate of HOS cells
流式细胞仪检测细胞凋亡结果(图5C、D)显示,siRNA-GRP78组HOS细 胞 的 凋 亡 率 为(13.93±1.06)%,高于Control组(5.98±0.51)%(P<0.05);siRNA-GRP78+MPPα-PDT组 凋 亡 率 为(51.99±2.15)%,高于MPPα-PDT组(32.19±2.79)%和siRNA-GRP78组(P<0.05)。以上结果提示沉默GRP78表达增加HOS细胞的凋亡率及凋亡相关蛋白的表达,并且增加MPPα-PDT作用下的细胞凋亡水平。
2.6 沉默GRP78表达可抑制MPPα-PDT诱导HOS细胞中Wnt通路的激活Western blot(图6)检测结果显示,与Control组比较,siRNA-GRP78组中p-AKT/AKT、p-GSK3β/GSK3β及β-catenin等Wnt通路相关蛋白表达下降(P<0.05);与MPPα-PDT组比较,siRNA-GRP78+MPPα-PDT组p-AKT/AKT、p-GSK3β/GSK3β及β-catenin等Wnt通路相关蛋白表达下降(P<0.05)。以上结果提示,沉默GRP78表达可有效抑制MPPα-PDT处理后HOS骨肉瘤细胞中Wnt通路的激活。
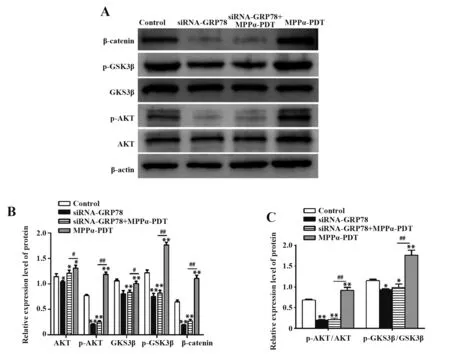
图6 Western blot检测Wnt通路相关蛋白的表达Fig.6 Expression levels of Wnt pathway related proteins were detected by Western blot
3 讨论
PDT是一种治疗效果显著的新型治疗肿瘤方法,MPPα作为新型的第二代光敏剂,能够特异性富集在肿瘤部位,然后利用特定波长的光照射肿瘤,使光敏剂发生光化学反应,导致肿瘤细胞发生凋亡[13]。肿瘤细胞在受到外界不利刺激后,会迅速诱导内质网应激,激活未折叠蛋白反应,恢复肿瘤细胞内质网微环境的稳定,增强肿瘤细胞对外界刺激的适应性[14-15]。GRP78作为内质网应激的关键调节蛋白,通过维持内质网的钙稳态及控制传感器的激活,调节未折叠蛋白反应,使细胞微环境恢复稳态[16-17]。本研究结果显示,MPPα-PDT作用于HOS细胞后,可诱导HOS细胞发生凋亡,并且能够激活未折叠蛋白反应,使GRP78表达的增加。
GRP78作为一种多功能蛋白折叠伴侣和共受体,具有强大的抗细胞凋亡特性,在人类发育和疾病中起着关键作用,与肿瘤的发生和发展密切相关[18-19]。在肿瘤细胞中,GRP78能够激活“促生存”通路,促进肿瘤细胞增殖、抗凋亡,增强肿瘤细胞对不利刺激的适应性,使肿瘤细胞对放化疗产生抗性[20]。在胰腺导管细胞癌的研究中,肿瘤组织中GRP78表达较高,并与肿瘤的化疗抗性与复发相关[21]。在复发性多形性胶质母细胞瘤的研究中,GRP78表达较高的细胞有更强的增殖与成瘤性[22]。本研究结果显示,siRNA-GRP78沉默HOS骨肉瘤细胞中GRP78表达后,HOS细胞的增殖蛋白及增殖活性下降,凋亡蛋白上调,表明GRP78在HOS细胞中起抗凋亡、促增殖的作用。
GRP78的重要性在各种癌细胞的研究中得到证实,目前认为GRP78主要通过激活经典Wnt信号通路,促进肿瘤的侵袭与转移[23-24]。在肝癌中发现,GRP78通过靶向LRP6激活Wnt信号通路,促进肝癌的侵袭与转移[25]。在结肠癌中发现,沉默GRP78可以通过干扰Wnt配体的糖基化在体外抑制Wnt信号,从而增强结肠癌干细胞对化疗药的敏感性[26]。在乳腺癌中发现,乳腺癌细胞增殖和迁移与Wnt信号通路激活相关,并且以GRP78为靶点的药物异甘草素通过抑制Wnt信号通路增强化疗药物对肿瘤细胞的敏感性[27-28]。在骨肉瘤研究中发现,化疗药物可诱发肿瘤细胞Wnt通路激活,抑制该通路可增加化疗对骨肉瘤细胞的敏感性[29]。β-catenin作为Wnt通路的核心蛋白,受上游分子GSK3β、AKT的调节,磷酸化GSK3β(p-GSK3β)及磷酸化AKT(p-AKT)作为其活化形式,可促进下游分子β-catenin激活,βcatenin入核后积累,作为转录因子调节下游靶基因,从而发挥其生物学作用[27]。本研究结果显示,与Control组比较,siRNA-GRP78组中AKT、GSK3β稍下降,p-AKT及p-GSK3β明显下降,且p-AKT/AKT、p-GSK3β/GSK3β比例及β-catenin均明显下降,表明有效沉默GRP78后,Wnt通路相关蛋白受抑制;同理,与Control组比较,MPPα-PDT组中Wnt信号通路中p-AKT/AKT、p-GSK3β/GSK3β比例及βcatenin均增加,表明MPPα-PDT可诱导HOS骨肉瘤细胞中Wnt通路激活;同时,与MPPα-PDT组比较,siRNA-GRP78+MPPα-PDT组中Wnt通路相关蛋白表达均下降,表明有效沉默GRP78后,可抑制MPPα-PDT诱导HOS细胞Wnt通路的激活。
综上所述,骨肉瘤HOS细胞经过MPPα-PDT处理后,HOS细胞中GRP78表达增高;并且沉默GRP78表达后,骨肉瘤HOS细胞增殖活性下降、凋亡水平上调;同时,沉默GRP78表达可抑制MPPα-PDT诱导下的骨肉瘤Wnt通路激活,提示沉默GRP78增加骨肉瘤HOS细胞对MPPα-PDT的敏感性可能与抑制Wnt通路激活相关,这为沉默GRP78靶点联合MPPα-PDT治疗骨肉瘤提供了一定的实验依据。