过氧化氢诱导大鼠离体子宫韧带成纤维细胞的相关变化
卓然然,聂明朝,李丽红,李常虹,张芳芳
(海南省妇女儿童医学中心(海南省妇幼保健院)妇产科,海口 571100)
盆底功能障碍性疾病是中老年女性的常见病,主要是由于损伤、衰老等原因导致盆底组织结构发生病理改变,最终发生盆腔器官位置异常及相应器官功能障碍,是影响女性身心健康和生活质量的一个重要公共问题[1-2]。该病包括盆腔器官脱垂(pelvic organ prolapse,POP)和压力性尿失禁。女性盆腔器官和盆底组织处于妊娠、分娩等引起腹内压力变化的复杂生物力学环境中,容易损伤盆底肌肉筋膜及子宫韧带,或因其他原因导致其张力减低,支持功能薄弱,使腔内器官下降移位,即为盆底器官脱垂[3-4]。有研究显示,POP的发生还与氧化应激相关[5],Kim等[6]对盆底组织基因组多态性的研究发现,氧化应激相关基因与POP相关。
成纤维细胞是子宫韧带的主要细胞,也是盆底韧带的主要受力细胞,主要功能是合成并分泌细胞外基质等,以此促进机体的新陈代谢,支持组织结构和功能[7],其中Ⅰ型胶原与支持作用有关,硬度较大,直径较粗,Ⅲ型胶原、弹性蛋白与组织的弹性有关,这些成分的变化导致弹性和拉伸强度降低,导致韧带、筋膜等支持结构松弛[8-9]。正常机体存在抗氧化系统,当活性氧生成过量和(或)机体抗氧化系统受损导致活性氧及其代谢产物过量聚集时,氧化还原平衡失调,大量的活性氧簇就会产生氧化应激反应。过氧化氢是活性氧簇的主要成员之一,可通过多种途径损害细胞,是一种比较常用的细胞氧化应激和细胞老化诱导剂[10-11]。本研究以子宫韧带成纤维细胞为干预对象,用不同浓度过氧化氢刺激模拟氧化应激微环境,观察氧化应激对大鼠子宫韧带成纤维细胞增殖、凋亡、胶原合成以及炎症因子表达的影响并探讨其相关分子机制,为POP疾病治疗提供实验依据。
1 材料和方法
1.1 实验动物
4周龄雌性SD大鼠4只,SPF级,体重70~80 g,购买于湖南省斯莱克景达实验动物公司[SCXK(湘)2019-0004],饲养于海南省人民医院实验动物中心[SYXK(琼)2019-0011],所有动物实验程序均按国家标准进行并经海南省人民医院动物实验伦理委员会批准(HNWCMC伦审2019年第[7]号),并按实验动物使用的3R原则给予人道关怀。
1.2 主要试剂与仪器
过氧化氢(H2O2)(天津科密欧化学试剂有限公司);DMEM培养基、胎牛血清、胶原酶(Gibco,美国);4%多聚甲醛、0.25%胰蛋白酶(Hyclone,美国);MTT试剂、二甲基亚砜(上海碧云天生物有限公司);AnnexinV-FITC/PI凋亡检测试剂盒(北京索莱宝科技有限公司);波形蛋白单克隆抗体、角蛋白单克隆抗体、生物素化山羊抗大鼠IgG、链酶亲和素-生物素-过氧化物酶复合物(武汉博士德生物工程有限公司);细胞裂解液、BCA蛋白含量检测试剂盒(Sigma公司,美国);抗Ⅰ型胶原、Ⅲ型胶原、肿瘤坏死因子α、白细胞介素6、白细胞介素1β、p-ERK1/2、ERK1/2、Akt、p-Akt、GAPDH抗体、HRP标记的兔抗羊二抗(Santa Cruz Biotechnology公司,美国)。
CO2细胞培养箱(Therm Fisher公司,美国);倒置显微镜(Olympus公司,日本);MK3酶标仪(Thermo公司,美国);流式细胞仪(BD公司,美国)。
1.3 实验方法
1.3.1 子宫韧带成纤维细胞培养
将4周龄雌性SD大鼠颈椎脱臼处死后,无菌条件下取出双侧子宫韧带组织,PBS清洗3~5遍,用剪刀剪成1 mm×1 mm左右的小块,用含0.25%胰蛋白酶及0.2%Ⅱ型胶原酶的混合液消化2 h,体积分数为10%胎牛血清终止消化,1500 r/min离心洗涤5 min,弃上清,用含体积分数为10%胎牛血清的DMEM培养基重悬,接种于培养瓶中,置于37℃、体积分数为5%的CO2培养箱内培养,每2 d换液1次,待细胞生长达到80%~90%时按1∶2比例进行传代,取第3~5代细胞用于后续实验。
1.3.2 成纤维细胞鉴定
选取生长状况良好的第3~5代子宫韧带成纤维细胞,制成每毫升2×105个的细胞悬液,以每孔1 mL接种于预先放有盖玻片的6孔培养板中,倒置显微镜下观察盖玻片上的细胞增殖至70%~80%时进行检测。取出玻片,PBS漂洗3次,40 g/L多聚甲醛固定30 min,PBS漂洗3次×3 min;体积分数为3%H2O2孵育15 min,PBS漂洗3次×3 min;10%山羊血清封闭20 min,消除非特异性背景,吸去多余液体,不必清洗;加入抗角蛋白、抗波形蛋白单克隆抗体,4℃孵育过夜,PBS漂洗3次×3 min;滴加生物素化山羊抗大鼠IgG二抗室温孵育20 min,PBS漂洗3次×3 min;然后加入链酶亲和素-生物素-过氧化物酶复合物室温孵育20 min,PBS漂洗3次×5 min;DAB显色,显微镜下掌握染色程度,流水冲洗;苏木精复染1 min,自来水冲洗返蓝,镜下观察。
1.3.3 过氧化氢诱导子宫韧带成纤维细胞氧化应激模型建立
据前期参考文献[12],选择0.2 mmol/L和0.8 mmol/L过氧化氢对子宫韧带成纤维细胞干预4 h,建立细胞低水平和高水平的氧化应激模型,以正常培养未进行任何干预的子宫韧带成纤维细胞作为对照组。
1.3.4 MTT法检测细胞增殖能力
将第3代子宫韧带成纤维细胞悬液以每孔2×105个的密度接种于96孔板,每孔100μL,细胞分3组:低氧化应激组用0.2 mmol/L过氧化氢干预4 h,高氧化应激组用0.8 mmol/L过氧化氢干预4 h,对照组单纯采用DMEM完全培养基孵育4 h,然后每孔加入10μL MTT溶液(5 g/L),继续培养4 h后吸弃上清,每孔加150μL DMSO溶液,振荡10 min,使用酶标仪检测490 nm波长处的吸光度值。
1.3.5 Annexin V-FITC/PI法检测细胞凋亡情况
将第3代子宫韧带成纤维细胞悬液以每孔1×105个细胞密度接种于6孔板,培养24 h后细胞分3组:低氧化应激组用0.2 mmol/L过氧化氢干预4 h,高氧化应激组用0.8 mmol/L过氧化氢干预4 h,对照组单纯采用DMEM完全培养基孵育4 h,PBS洗涤2次,0.25%胰酶消化,离心收集细胞,加入500μL Binding Buffer结合缓冲液吹打混匀,然后依次加入5μL Annexin V-FITC和5μL PI,室温避光孵育20 min,流式细胞仪上机检测。
1.3.6 Western blot检测Ⅰ型胶原、Ⅲ型胶原、炎症因子、信号通路相关蛋白的表达
按上述分组干预4 h后收集细胞,PBS清洗2次,按比例加入细胞裂解液,研磨细胞,12000 r/min离心8 min,提取细胞总蛋白,采用BCA方法检测蛋白浓度。取20μL蛋白样品,加入适量浓缩的蛋白上样缓冲液混合,100℃水浴中煮沸5 min使蛋白变性,冷却到室温后,把蛋白样品直接上样到加样孔内,100 V电压下SDS-PAGE凝胶电泳分离90 min;然后将电泳分离的蛋白转移到PVDF膜上,在100 V电压下转膜1 h;取出PVDF膜,用含5%脱脂奶粉封闭液放摇床上封闭1~3 h;加入一抗(抗Ⅰ型胶原、Ⅲ型胶原、肿瘤坏死因子α、白细胞介素6、白细胞介素1β、p-ERK1/2、ERK1/2、p-Akt、Akt、GAPDH抗体)室温孵育1 h后,4℃孵育过夜,TBST洗膜3次,加入HRP标记的兔抗羊二抗室温孵育2 h,TBST清洗3次,加入ECL发光液反应5 min,曝光,显影,用Image J软件分析各组目的蛋白和内参蛋白条带的灰度值,结果以目的蛋白与内参蛋白灰度值的比值表示。
1.4 统计学方法
各实验重复3次,计量资料以平均数±标准差(±s)表示,采用SPSS 20.0统计软件进行统计分析,检测水平为α=0.05,样本均数多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。
2 结果
2.1 子宫韧带成纤维细胞形态及鉴定结果
细胞形态以梭形、纺锤形为主,胞体狭长,胞核呈椭圆形,胞浆丰富,细胞排列有一定的方向性。免疫细胞化学染色显示:波形蛋白染色阳性,胞浆内见大量棕黄色颗粒,角蛋白染色阴性,符合成纤维细胞的细胞标记特征。见图1。

图1 子宫韧带成纤维细胞形态及鉴定结果Note.A,Fibroblasts of the third generation of uterine ligament were long spindle shaped.B,Immunocytochemical staining showed that vimentin staining was positive.C,Keratin staining was negative.Figure 1 Morphology and identification results of fibroblasts from uterine ligament
2.2 氧化应激对子宫韧带成纤维细胞增殖的影响
采用MTT法检测细胞增殖能力,高氧化应激组吸光度值显著低于低氧化应激组、对照组,差异有显著性意义(P<0.05),可见0.8 mmol/L过氧化氢干预4 h后,细胞增殖能力下降,而低氧化应激组吸光度值与对照组比较,差异无显著性意义(P>0.05)。见图2。
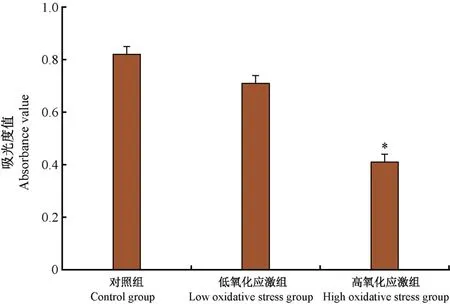
图2 氧化应激对子宫韧带成纤维细胞增殖的影响Note.Compared with the control group and low oxidative stress group,*P<0.05.The same as below.Figure 2 Effect of oxidative stress on proliferation of fibroblasts from uterine ligament
2.3 氧化应激对子宫韧带成纤维细胞凋亡的影响
流式细胞仪检测高氧化应激组细胞凋亡率[(39.6±4.4)%]显著高于低氧化应激组、对照组[(18.45±1.61)%,(12.12±1.06)%],差异有显著性意义(P<0.05),可见0.8 mmol/L过氧化氢干预4 h后,细胞凋亡率明显增高,而低氧化应激组细胞凋亡率与对照组比较,差异无显著性意义(P>0.05)。见图3。
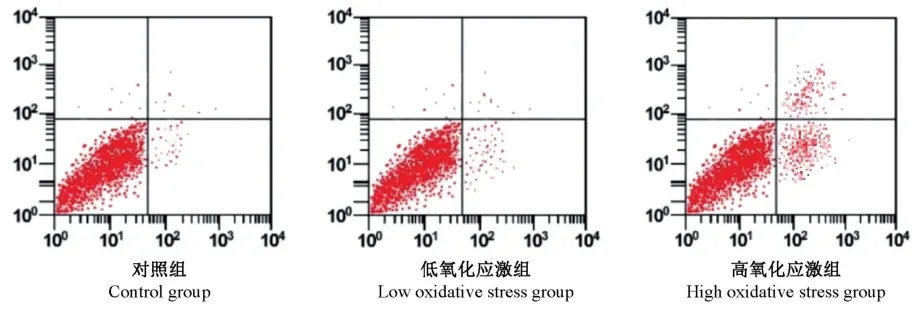
图3 流式细胞术检测子宫韧带成纤维细胞凋亡率Figure 3 Flow cytometry was used to detect the apoptosis rate of fibroblasts in uterine ligament
2.4 氧化应激对子宫韧带成纤维细胞胶原合成的影响
Western blot检测高氧化应激组Ⅰ型胶原、Ⅲ型胶原蛋白表达显著低于低氧化应激组、对照组,差异有显著性意义(P<0.05),可见0.8 mmol/L过氧化氢干预4 h后,Ⅰ型胶原、Ⅲ型胶原合成明显减少,而低氧化应激组Ⅰ型胶原、Ⅲ型胶原蛋白表达与对照组比较,差异无显著性意义(P>0.05)。见图4。
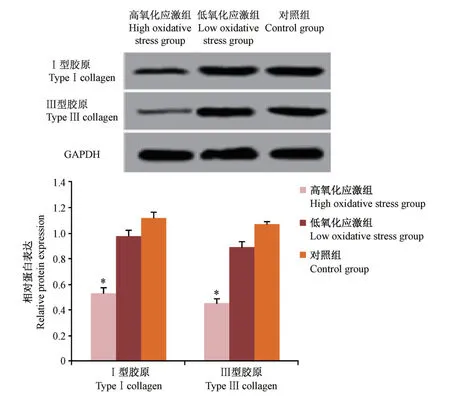
图4 Western blot检测各组子宫韧带成纤维细胞Ⅰ型胶原、Ⅲ型胶原的表达Figure 4 Western blot was used to detect the expression of type I collagen and type III collagen in uterine ligament fibroblasts
2.5 氧化应激对子宫韧带成纤维细胞炎症因子蛋白表达的影响
Western blot检测高氧化应激组白细胞介素1β、肿瘤坏死因子α和白细胞介素6的蛋白表达水平明显高于低氧化应激组、对照组,差异有显著性意义(P<0.05);同时低氧化应激组白细胞介素1β、肿瘤坏死因子α和白细胞介素6的蛋白表达水平也轻微提高,但与对照组比较差异无显著性意义(P>0.05)。见图5。
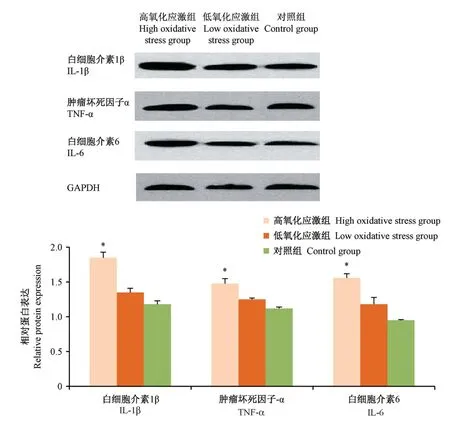
图5 Western blot检测各组子宫韧带成纤维细胞炎症因子蛋白的表达Figure 5 Western blot was used to detect the expression of inflammatory factor protein in fibroblasts of uterine ligament
2.6 Western blot检测通路相关蛋白的表达
采用Western blot检测MEK-ERK1/2与PI3KAkt信号通路相关蛋白的表达,结果显示,与对照组和低氧化应激组相比,高氧化应激组p-ERK1/2、p-Akt的表达明显降低(P<0.05),而总蛋白ERK1/2、Akt的表达基本保持不变。见图6。
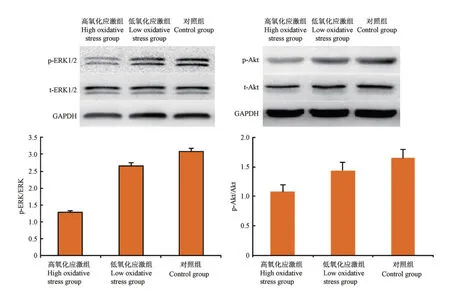
图6 Western blot检测各组子宫韧带成纤维细胞通路相关蛋白的表达Figure 6 Western blot was used to detect the expression of fibroblast pathway related proteins in each group
3 讨论
POP是一类由盆底支持结构功能障碍而引起的盆腔正常器官(阴道壁、子宫、膀胱、直肠等)位置下移,从而严重影响人们的身体健康及生活质量的常见疾病。年龄、阴道分娩、慢性便秘、肥胖和激素水平下降是公认的危险因素,随着年龄的增长,分娩的影响逐渐降低,而衰老、激素水平改变的影响则明显增加[13-14]。根据衰老自由基理论[15],细胞衰老在某种意义上是氧化损伤的结果。研究显示导致氧化应激损伤的活性氧不仅能诱导细胞发生凋亡,还能激活细胞使其具有表型转化的潜能[16-17]。过氧化氢是活性氧的一种,也是体内导致氧化应激损伤的主要效应分子,其参与调节新陈代谢、老年性疾病、凋亡和生长因子相关的信号通路,尽管其本身会迅速与信号分子反应而失活,但其造成级联反应能导致氧化应激持续存在,使其成为氧化应激研究的重要工具药[18]。过氧化氢介导的氧化应激在POP疾病进展过程中可能发挥着重要作用。课题组前期用不同浓度过氧化氢干预后发现子宫旁韧带成纤维细胞内活性氧水平增高,使细胞处于氧化应激状态,且具有一定的剂量依赖性,认为0.2 mmol/L和0.8 mmol/L过氧化氢可导致细胞低水平氧化应激和高水平氧化应激[12]。在此基础上,该实验选取0.2 mmol/L和0.8 mmol/L过氧化氢诱导大鼠子宫韧带成纤维细胞氧化应激产生,初步观察不同程度氧化应激作用下大鼠子宫韧带成纤维细胞增殖、凋亡、胶原合成以及炎症因子表达并探讨其相关分子机制。本研究采用MTT法和Annexin V-FITC/PI法检测细胞增殖、凋亡情况,结果显示:低水平氧化应激状态下细胞内活性氧虽有增多,细胞活力有所下降,细胞凋亡有所增加,但与对照组比较差异无显著性意义,说明其不足以影响细胞发挥正常功能;但随着活性氧产生继续增加,细胞氧化应激水平也增加,细胞活力明显下降,细胞凋亡进一步增加,与对照组和低氧化应激组比较差异有显著性意义,说明高浓度的过氧化氢能明显抑制子宫韧带成纤维细胞增殖,诱导细胞凋亡。
以往研究表明,以胶原合成减少为特征的细胞外基质代谢紊乱是POP的病理分子基础[19]。胶原蛋白是一组由多种糖分子组成的大家族,是细胞外基质的一种结构蛋白质。不同类型的胶原蛋白有着不同的化学结构,相应的具有不同功能和免疫学特性。盆底的筋膜和韧带胶原蛋白主要由Ⅰ型和Ⅲ型胶原构成,Ⅰ型胶原蛋白直径较粗,有很高的抗张强度,对盆腔器官起支持作用;Ⅲ型胶原蛋白直径较细,与弹性有关。Jackson等[20]发现POP患者阴道组织胶原含量减少20%;Lang等[21]报道压力性尿失禁和POP患者子宫韧带胶原纤维直径明显大于对照组,这些韧带弹性较小,更容易断裂,以胶原降解占主导作用可能是发生压力性尿失禁和POP的原因之一;Han等[22]研究发现POP伴或不伴压力性尿失禁患者子宫韧带Ⅰ、Ⅲ型胶原表达水平均显著低于对照组;Vulic等[23]研究发现POP患者子宫骶韧带中基质金属蛋白酶1表达增加,Ⅰ型胶原表达降低,并认为子宫骶韧带中Ⅰ型胶原和基质金属蛋白酶1的表达可能与POP有关。本研究结果显示外源性过氧化氢孵育4 h后,较低浓度的过氧化氢刺激对子宫韧带成纤维细胞胶原合成代谢与对照组无显著差异,而高浓度的过氧化氢促进Ⅰ型、Ⅲ型胶原的分解代谢。因此,我们认为氧化应激是导致子宫韧带成纤维细胞胶原代谢紊乱的原因之一。Western blot检测实验可知,高氧化应激组白细胞介素1β、肿瘤坏死因子α和白细胞介素6的蛋白表达水平明显高于低氧化应激组、对照组;同时低氧化应激组也轻微提高白细胞介素1β、肿瘤坏死因子α和白细胞介素6的蛋白表达水平,但与对照组比较无显著差异,说明这些炎性因子参与了过氧化氢诱导的子宫韧带组织炎症反应。
目前研究较广泛的与细胞增殖、凋亡发生过程相关的信号通路分子主要有MEK-ERK1/2与PI3KAkt信号通路等[24-26]。ERK1/2是MAPK通路中极其重要的组成部分之一,研究表明,ERK活化后通过促进Cyclin D1表达以及其与CDK4结合而促进细胞周期进展,促进细胞增殖分化。ERK持续激活可以阻止细胞凋亡的发生,抑制ERK的活化能够促进细胞凋亡的发生[27]。PI3K是生长因子受体下游直接的信号传递分子,负责传递细胞内有丝分裂信号,对细胞的生存、增殖起重要作用[28-29]。本实验证实,对大鼠子宫韧带成纤维细胞进行低、高浓度过氧化氢干预4 h后,有效抑制MAPK-ERK1/2、PI3K-Akt信号通路的活化,与对照组和低氧化应激组相比,高氧化应激组p-ERK1/2、p-Akt的表达明显降低(P<0.05),而总蛋白ERK1/2、Akt的表达基本保持不变,上述指标在对照组和低氧化应激组无显著差异。这些结果表明高浓度过氧化氢通过磷酸化ERK1/2和Akt,抑制细胞增殖和促进细胞凋亡过程。总之,高浓度过氧化氢通过抑制ERK1/2信号通路,下调Ⅰ型和Ⅲ型胶原蛋白的表达,抑制子宫韧带成纤维细胞的增殖,研究表明参与盆腔功能障碍性疾病发生发展的分子机制十复杂且涉及的信号通路不止一种[30-32],各个通路共同参与了盆腔功能障碍性疾病的发展,为解释盆腔功能障碍性疾病的相关作用机制提供更多的实验依据。
综上所述,氧化应激微环境中较高浓度的过氧化氢通过抑制MAPK通路中ERK1/2表达和PI3KAkt通路中Akt表达,引起子宫韧带成纤维细胞的增殖能力下降,细胞凋亡增加,胶原合成受阻。另外,氧化应激导致炎症因子表达增加,对子宫韧带成纤维细胞的增殖、凋亡有一定影响,并进一步影响胶原合成,但其具体机制尚需进一步研究。

