梓醇通过上调BMP-2表达激活Wnt/β-catenin信号通路促进大鼠股骨骨折愈合*
曹 园,陈枫文,胡 杨,廉 凯,张熙明
(湖北文理学院附属医院襄阳市中心医院骨科,襄阳 441021)
骨骼在运动、支持器官、维持矿物质稳态和结构坚固性方面发挥着重要作用。代谢紊乱、创伤、肿瘤切除、骨髓炎手术清创以及各种先天性疾病均可造成骨萎缩、骨再生延迟等骨缺损[1]。据统计,骨折的终生患病率为50%。虽然大多数骨损伤能够正常愈合,但仍有10%~15%的骨折患者会出现愈合不良的并发症,如延迟愈合或不愈合[2]。因此,继续探索促进骨折愈合的有效策略具有重要意义。地黄是东亚地区的一种传统中草药,已被广泛用于治疗骨质疏松症,但其活性成分和作用机制尚不完全清楚[3]。梓醇是地黄的主要活性成分,具有抗氧化、抗炎、抗缺血等多种生物学活性[4]。然而,梓醇对骨折愈合的影响尚待阐明。骨形态发生蛋白(bone morphogenetic protein,BMP)属于转化生长因子-β(transforming growth factor-β,TGF-β)超家族,在促进和加速骨再生方面具有巨大潜力[5]。骨形态发生蛋白-2(bone morphogenetic protein 2,BMP-2)是骨形成最重要的调节因子之一,自人体胚胎发育开始参与骨骼发育和骨缺损修复,在脂肪、肾脏和神经系统的发育中起着至关重要的作用[6]。已有研究表明,BMP-2通过激活人无翅型MMTV整合位点家族(Wingless-Type MMTV Integration Site Family,Wnt)信号通路,使β-连锁蛋白(β-catenin)信号通路积聚,从而促进骨髓间充质干细胞的成骨分化,修复骨缺损[7]。本研究旨在探究梓醇对大鼠股骨骨折愈合的影响及其作用机制是否与调控BMP-2 和Wnt/β-catenin 信号通路相关,以期为制定新的促进骨折愈合的有效策略提供参考。
1 材料与方法
1.1 药品和主要试剂
梓醇(纯度≥98%)购自成都曼思特生物科技有限公司;BMP-2干扰慢病毒液(sh-BMP-2)和阴性对照慢病毒液(sh-NC)购自上海吉玛制药技术有限公司;Trizol 试剂购自赛默飞世尔科技(中国)有限公司;2×SYBR Green qPCR Master Mix 购自美国Bimake ;BMP-2、Runx2 和Ⅰ型胶原蛋白(ColⅠ)抗体购自英国Abcam;β-catenin 和GAPDH 抗体购自北京义翘神州科技股份有限公司;cyclinD1 和c-myc抗体购自美国Cell Signaling Technology ;碱性磷酸酶(ALP)检测试剂盒和BCA 蛋白定量检测试剂盒购自上海碧云天生物技术有限公司;骨钙素(OCN)检测试剂盒购自上海江莱生物科技有限公司。
1.2 实验动物
48 只清洁级雄性SD 大鼠,6~7 周龄,体质量(230±20)g,购自湖北奥菲生物科技有限公司,许可证号SCXK(鄂)2019—0024。所有大鼠饲养于标准动物房。环境温度20~24 ℃、湿度60%~70%、昼夜12 h/12 h 饲养,提供充足的饮水和饲料。待所有大鼠适应环境1 周后,进行造模。本研究经我院动物实验伦理委员会审批通过。
1.3 方法
1.3.1 大鼠股骨骨折模型的建立及给药处理
待所有大鼠适应环境1 周后,参考文献[8]建立大鼠股骨骨折模型。10%水合氯醛(3 mL/kg)腹腔麻醉大鼠,随后将大鼠固定。暴露大鼠股骨中段,用线锯将股骨中段锯断,造成横行骨折。用直径为1.5 mm的克氏针进行髓内固定骨折断端,生理盐水反复冲洗切口后,逐层缝合切口。将48 只SD 大鼠随机分为对照组、梓醇组、梓醇+sh-NC 组和梓醇+sh-BMP-2 组,每组12 只。梓醇组大鼠灌胃50 mg/kg梓醇[9],梓醇+sh-NC组大鼠灌胃50 mg/kg梓醇和尾静脉注射300 μL sh-NC 慢病毒液,梓醇+sh-BMP-2 组大鼠灌胃50 mg/kg 梓醇和尾静脉注射300 μL sh-BMP-2 慢病毒液,对照组大鼠灌胃等量溶剂,1次/d,连续给药3周。
1.3.2 X线检测
各组大鼠骨折0 周、2 周和3 周后,拍摄各组大鼠股骨正位X 线片。参考文献[10]应用Lane-Sandhu X 线评分评估各组大鼠骨折愈合情况。Lane-Sandhu X线评分标准包括骨形成、骨连接、骨塑形3个方面。骨形成:无骨形成记0分;骨形成占骨缺损25%记1 分;骨形成占骨缺损50%记2 分;骨形成占骨缺损75%记3分;骨形成满缺损记4分。骨连接:骨折线清楚记0分;骨折线部分存在记2分;骨折线消失记4分。骨塑形:未见骨塑形记0分;骨髓腔形成记2分;皮质骨塑形记4分。
1.3.3 Micro-CT检测
术后2 周和3 周,各组大鼠随机取6 只大鼠,10%水合氯醛(3 mL/kg)腹腔麻醉大鼠,随后处死大鼠,取患肢股骨标本,去除周围软组织和髓内克氏针。用微型CT 系统扫描股骨,定义骨折线上下5 mm 范围区域建立三维兴趣区,分别测量骨体积(bone volume,BV)、骨体积分数(bone volume/tissue volume,BV/TV)、骨小梁数量(trabecular number,TB.N)、骨小梁间距(trabecular bone spacing,TB.Sp)和骨小梁厚度(trabecular thickness,TB.Th)。
1.3.4 RT-PCR检测BMP-2 mRNA表达
术后3 周,处死大鼠,取大鼠骨痂组织液氮冻存。取液氮冻存的各组大鼠骨痂组织,迅速研磨至粉末状。加入Trizol 试剂,提取组织总RNA。微量分光光度计测定各样品的RNA 浓度,立即将RNA逆转录成cDNA。以此cDNA 为模板,根据2×SYBR Green qPCR Master Mix 说明书所示进行BMP-2 mRNA 表达的检测。反应程序:95℃、10 min;95℃、15 s,60℃、30 s,72℃、30 s,40 个循环;95℃、15 s;60℃、60 s;95℃、15 s。以GAPDH 为内参,采用2-ΔΔCt法计算BMP-2 mRNA 表达。其中,BMP-2 上游引物:5’-TCGAGAACAGATG CAGGAAG-3’,BMP-2 下游引物:5’-GGAATTTCGAGT TGGCTGTT-3’;GAPDH 上游引物:5’-TTGAACCAGGCGGCTGCGGA-3’,GAPDH 下游引物:5’-GGAGGCTGCG GGCTCAATTT-3’。
1.3.5 Western blotting 检测BMP-2、Runx2、ColⅠ、β-catenin、cyclinD1和c-myc蛋白表达
取液氮冻存的各组大鼠骨痂组织,迅速研磨至粉末状。加入RIPA 蛋白裂解液,冰上裂解组织30 min,离心取上清液。BCA 蛋白定量检测试剂盒测定上清液的蛋白浓度。各样品取30 μg蛋白置于SDS-PAGE 凝胶加样孔内进行电泳分离和转膜操作。5%脱脂奶粉室温封闭2 h,随后加入BMP-2(1∶1 000)、Runx2(1∶1 000)、ColⅠ(1∶1 000)、βcatenin(1∶1 000)、cyclinD1(1∶2 000)、c-myc(1∶1 000)和GAPDH(1∶2 000)抗体,4 ℃条件下孵育过夜。二抗(1∶5 000)室温条件下孵育1 h。将ECL化学发光检测试剂均匀滴至膜上,化学发光成像系统检测蛋白条带。应用Image Pro Plus 6.0软件进行蛋白条带的灰度分析。
1.3.6 ELISA检测血清中ALP和OCN水平
10%水合氯醛(3 mL/kg)腹腔麻醉大鼠,分离患肢侧股动脉,切断股动脉后收集血液。血液室温静置10 min后,离心收集上清液(即血清)。根据ELISA 检测试剂盒说明书所示,检测血清样品中ALP和OCN水平。
1.4 统计学方法
采用SPSS 21.0 软件对数据进行统计分析,计量资料以均数±标准差()表示。多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠骨折愈合X线评分的比较
与对照组比较,梓醇组大鼠骨折2周和3周后X线评分显著升高(P<0.05);梓醇组和梓醇+sh-NC组大鼠骨折2周和3周后X线评分差异无统计学意义(P>0.05);与梓醇+sh-NC 组比较,梓醇+sh-BMP-2组大鼠骨折2周和3周后X线评分显著降低(P<0.05),见图1。
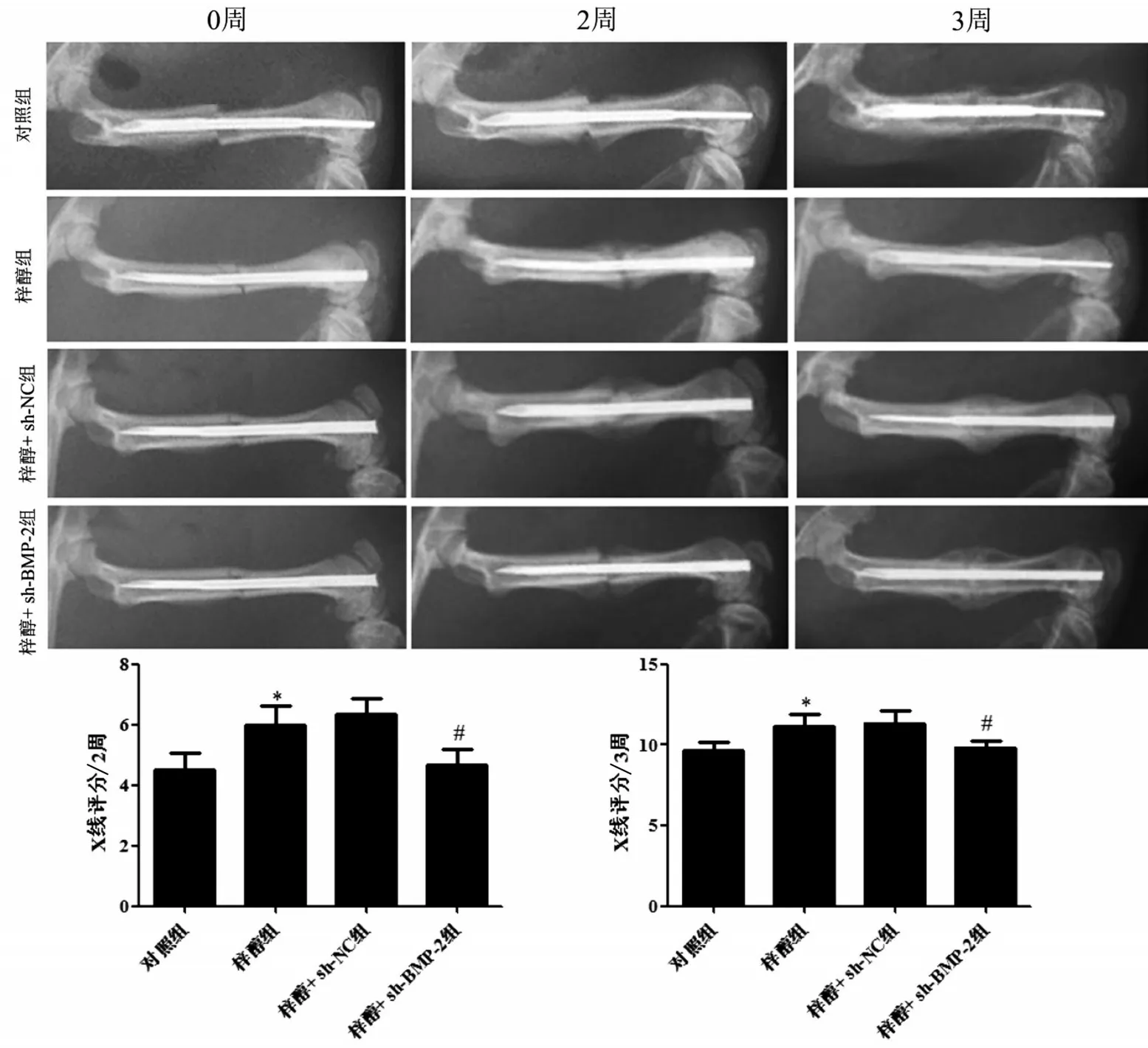
图1 各组大鼠骨折愈合X线评分的比较
2.2 各组大鼠Micro-CT检测指标的比较
与对照组相比,梓醇组大鼠骨折3周后BV、BV/TV、TB.N 和TB.Th 显著升高(P<0.05),TB.Sp 无显著差异(P>0.05);梓醇组和梓醇+sh-NC 组大鼠骨折3 周后BV、BV/TV、TB.N、TB.Sp 和TB.Th 差异无统计学意义(P>0.05);与梓醇+sh-NC 组相比,梓醇+sh-BMP-2组大鼠骨折3周后BV、BV/TV、TB.N和TB.Th 显著降低(P<0.05),TB.Sp 无显著差异(P>0.05),见图2。
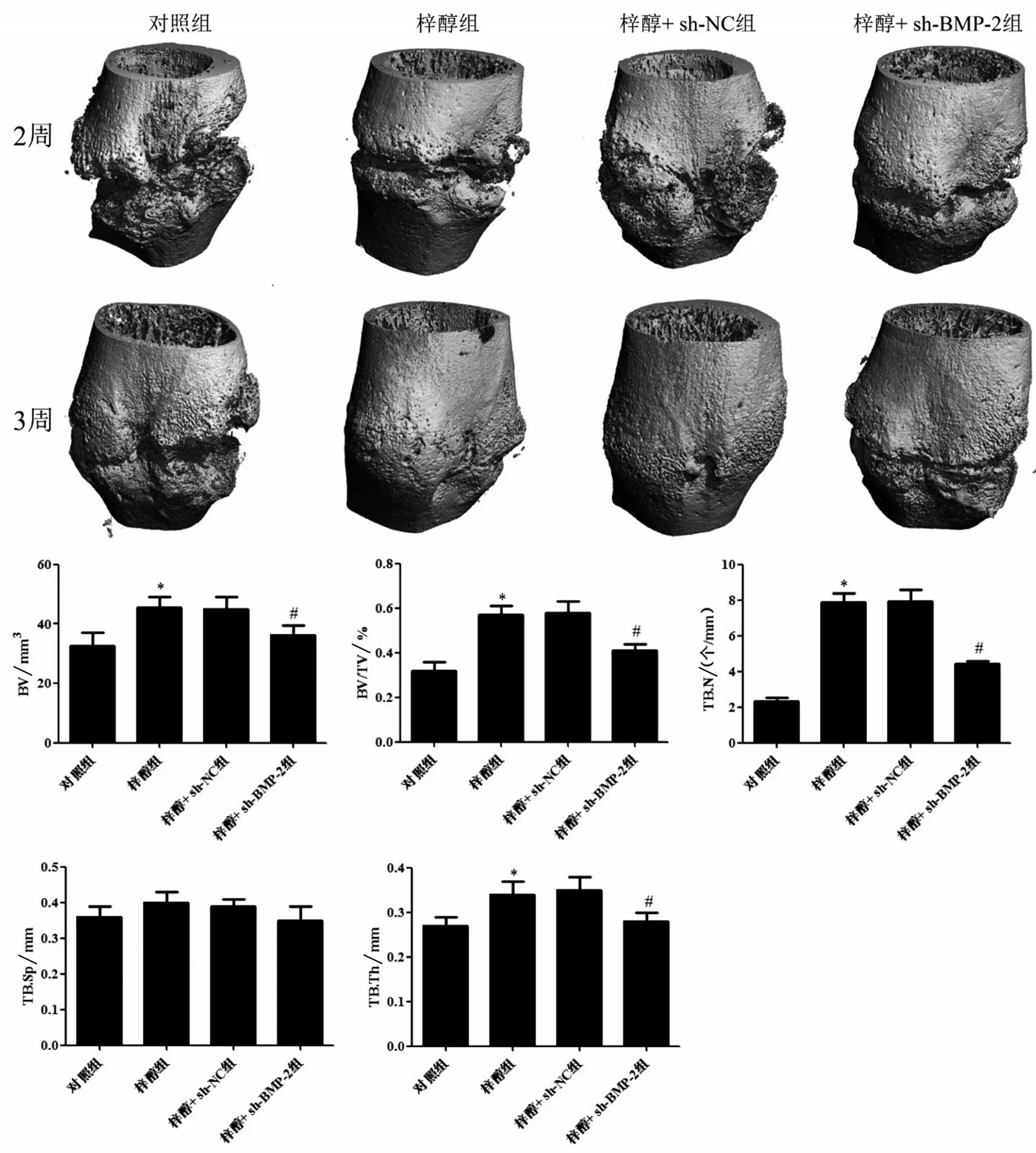
图2 各组大鼠Micro-CT检测指标的比较
2.3 各组大鼠BMP-2蛋白表达的比较
与对照组相比,梓醇组大鼠BMP-2 mRNA和蛋白表达明显升高(P<0.05);梓醇组和梓醇+sh-NC组大鼠BMP-2 mRNA 和蛋白表达差异无统计学意义(P>0.05);与梓醇+sh-NC 组相比,梓醇+sh-BMP-2 组大鼠BMP-2 mRNA 和蛋白表达明显降低(P<0.05),见图3。
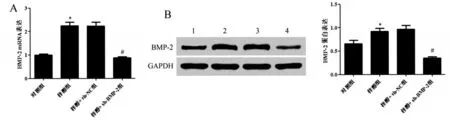
图3 各组大鼠BMP-2蛋白表达
2.4 各组大鼠血清骨代谢指标和成骨相关基因蛋白表达的比较
与对照组相比,梓醇组大鼠ALP 和OCN 水平显著升高(P<0.05),Runx2 和ColⅠ蛋白表达显著升高(P<0.05);梓醇组和梓醇+sh-NC 组大鼠ALP和OCN 水平、Runx2 和ColⅠ蛋白表达差异无统计学意义(P>0.05);与梓醇+sh-NC组相比,梓醇+sh-BMP-2组大鼠ALP和OCN水平显著降低(P<0.05),Runx2和ColⅠ蛋白表达显著降低(P<0.05),见图4。
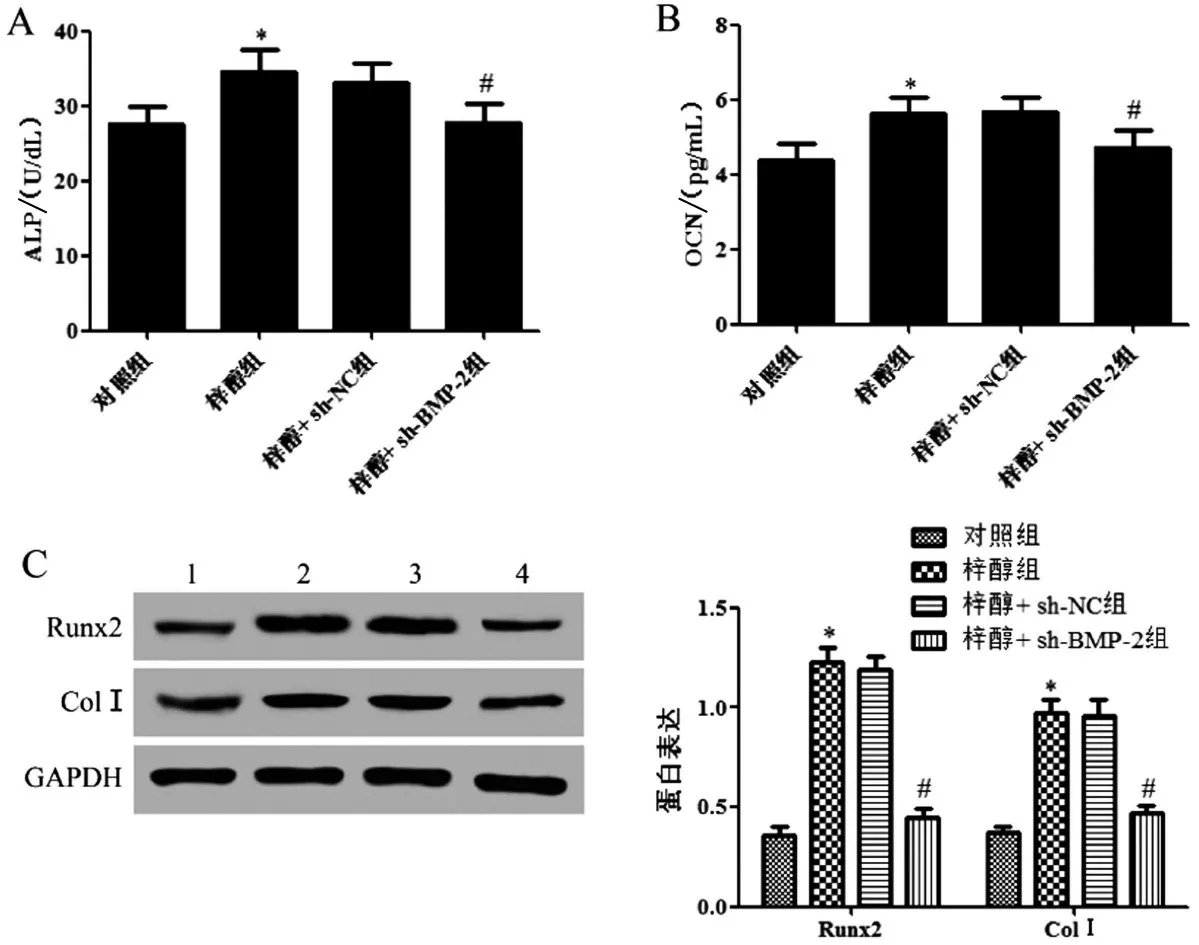
图4 各组大鼠血清骨代谢指标和成骨相关基因蛋白表达的比较
2.5 各组大鼠Wnt/β-catenin 信号通路相关蛋白表达的比较
与对照组相比,梓醇组大鼠β-catenin、cyclinD1和c-myc蛋白表达显著升高(P<0.05);梓醇组和梓醇+sh-NC 组大鼠β-catenin、cyclinD1 和c-myc 蛋白表达差异无统计学意义(P>0.05);与梓醇+sh-NC组相比,梓醇+sh-BMP-2组大鼠β-catenin、cyclinD1和c-myc蛋白表达显著降低(P<0.05),见图5。
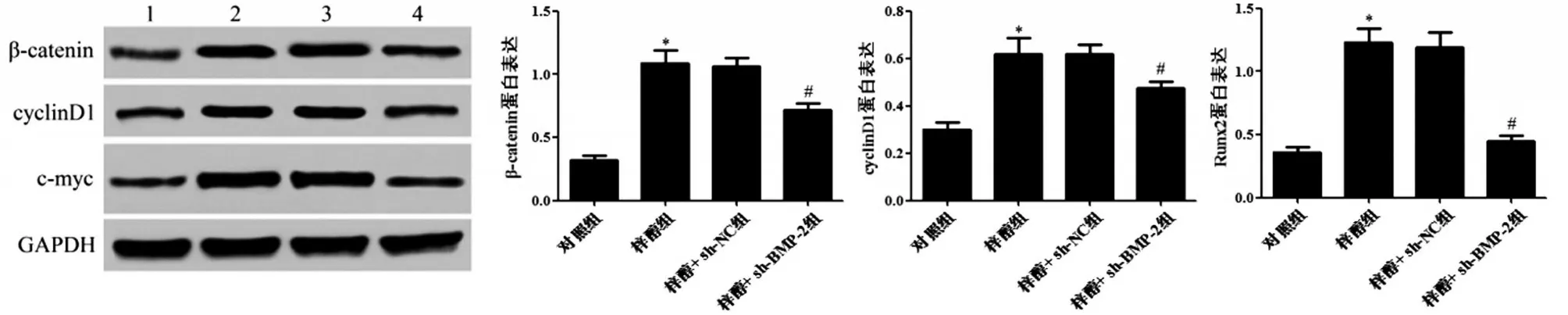
图5 各组大鼠Wnt/β-catenin信号通路相关蛋白表达的比较
3 讨论
骨折愈合是一个复杂、缓慢、长期的病理过程,涉及间充质干细胞的趋化和聚集,成骨细胞的分化和成熟,以及细胞外基质的形成和血管生成[11]。骨折愈合是受损组织的自我修复过程,但各种因素的干预可能会减缓愈合过程或导致骨不连[12]。目前,关于梓醇对骨折的作用及其可能的作用机制尚不明确。本研究结果表明,梓醇通过上调BMP-2表达激活Wnt/β-catenin 信号通路在大鼠股骨骨折愈合过程中起促进作用。
梓醇具有抗炎、抗氧化、抗凋亡和降血糖等多种生物活性[13]。研究表明,梓醇通过抑制核因子κB配体诱导的破骨细胞形成和骨吸收,抑制卵巢切除小鼠的骨丢失。该结果表明,梓醇可能是治疗骨疾病的一种有前途的候选药物[14]。另有研究探讨了梓醇对牙槽骨损伤的保护机制,该研究结果显示,梓醇能减少骨丢失,升高ALP和OCN水平,降低TNFα 和COX-2 的表达,从而减轻尼古丁所致损伤和牙槽骨丢失,促进牙槽骨矿化[15]。本研究结果显示,梓醇可升高大鼠X 线评分、BV、BV/TV、TB.N 和TB.Th,升高大鼠ALP 和OCN 水平,促进骨痂形成、Runx2和ColⅠ蛋白表达,该研究结果与Li等[15]的研究结果一致,说明梓醇可促进大鼠骨折端软骨痂的矿化和吸收,促进骨折愈合。
BMP-2 是调节成骨细胞分化的最重要的细胞因子之一,在胚胎发生、细胞生长、分化到骨发育和骨折修复等多种细胞功能中发挥相关作用。成人骨骼中BMP活性的变化与骨质疏松症、骨关节炎和骨折愈合能力下降有关[16]。证据显示,BMP-2 能促进体外兔骨髓间充质干细胞的增殖和成骨分化。此外,BMP-2 能促进兔桡骨缺损处的骨修复[17]。研究表明,BMP-2联合骨诱导生物陶瓷材料β-磷酸三钙可明显促进拔牙窝骨愈合,减少拔牙窝骨坏死[18]。在体外,丹参酮ⅡA 通过上调BMP-2 增加Runx2 和ColⅠ的表达、ALP 活性和钙沉积,促进小鼠胚胎成骨细胞前体细胞的成骨分化。在体内,丹参酮ⅡA具有促进骨折愈合的作用。该研究结果表明,上调BMP-2在骨折愈合中具有重要作用[19]。本研究结果显示,梓醇治疗可上调股骨骨折大鼠BMP-2蛋白表达。此外,慢病毒介导的BMP-2干扰可逆转梓醇对骨折大鼠骨折愈合的促进作用。结果表明,梓醇通过上调BMP-2表达促进大鼠骨折愈合。
Wnt/β-catenin信号通路在间充质干细胞向脂肪细胞、软骨细胞或成骨细胞分化过程中起着关键作用[20]。β-Catenin 的活性受Wnt 信号转导的控制,由Wnt配体、Fzd和Lrp5/6组成的复合物可稳定细胞质β-Catenin 蛋白并阻止其降解。累积的β-catenin 转运到细胞核,与转录因子LEF/TCF 形成复合物,刺激下游基因c-myc、cyclinD1 和c-jun 的表达[21]。βcatenin 的缺失将使间充质干细胞的成骨分化转变为软骨生成[20]。目前,已有研究表明,DMP-PYT 通过增强BMP-2诱导的β-catenin的活化,在体内外刺激成骨细胞分化和骨形成[22]。此外,证据显示,梓醇在体内外通过激活Wnt/β-catenin 信号通路诱导骨髓间充质干细胞的成骨分化,增加大鼠颅骨缺损模型中骨愈合能力,并减轻卵巢切除模型大鼠骨丢失[23]。因此,梓醇对骨折大鼠的作用可能与调控BMP-2 和Wnt/β-catenin 信号通路有关。本研究结果显示,梓醇处理可上调Wnt/β-catenin 信号通路中β-catenin、c-myc 和cyclinD1 表达。慢病毒介导的BMP-2干扰可逆转梓醇对骨折大鼠β-catenin、c-myc和cyclinD1 表达的促进作用。该研究结果表明,梓醇可能通过上调BMP-2 表达激活Wnt/β-catenin 信号通路促进大鼠股骨骨折愈合。
综上所述,梓醇可能通过上调BMP-2表达激活Wnt/β-catenin信号通路促进大鼠股骨骨折愈合。本研究为明确梓醇对骨折愈合的影响及开发新的骨折治疗药物提供了新的依据。

