抗破伤风毒素单克隆抗体细胞培养基的筛选与优化
叶星,陈继军,王建锋,安晨,宋兰兰,李晓进,毛晓燕
兰州生物制品研究所有限责任公司,甘肃 兰州 730030
单克隆抗体药物作为生物技术药物,对多种复杂的疾病如肿瘤、自身免疫性疾病和感染性疾病等的治疗具有重要作用[1],其市场潜力和经济价值巨大。由于抗体药物的临床治疗剂量较大且治疗周期较长[2],其工业化生产的规模和效率将最终决定其产业化的成败。基于生物反应器的动物细胞大规模培养和抗体质量分析已成为我国抗体药物产业化的主要限制因素。
细胞培养基决定了细胞的生长环境和理化特性,许多研究表明,培养基的成分组成可显著影响细胞的生长代谢、蛋白产量、产品质量等[3-7]。培养基的优化策略应针对最终产品、生产细胞及生产工艺的类型进行综合考虑[8]。
目前国内哺乳动物细胞培养仍以使用进口商业培养基为主,这些培养基的具体组分一般不会公开,使得培养基的筛选与优化在早期即面临许多困难[9]。由于对所使用的培养基成分未知,一旦出现抗体质量问题便无从优化,特别对于生物仿制药的开发,抗体质量的一致性显得尤为重要。因此,动物细胞培养基及其关键组分的研发及细胞培养工艺的优化,对于实现抗体药物低成本、高效率的生产具有重大意义。本研究旨在对抗破伤风毒素单克隆抗体工程细胞株CHO-K1-G2的培养基进行筛选和优化,以期促进细胞株生长及抗体表达,为最终建立经济高效的抗体药物生产工艺奠定基础。
1 材料与方法
1.1 细胞株 抗破伤风毒素单克隆抗体工程细胞株CHO-K1-G2由兰州生物制品研究所有限责任公司第五研究室构建,宿主细胞来源于ATCC。
1.2 主要试剂及仪器 细胞培养基添加成分D(+)-半乳糖、L-天冬氨酸、牛磺酸、L-丙氨酸、L-酪氨酸、L-丝氨酸、L-甲硫氨酸、L-赖氨酸、L-缬氨酸、胸苷、抗坏血酸、腐胺、还原性谷胱甘肽、丙酮酸钠、腺苷、乙醇胺、D-泛酸钙、氯化胆碱、次黄嘌呤、L-精氨酸、卵磷脂购自日本TCI公司,七水合硫酸锌、柠檬酸铁购自美国Sigma公司,所有添加物均用超纯水配成母液,0.22μm微孔滤膜除菌过滤,4℃保存;胎牛血清、胰酶和10%Pluronic F68购自美国Gibco公司;谷氨酰胺、葡萄糖和HRP标记的抗人Fc段抗体购自美国Sigma公司;碳酸盐、氯化钠、硼酸和四硼酸钠购自国药集团化学试剂有限责任公司;脱脂奶购自美国BD公司;ELISA检测试剂盒(洗液、底物A、底物B、终止液)由兰州生物制品研究所有限责任公司诊断试剂室提供;破伤风抗毒素标准品及标准破伤风毒素均由中国食品药品检定研究院提供;EP+Buffer、氨基偶联试剂盒、CM5芯片等均购自美国GE公司;NOVA多参数生化分析仪购自美国NOVA公司。
1.3 实验动物 普通级BALB/c小鼠,雌性,1.5~2月龄,体重17~19 g,由兰州生物制品研究所有限责任公司动物室提供,动物合格证号:SYXK(甘)2017-0001。
1.4 无血清培养基基本信息 试验中选择的初筛培养基信息见表1。所有粉末培养基均用超纯水配制,0.22μm微孔滤膜除菌过滤,4℃保存。
1.5 无血清培养基的筛选 针对本试验中所用CHOK1-G2细胞株,应用批式培养(batch)模式,对表1中9种商业无血清培养基进行筛选,以该细胞株目前正在使用的培养基D作为对照。各培养基所含的葡萄糖浓度均在5 g/L以上,使用前均添加一定的谷氨酰胺,以保证细胞能够快速适应新培养基。
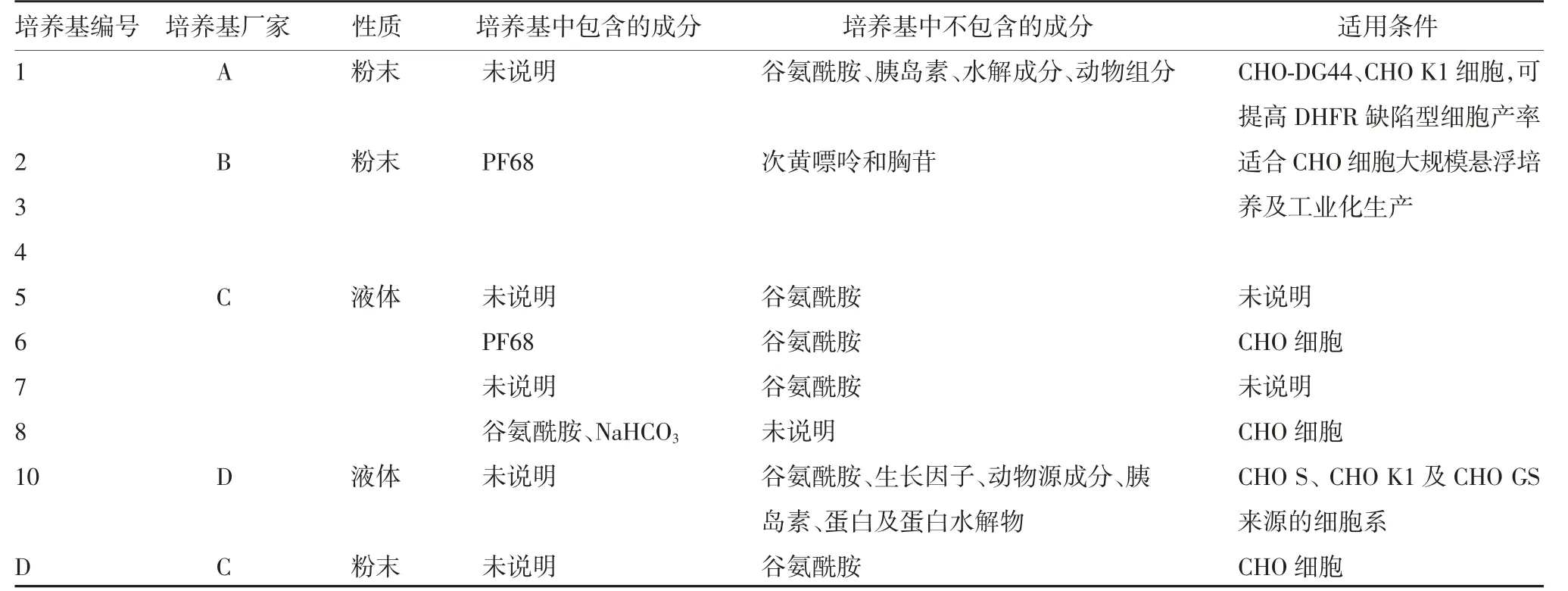
表1 商业无血清培养基使用说明Tab.1 Instructions of commercial serum-free medium
无血清悬浮驯化后的细胞经传代培养,当细胞活率达98%以上,且大小均匀、无明显结团时,接种至50 mL TPP管中,细胞密度为0.5×106cells/mL,工作体积20~25 mL,于37℃,5%CO2,220 r/min的条件下进行培养。监测细胞密度、活率及各代谢参数(葡萄糖、谷氨酰胺、乳酸等)。培养结束后,离心收集细胞培养上清,4℃保存。
初步筛选主要评价指标为细胞密度、活率、生长状态及培养时间,进一步筛选评价指标为抗体表达量、细胞密度、细胞活率及各代谢参数。
1.5.1 细胞培养参数及培养基理化参数测定 使用NOVA多参数生化分析仪测定细胞密度、活率及细胞培养上清中各代谢参数(葡萄糖、谷氨酰胺、乳酸等)。各新鲜培养基的成分参数由Cedex Bio Analyzer进行测定(数据未列出)。
1.5.2 抗体表达量测定 采用ELISA法。将标准破伤风毒素以5μg/mL包被于96孔酶标板中,每孔100μL;次日经脱脂奶4℃封闭过夜后,每孔加入100μL倍比稀释的样品,重复2孔,置37℃孵育1 h,同时设空白孔、阴性对照孔(加入样品稀释液)及阳性对照孔(加入抗破伤风毒素单抗标准品);弃去孔内液体,洗涤后每孔加入100μL HRP标记的抗人Fc段抗体(1∶10 000稀释),37℃孵育1 h;弃去孔内液体,洗涤后依次加入底物溶液A与B各50μL,37℃避光孵育20 min;每孔加入终止液50μL终止反应,于酶标仪波长450 nm处测定吸光度值。
1.6 主要影响因子的筛选 以筛选出的培养基为平台,细胞抗体表达量为评价指标,采用Plackett-Burman试验对23种培养基添加因子进行筛选,分析23种添加因子对细胞生长和蛋白表达的影响。试验依据Minitab软件所设计的矩阵进行,每行代表1个试验(一种培养基),每列代表1个单独的变量(添加因子),1和-1分别代表每个试验中各个变量的高低水平。试验包括3个中心点,用来验证试验的重复性与结果的可靠性,0表示高水平与低水平的均值。各因子代码及添加水平见表2。

表2 Plackett-Burman设计的因子及浓度Tab.2 Factorsand their concentrationsof Plackett-Burman design
1.7 目的蛋白的表达与纯化 将细胞从250 mL摇瓶逐步转移至1 000 mL摇瓶中进行扩大培养。待细胞密度达(3~4)×106cells/mL,且细胞活率在98%以上时,开始fed-batch培养。当培养液中葡萄糖浓度低于2 g/L时,补加至6~8 g/L;谷氨酰胺浓度低于2 mmol/L时,按照培养体积的2%补加(谷氨酰胺浓度为50 mmol/L)。培养结束后,采用ELISA法检测抗体表达量。将上述细胞培养收获液离心并收集上清,超滤浓缩后用Mabselect Sure介质进行亲和纯化,获得目的蛋白。
1.8 抗体效价测定 应用破伤风抗毒素效价测定法(小鼠试验法)。将破伤风毒素用硼酸盐缓冲液稀释至每1 mL含5个试验量,即与抗毒素等量混合后,每0.4 mL注射量中含1个试验量。破伤风抗毒素标准品用硼酸盐缓冲液稀释至每1 mL含0.5 IU,即与毒素等量混合后,每0.4 mL注射量中含1/10 IU,抗毒素标准品原倍溶液的1次吸取量应不低于0.5 mL。将供试品用硼酸盐缓冲液稀释成若干个稀释度,每个稀释度间隔约5%。
在稀释后的抗毒素标准品及不同稀释度的供试品中分别加入等量的稀释毒素溶液,混匀,37℃结合1 h,立即经小鼠腹部或大腿根部皮下注射0.4 mL,标准品与供试品每个稀释度各注射小鼠5只,连续观察5 d,记录小鼠发病与死亡情况。结果判定:对照小鼠应于72~120 h内全部死亡,供试品效价为与对照组小鼠同时死亡或出现破伤风神经毒症状最重者的最高稀释浓度。
1.9 抗体亲和常数测定 采用表面等离子共振(surface plasmon resonance,SPR)技术测定破伤风类毒素与CHO-K1-G2细胞培养所得抗体的亲和常数。先用氨基偶联法将抗人IgG1 Fc抗体偶联在CM5芯片上,然后用该抗体捕获一定量的目的蛋白,再将梯度浓度的破伤风类毒素相继流过目的蛋白表面,记录传感图谱。利用随机软件BIAevalution对不同破伤风类毒素浓度下的各条结合曲线进行分析,计算目的蛋白对破伤风类毒素的亲和常数。
2 结果
2.1 无血清培养基的初步筛选 CHO-K1-G2细胞株在9种商业无血清培养基中进行batch培养,从细胞密度、生长状态、细胞活率、培养时长等因素进行选择,确定2、3、6、7号培养基进入下一轮筛选,见表3。

表3 9种无血清培养基的初步筛选结果Tab.3 Preliminary screening of nine serum-free media
2.2 无血清培养基的进一步筛选
2.2.1 抗体表达量、细胞密度及细胞活率分析 CHOK1-G2细胞在2号培养基中的抗体表达量最高,同厂家的3号培养基抗体表达量相对较低,细胞密度及活率也略低;6号、7号培养基最大细胞密度较高,但7号培养基的细胞活率下降相对较快,培养时间短;对照组细胞密度、活率及培养时间均低于各试验组。见图1~图3。

图1 CHO-K1-G2细胞在5种无血清培养基中的抗体表达量Fig.1 Antibody expression levels of CHO-K1-G2 cells in five serum-free media

图3 CHO-K1-G2细胞在5种无血清培养基中的细胞活率Fig.3 Viabilities of CHO-K1-G2 cells in five serum-free media
2.2.2 细胞的营养代谢分析
2.2.2.1 葡萄糖浓度变化 整个batch培养过程中不同培养基中葡萄糖浓度均趋于下降。2、3、7号培养基趋势相似,细胞对葡萄糖消耗较快,其浓度在第8天降至最低点,此时正好达到最大细胞密度,之后细胞密度和活率均开始下降,表明葡萄糖对这些培养基中细胞的生长及蛋白生产具有较大影响;6号和D培养基趋势一致,整个培养过程中细胞持续缓慢消耗葡萄糖,表明细胞生长及蛋白生产可能还依赖于其他的能源物质。见图4。

图4 5种无血清培养基中葡萄糖浓度的变化Fig.4 Changes of glucose concentration in five serum-free media
2.2.2.2 乳酸浓度变化 2、3、7号培养基在batch培养第6天后,乳酸浓度呈下降趋势,表明因葡萄糖浓度下降,细胞开始摄取乳酸以维持自身生长与蛋白生产;6号和D培养基中乳酸呈缓慢累积的过程,培养结束时,乳酸浓度均大于2.5 g/L,表明该培养基中细胞并不能主动摄取乳酸作为能源物质,且乳酸的累积也会对细胞生长及蛋白生产产生不利影响。见图5。

图5 5种无血清培养基中乳酸浓度的变化Fig.5 Changes of lactic acid concentration in five serumfree media
2.2.2.3 谷氨酰胺浓度变化 2、3号培养基中细胞对谷氨酰胺的消耗较缓慢,在第8天降至1.80 mmol/L,此后一直维持该浓度至培养结束,表明细胞对谷氨酰胺的利用率较低;6、7号培养基中谷氨酰胺在第4天即低于1.5 mmol/L(由于这6种培养基中谷氨酰胺初始含量较低,均已预先补加2%50 mmol/L谷氨酰胺),表明细胞生长消耗了大量谷氨酰胺;D培养基中谷氨酰胺的水平一直为0.00 mmol/L,表明该培养基中细胞对谷氨酰胺的需求量非常大。见图6。
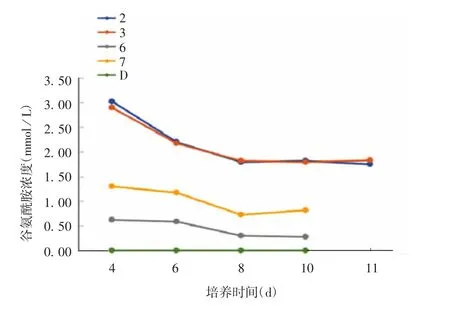
图6 5种无血清培养基中谷氨酰胺浓度的变化Fig.6 Changes of glutamine concentrations in five serumfree media
通过对以上数据的分析,2号培养基中细胞的蛋白产量较高,细胞生长状况良好,最终确定2号培养基作为后续优化的基础培养基。在后续优化过程中,应考虑促进细胞对谷氨酰胺的利用,以进一步提高细胞密度,同时注意氨的累积及渗透压的变化。
2.3 试验设计(D es i g n o f E x pe r im e nt s,D O E)优化无血清培养基
2.3.1 Plackett-Burman设计筛选主要影响因子以细胞的抗体表达量作为响应值,Plackett-Burman设计用27次试验考察了23种化合物对蛋白表达的影响,Minitab软件设计的试验矩阵及结果见表4,各种因子的浓度及对蛋白生产的影响见表5,抗体表达量范围为53.90~222.42 mg/L。对于该实验模型,自由度为24,相关系数R-Sq为99.60%,F=20.82,P=0.047<0.05,表明此模型具有显著性。P<0.05的因子则具有显著性影响。效应参数为正,表明因子对响应值有积极作用;参数为负,表明因子对响应值有消极作用。乙醇胺、次黄嘌呤、卵磷脂、天冬氨酸、柠檬酸铁及牛磺酸的P<0.05,且效应参数为正值,表明它们对蛋白表达具有显著正影响作用,可作为培养基的添加物;效应参数越大,影响越显著,按照影响作用大小依次为次黄嘌呤、牛磺酸、乙醇胺、卵磷脂、柠檬酸铁和天冬氨酸。但需注意的是,Plackett-Burman设计并不能反应变量之间的相互作用。
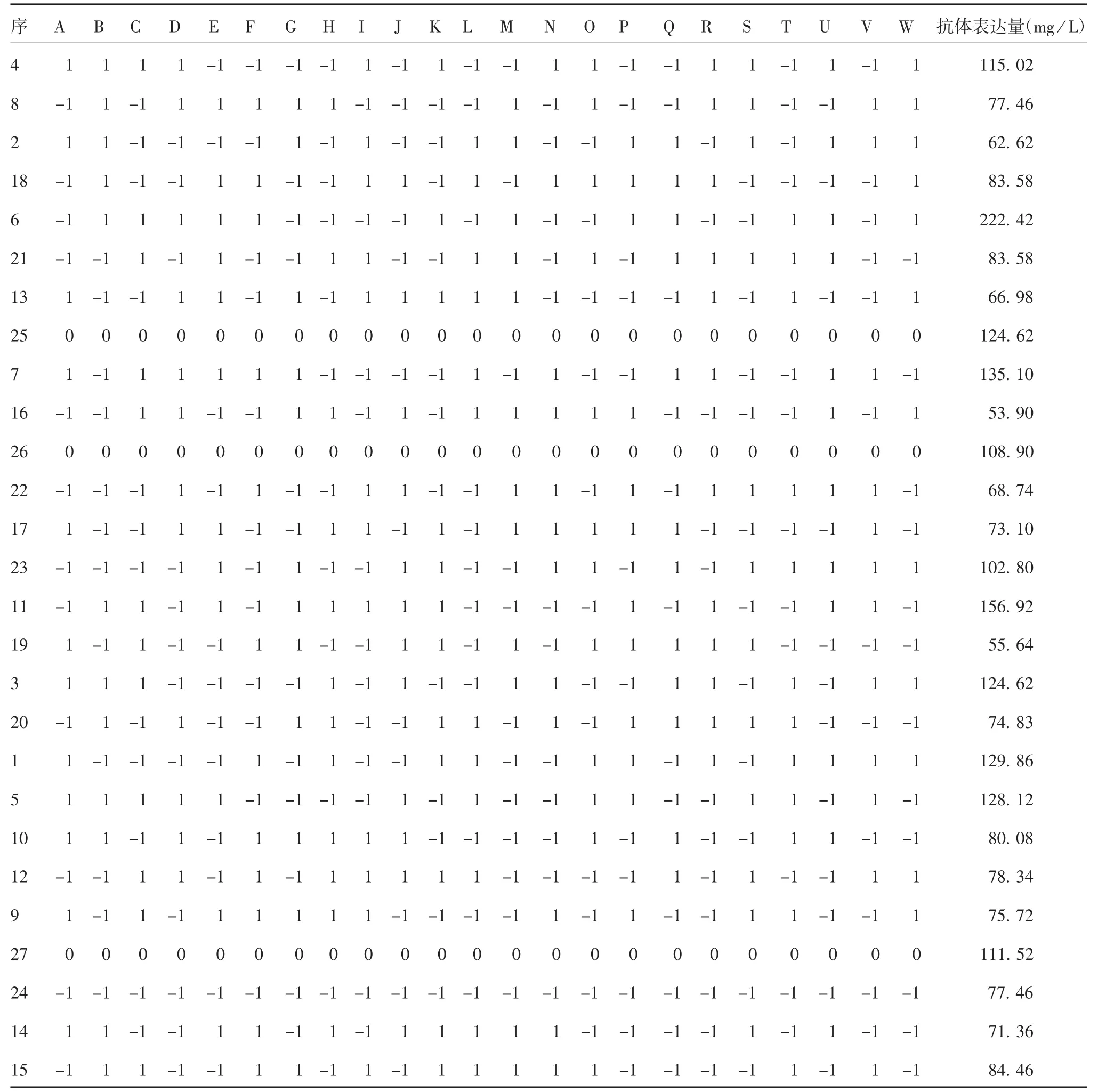
表4 Plackett-Burman试验设计矩阵及响应值Tab.4 Plackett-Burman matrix of experimental design and responses

表5 Plackett-Burman筛选统计分析结果表Tab.5 Plackett-Burman screening variance table
2.3.2 Minitab软件得到最优值 筛选出具有显著影响的因子后,用优化设计方法确定响应值的最优值及各因子的最优组合。Minitab提供了一种优化方法,可通过试验分析给出输出变量的最优值及其对应的各试验因素的最优组合。此次优化的主要对象为细胞表达量,优化的目的是得到最大响应值,以Plackett-Burman设计中所得到的响应值范围53.90~222.42 mg/L分别作为优化的下限与目标值,响应上限不设限,权重:1,重要度:1。软件计算得到的结果见表6,此为各因素的最优组合;同时得到细胞表达量最优拟合值238.22 mg/L。
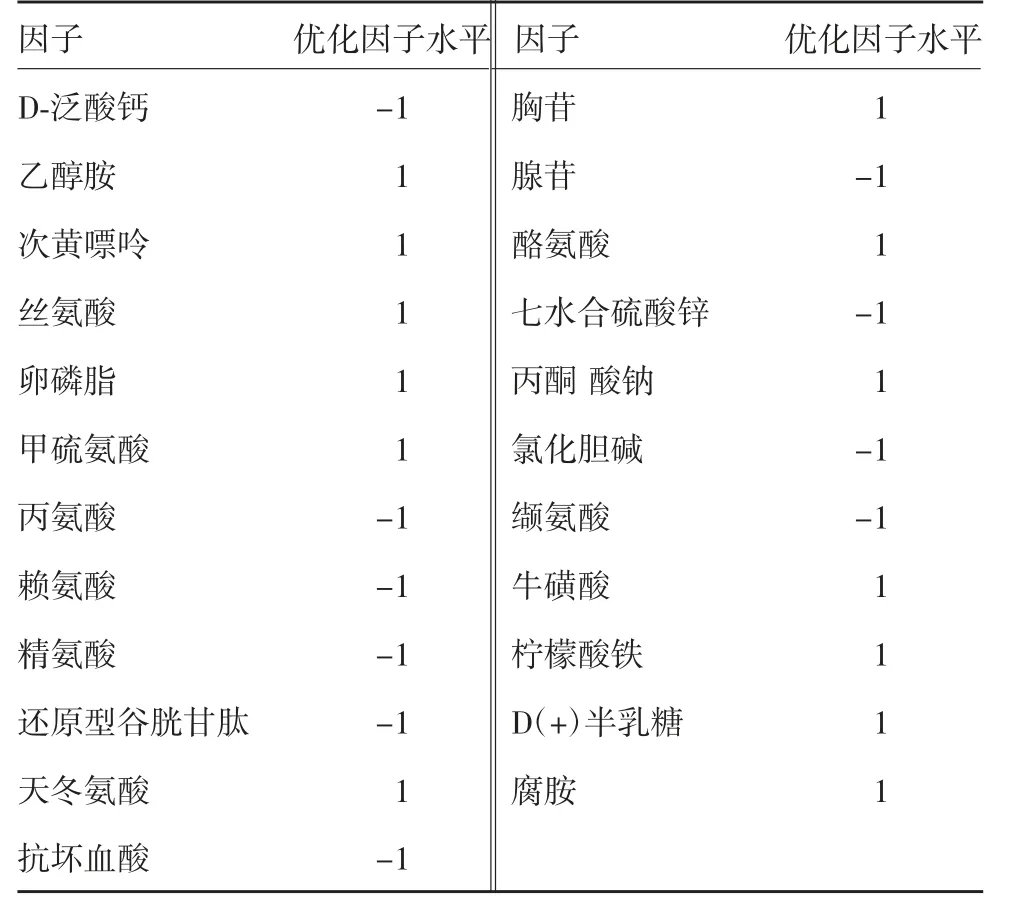
表6 各因素最优组合表Tab.6 Optimization of various factors and levels
2.4 抗体表达量 应用筛选出的2号培养基进行fed-batch扩大培养,最终收获液中抗体表达量为124 mg/L。
2.5 抗体效价 对照组小鼠死亡时间为96 h,表明试验结果成立。CHO-K1-G2细胞培养所得抗体效价为500 IU/mg。
2.6 抗体亲和常数 破伤风类毒素与抗体的梯度结合曲线见图7。以“1:1 Binding”的分析模块进行计算,得到的动力学常数分别为:ka(1/Ms)=2.15×105,kd(1/s)=2.85×10-4,因此,亲和常数Ka=ka/kd=1.33×10-9/M。
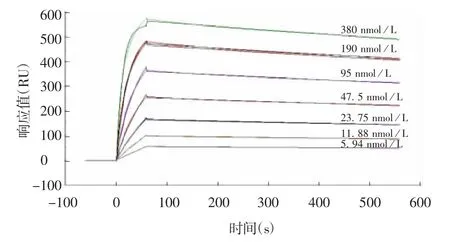
图7 破伤风类毒素与抗体的梯度结合曲线Fig.7 Gradient binding curve of tetanus toxoid and antibody
3 讨论
3.1 筛选培养基的考虑因素及细胞代谢分析 在培养基的初步筛选中,所参考的主要指标是最大细胞密度、细胞活率变化及培养周期的长短。进一步筛选时,此时各培养基中细胞的生长状况相近,因此增加了抗体产量作为评价指标。同时根据培养基中一些营养物质及副产物的变化,分析细胞的代谢需求,选择适合优化的培养基。
在batch培养中,2号和3号培养基中细胞以葡萄糖为主要能源物质,且葡萄糖不足时能主动消耗副产物乳酸,减少了乳酸造成的不利影响,同时细胞对谷氨酰胺的消耗较少,副产物氨的产生较少,这可能是细胞活率及蛋白产量较高的原因;但细胞生长时对谷氨酰胺的利用率较低可能导致其最大细胞密度相对较低;3号培养基的蛋白产量低可能与氨的产生或渗透压等其他因素有关。
6号培养基中细胞消耗了大量的谷氨酰胺,最大细胞密度较高,但同时副产物氨的产生也较多;结合葡萄糖代谢发现,细胞对葡萄糖的消耗较少,且乳酸有一定程度累积,因此葡萄糖的利用率低及两种副产物的累积可能对其蛋白产量影响较大。7号培养基中细胞对葡萄糖及谷氨酰胺的消耗均很大,且能够主动利用乳酸,最大细胞密度较高;但蛋白产量很低,表明该培养基中的细胞较蛋白生产而言,自身的生长消耗了更多的营养物质。D培养基中细胞对谷氨酰胺的消耗很大,表明氨的累积也较多,对葡萄糖的消耗相对较少,且乳酸轻度累积,其细胞密度及活率均较低,表明该培养基中细胞以谷氨酰胺为主要的能源物质,且副产物累积及渗透压等因素对细胞生长影响较大。
葡萄糖和谷氨酰胺作为细胞重要的能源物质,对细胞生长及蛋白生产具有显著影响。它们的代谢副产物—乳酸和氨的过度累积,可能会对细胞生长及蛋白生产造成诸多不利影响,如渗透压的升高、限制细胞的生长及活率、改变单抗的糖基化修饰,甚至增加产品的降解等。WAHRHEIT等[10]研究了谷氨酰胺的利用与限制对CHO细胞生理的影响,发现谷氨酰胺利用率的不同会导致整体代谢的改变。
减少乳酸累积有很多方法,如改造宿主细胞[11];或用其他代谢较慢或乳酸产率较低的糖代替葡萄糖;添加铜离子也可降低乳酸的累积[12]。就大规模生产工艺来说,可通过调控培养过程中的pH环境、CO2含量或搅拌速率等减少乳酸累积[13]。另一方面,在促进细胞对葡萄糖有效利用的同时,如何促进其对乳酸的消耗[14-15],也是培养过程中需要考虑的问题。
除了本试验中所提到的葡萄糖、谷氨酰胺外,培养基中氨基酸的含量也是影响细胞生长与蛋白生产的重要因素。培养基中部分氨基酸(如天冬酰胺、丝氨酸等)过量时也会增加氨的累积,可在不影响细胞生长及蛋白生产的前提下对培养基中氨基酸的组成进行调控,以减少氨的产生[16]。
3.2 培养基优化策略及蛋白产量的变化 本试验中所选择的添加物及其试验浓度范围,是查阅大量文献后经若干轮预试验确定的。Plackett-Burman筛选试验能够极大地缩短试验时间,提高筛选效率,但前提是选择合适的浓度范围。此外,响应值的选择也很重要。刚开始选择最大细胞密度作为响应,由于响应值差异不大,未筛选到显著因子。后改用抗体表达量作为响应值,成功筛选到6种显著性影响因子。本试验所得到的只是一个大概的浓度范围,如需进一步确定各因子准确的添加浓度,还需结合最速上升法[17]及中心复合设计[18]等方法进行多轮优化。
培养基的进一步筛选过程中,与对照培养基相比,CHO-K1-G2细胞在2号培养基中batch培养下的抗体表达量提高了3.8倍。Plackett-Burman设计的27组试验中,CHO-K1-G2细胞最高抗体表达量显著提高,表明适宜的添加物可促进细胞的生长与表达。对于目的蛋白的表达,培养基的筛选只是一个方面,培养条件的变化也是重要因素,这在培养规模发生较大改变时尤为突出。因此,在进行规模放大时,还需进行培养工艺的优化。

