牛病毒性腹泻病毒Npro基因克隆、生物信息学分析及其表达鉴定
王丽,马骏,吴陈华,黄雯静,高丽,付金蕾,赵童,刘思雨,岳山,刘宇,翟军军,朱战波
1.黑龙江八一农垦大学动物科技学院,黑龙江 大庆 163319;2.黑龙江省牛病防控工程技术研究中心,黑龙江 大庆 163319
牛病毒性腹泻病毒(bovine viral diarrhea viruses,BVDV)属于黄病毒科瘟病毒属成员,主要导致牛腹泻、白细胞减少、持续性感染、免疫抑制、产奶量降低和生殖问题等[1],该病呈世界性分布,给养牛业造成了巨大的经济损失[2]。BVDV为单股正链RNA,通常基于5′-UTR序列、基因组N-端自身蛋白酶(Npro)或包膜糖蛋白(E2)区域分为BVDV-1和BVDV-2型[3]。有报道,第3种遗传物种BVDV-3被描述为非典型的BVDV[4]。BVDV-1进一步分为21个亚型(1a~1u),BVDV-2分为3个亚型(2a~2c)。目前中国主要流行8个亚型:1a、1b、1c、1d、1m、1o、1p和1q[5]。
BVDV基因组包括4种结构蛋白(C、E0、E1和E2)和8种非结构蛋白(Npro、P7、NS2-3、NS4A、NS4B、NS5A和NS5B)[6-7]。Npro蛋白为ORF中编码的第1种蛋白质,具有蛋白酶活性,可从多聚蛋白链上自我裂解下来发挥作用,其Cys69和His130是蛋白酶活性中心的2个位点,可催化Tyr164和Vail65间肽键的断裂。Npro蛋白在瘟病毒属中具有高度的保守性,可通过比较分析该基因序列对BVDV及瘟病毒属其他成员的种、群、型进行确定[8],但目前尚不能完全解释其蛋白水解作用及免疫抑制机理。本文对BVDV Npro基因进行扩增、生物信息学分析、原核表达及免疫原性检测,旨在为研究Npro蛋白的功能奠定基础。
1 材料与方法
1.1 病毒株、菌株、细胞及质粒 BVDV-1 NADL株、E.coli DH5α和BL21(DE3)感受态细胞、pET-28a质粒、pcDNA3.1-Npro质粒、pcDNA3.1空载体、293T细胞均由黑龙江八一农垦大学动物传染病病原学与生物安全实验室保存并提供;pMD18-T购自宝日医生物技术有限公司。
1.2 实验动物 SPF级昆明小鼠,6周龄,雌性,体重18~20 g,购自吉林省实验动物中心,动物合格证号:SCXK2016-0006。
1.3 主要试剂及仪器 高保真Taq酶购自宝日医生物技术有限公司;胶回收试剂盒购自北京安诺伦生物科技有限公司;质粒小量提取试剂盒购自天根生化科技(北京)有限公司;EcoRⅠ和XhoⅠ限制性内切酶、FITC标记的羊抗鼠IgG购自赛默飞世尔科技有限公司;鼠源单抗Anti-His标签抗体、HRP标记的山羊抗小鼠二抗购自北京中杉金桥生物技术有限公司;IPTG购自上海桥星贸易有限公司;Ni-NTA柱购自金斯瑞生物有限公司。
1.4 引物设计及合成 根据GenBank上登录的BVDV Npro基因(NC-001461.1)设计引物,序列如下:F:5′-CGGAATTCATGGAGTTGATCACAAATGAACTTTTATACAAAACATACA-3′(下划线部分为EcoRⅠ酶切位点);R:5′-TGCTCGAGGCAAGTTGTGACCCATAGA-3′(下划线部分为XhoⅠ酶切位点)。引物由生工生物工程(上海)股份有限公司合成。BVDV Npro基因全长为504 bp,编码168 aa。
1.5 Npro基因的扩增 以BVDV-1 NADL株基因组为模板扩增Npro基因。反应体系(50μL):模板2μL,上下游引物各1μL,10×bufferⅡ5μL,dNTPs5μL,高保真Taq酶1μL,用无菌去离子水补足体积。以2μL无菌去离子水为模板作为阴性对照。反应条件:94℃5 min;94℃30 s,59℃30 s,72℃1 min,30个循环;72℃5 min。PCR产物进行1%琼脂糖凝胶电泳鉴定,按胶回收试剂盒说明书纯化回收。
1.6 重组克隆质粒p M D-18T-Npro的构建 将纯化回收的PCR产物与pMD18-T克隆载体连接,构建pMD18-T-Npro重组质粒,转化至E.coli DH5α感受态细胞,涂布氨苄抗性(终浓度100 mg/L)LB固体培养基,37℃培养后挑单个菌落继续培养12 h;提取质粒进行双酶切(EcoRⅠ/XhoⅠ)鉴定,并送生工生物工程(上海)股份有限公司测序。
1.7 Npro基因进化树的构建及生物信息学分析 将目的基因测序进行BLAST同源性分析,用MEGA 6.0软件采用邻近法构建系统发育树;利用ExPASy服务器上的ProtParam工具预测蛋白相对分子质量、原子组成、原子数、等电点、亲水性或疏水性;采用TMHMM server 2.0在线工具进行跨膜区预测分析;使用SignalP 4.1服务器对蛋白序列进行信号肽的预测分析;运用Raptor(http://raptorx.uchicago.edu/Structure Prediction/predict/)预测蛋白的二级及三级结构。
1.8 重组原核表达质粒的构建 将测序正确的阳性质粒pMD18-T-Npro及pET-28a载体分别经EcoRⅠ和XhoⅠ双酶切,胶回收酶切产物,16℃连接过夜;连接产物转化至E.coli BL21(DE3)感受态细胞中,涂布卡那抗性(终浓度100 mg/L)LB固体培养基,37℃培养13h;挑取菌落至卡那抗性(终浓度100mg/L)LB液体培养基,培养12 h;少量摇菌后小提质粒,进行PCR及双酶切(EcoRⅠ/XhoⅠ)鉴定,并送生工生物工程(上海)股份有限公司测序。鉴定正确的阳性质粒命名pET-28a-Npro。
江苏乡村旅游起步早,发展速度快,发展水平已经从粗放复制走进优质提升的新阶段,呈现出品质化、特色化、融合化发展的趋势。江苏具有深厚的文化底蕴和得天独厚的生态旅游资源,乡村旅游产品已经从“观光农家乐”的简单模式发展成为“休闲度假”的体验模式,乡村旅游已基本形成了依托江南文化底蕴、经营农事、特色农耕文明与现代文明融合发展的格局,充分满足了自驾旅游者自由休闲的度假需求。同时,今年清明和端午小长假期间,江苏各地乡村旅游市场火爆,根据旅游大数据显示,乡村族游中跨省跨市出行比例达56%,每月到乡村旅游一次的游客比例达46%。
1.9 Npro蛋白的表达及可溶性分析 将鉴定正确的重组表达质粒转化至E.coli BL21(DE3)感受态细胞中,挑取单菌落至氨苄抗性(终浓度100 mg/L)液体LB中,37℃,180 r/min振荡培养至菌液A600约为0.6时,加入IPTG至终浓度为1 mmol/L,37℃培养箱振荡培养4 h;收集菌液,7 000×g离心10 min;弃上清,沉淀用PBS(pH 7.4)重悬,冰浴超声破碎30 min;4℃,10 000×g离心10 min,收集上清及沉淀进行12%SDS-PAGE分析。
1.10 重组蛋白的W es t e rn blot分析 将表达产物经12%SDS-PAGE分离后,经半干转膜仪转移至NC膜上,5%脱脂乳室温封闭2 h;以鼠源单抗Anti-His标签抗体作为一抗(1∶2 000稀释),4℃孵育过夜;TBST洗涤3次,加入HPR标记的羊抗鼠IgG作为二抗(1∶8 000稀释),室温孵育1 h;TBST洗涤3次,DAB显色。
1.11 重组蛋白的纯化及多抗制备 将细菌沉淀用1×PBS重悬,超声法破碎,4℃,10000×g离心10 min;收集包涵体,1×PBS洗涤包涵体2~3次,LE Buffer溶解包涵体(100 mmol/L Na2HPO4,10 mmol/L Tris-HCl,8 mol/L Urea,pH 8.0),混匀,室温孵育30~60 min;4℃,12 000×g离心30 min;收集上清,弃沉淀,经0.45μm滤膜过滤后,加入平衡好的Ni-NTA树脂中,让样品缓慢流出,先用5~10倍柱体积的LE Buffer冲洗柱子,再用5~10倍柱体积的Wash Buffer(100 mmol/L Na2HPO4,10 mmol/L Tris-HCl,20 mmol/L imidazole,8 mol/LUrea,pH 8.0)洗涤,最后用Elution Buffer(100 mmol/L Na2HPO4,10 mmol/L Tris-HCl,200 mmol/L imidazole,8 mol/L Urea,pH 8.0)洗脱,每次加入1 mL,收集洗脱液,洗脱至检出无蛋白。取各管收集液进行12%SDSPAGE分析。按Ni-NTA亲和层析说明书纯化蛋白。将纯化的Npro蛋白与等体积完全弗氏佐剂混匀乳化后,按照50 ng剂量皮下注射小鼠进行初免,每隔2周加强免疫1次,用50 ng重组Npro蛋白与不完全弗氏佐剂1∶1混合分别作为2、3免抗原。3次免疫后第7天,经眼球采血,分离血清,-80℃保存备用。
1.12 多克隆抗体效价的检测及其蛋白反应原性鉴定 采用ELISA法检测抗体效价,以纯化的Npro蛋白作为包被抗原,4℃过夜包被ELISA板,500 ng/孔;以制备的鼠抗Npro蛋白多克隆抗体为一抗(1∶8 000倍比稀释),HPR标记的羊抗鼠IgG(1∶8 000稀释)为二抗,用酶标仪检测A450值。计算阳性血清与阴性血清的A450比(P/N),当P/N≤1.5为阴性,1.5<P/N<2.1为可疑,P/N≥2.1为阳性。将P/N≥2.1时所对应的抗体最高稀释倍数作为抗体效价。采用Western blot法鉴定免疫原性,具体分析方法同1.10项,用分离血清作为一抗。
1.13 多克隆抗体的特异性鉴定 采用间接免疫荧光试验,将pcDNA3.1空载体和pcDNA3.1-Npro质粒分别转染至293T细胞中,用制备的鼠抗Npro多克隆抗体作为一抗(1∶500稀释),室温孵育1 h;以FITC标记的羊抗鼠IgG作为二抗(1∶100稀释),室温孵育1 h;封片,观察荧光。
2 结果
2.1 Npro基因P C R扩增产物的鉴定 扩增产物经1%琼脂糖凝胶电泳分析,在504 bp处可见明显目的条带,大小与预期相符,见图1。
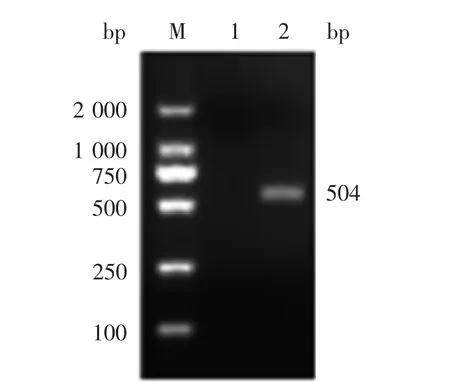
图1 Npro基因PCR扩增产物电泳图Fig.1 Electrophoretic profile of PCR product of Npro gene
2.2 重组质粒p M D-18T-Npro的鉴定 质粒的双酶切产物经1%琼脂糖凝胶电泳分析,可见约3 000 bp的载体片段和504 bp的目的基因Npro片段,见图2。测序结果与原序列一致。
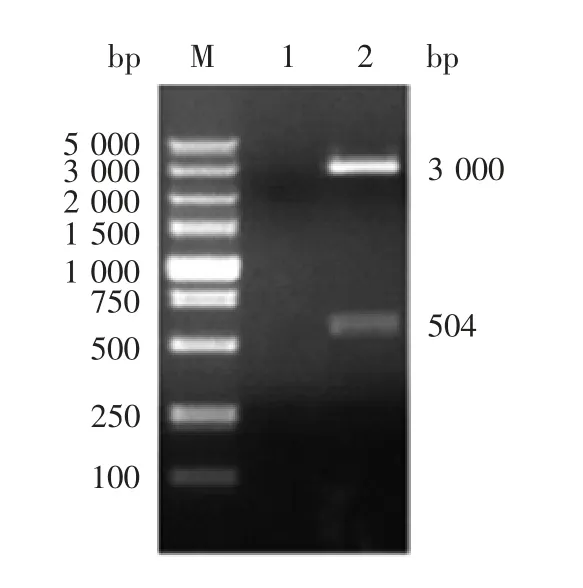
图2 重组质粒pMD-18T-Npro的双酶切(EcoRⅠ/XhoⅠ)鉴定Fig.2 Restriction map of recombinant plasmid pMD-18TNpro(EcoRⅠ/XhoⅠ)
2.3 Npro基因进化树的构建及结构预测 将BVDV NADL株Npro基因苷酸序列经NCBI上的BLAST检索比对,应用MEGA 6.0软件构建系统发育树,结果显示,NADL株的Npro基因与BVDV V026株Npro基因同源性最近,达99%,并在同一分支,表明NADL株的Npro基因与BVDV V026株Npro基因具有相似的生物学功能,见图3。利用ExPASy服务器上的Prot-Param工具分析得知,Npro蛋白为亲水性蛋白,原子组成C850H1333N239O243S8,原子总数2 673个,共有168个氨基酸,相对分子质量为19 044.87,等电点为9.01;利用TMHMM server 2.0在线工具对Npro蛋白进行跨膜区分析,显示Npro蛋白的全部氨基酸位于细胞膜表面,表明Npro是一种外膜蛋白;使用SignalP 4.1服务器对信号肽进行预测分析,发现该蛋白不存在信号肽;运用Raptor在线工具对二、三级结构进行预测,结果显示,α螺旋占1%,β折叠占30%,无规则卷曲占69%,二级结构主要以β折叠与无规则卷曲为主,见图4。

图3 Npro基因系统发育树Fig.3 Phylogenetic tree of Npro gene
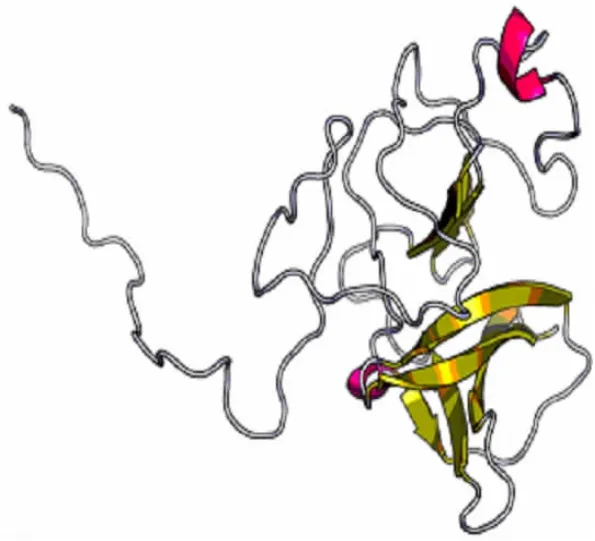
图4 Npro蛋白三维模型构建示意图Fig.4 Three-dimensional modeling of Npro protein
2.4 重组表达质粒p E T-28a-Npro的鉴定 质粒经PCR及双酶切鉴定,在504 bp处可见明显的目的条带,大小与预期相符,见图5。测序结果与原序列一致。
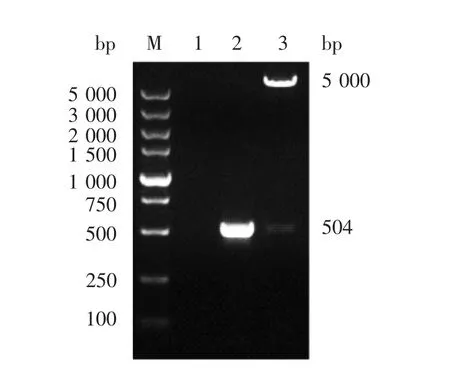
图5 质粒pET-28a-Npro的PCR及双酶切(EcoRⅠ/XhoⅠ)鉴定Fig.5 Identification of plasmid pET-28a-Npro by PCR and restriction analysis(EcoRⅠ/XhoⅠ)
2.5 表达产物的S D S-P A G E鉴定 结果显示,在沉淀样品中能正确表达带有His标签的重组Npro蛋白,相对分子质量约25 000,与预期相符,见图6。
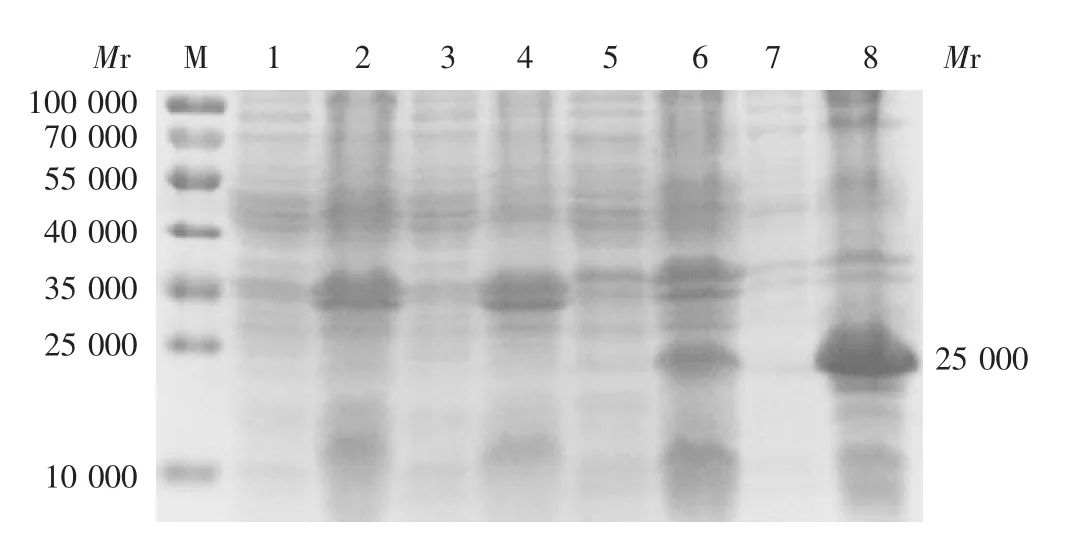
图6 表达产物的SDS-PAGE分析Fig.6 SDS-PAGE profile of expressed protein
2.6 表达产物的W es t e rn blot鉴定 结果显示,表达的重组Npro蛋白能被鼠源Anti-His标签抗体识别,见图7。

图7 Npro蛋白的Western blot鉴定Fig.7 Western blotting of Npro protein
2.7 纯化产物的S D S-P A G E鉴定 结果显示,在相对分子质量约25 000处可见较单一的目的条带,大小与重组Npro蛋白一致,纯度达95%以上,见图8。

图8 纯化产物的SDS-PAGE分析Fig.8 SDS-PAGE profile of purified protein
2.8 鼠抗Npro蛋白多克隆抗体效价 ELISA结果显示,当血清稀释倍数达到1∶128 000时,鼠抗Npro蛋白多克隆抗体的A450为1.457,且P/N>2.1,抗体效价为128 000,见图9,表明制备的鼠抗Npro蛋白多克隆抗体效价较高。

图9 多克隆抗体效价的ELISA检测Fig.9 ELISA of titer of polyclonal antibody
2.9 Npro蛋白的反应原性 Western blot分析显示,重组Npro蛋白能与鼠抗Npro多克隆抗体血清发生特异性反应,反应原性较好,而pET-28a诱导菌未发生特异性反应,见图10。

图10 Npro蛋白反应原性的Western blot鉴定Fig.10 Identification of reactogenicity of Npro protein by Western blot
2.10 鼠抗Npro多克隆抗体的特异性 间接免疫荧光试验结果显示,抗Npro蛋白能够识别在293T细胞中表达的Npro蛋白,而转染pcDNA3.1空载体的细胞中仅见少量非特异性的荧光标记,见图11。

图11 鼠抗Npro多克隆抗体特异性的间接免疫荧光试验(×20)Fig.11 Indirect IFA of specificity of mouse polyclonal antibody against Npro(×20)
3 讨论
BVDV属于黄病毒科(Flaviviridae)瘟病毒属成员,包括4种结构蛋白和8种非结构蛋白[9],而非结构蛋白Npro是瘟病毒的关键效应蛋白,具有高度的保守性及蛋白酶活性,但不是病毒复制所必需的。研究表明,BVDV非结构蛋白Npro通过泛素化途径降解BoELF4负调控Ⅰ型干扰素的表达[10];使用CSFV Npro的细胞系验证Npro蛋白的存在使IRF3表达减少,表明瘟病毒特有的这种单一病毒蛋白可在先天免疫系统中抑制干扰素的产生[11];Npro蛋白在细胞培养中通过抑制Ⅰ型干扰素来干扰先天免疫抑制,这种免疫抑制可能与免疫耐受和BVDV中持续感染(persistent infection,PI)的发展有关[12]。但目前尚不能完全解释其蛋白水解作用及免疫抑制机理。
李慧昕等[13]将BVDV Npro基因克隆至原核表达载体pGEX-6p-1上,并转化至相应的宿主大肠埃希菌BL21(DE3)中,获得了高效表达,但用Western blot法未能检测到蛋白的反应条带,推测这种蛋白可能存在构象表位。本研究通过PCR法扩增BVDV Npro基因,并将该基因与表达载体pET-28a连接,转化至大肠埃希菌BL21(DE3)中。该基因在大肠埃希菌中高效表达,并形成包涵体。有研究表明,在低表达时很少形成包涵体,表达量越高越容易形成包涵体,可能是由于重组蛋白的表达过程中缺乏某些蛋白质折叠的酶类和辅助因子、表达的温度不适合、二硫键不能正确配对、蛋白质无法达到足够的溶解度等[14]。宫晓炜[15]通过间接免疫荧光试验和Western blot法检测BVDV细胞中感染的病毒粒子和表达的病毒蛋白,结果证实兔抗Npro多克隆抗体具有较高的亲和力。本研究用Npro蛋白免疫小鼠,制备Npro多克隆抗体,通过间接免疫荧光试验和Western blot法证明制备的鼠抗Npro多克隆抗体能与重组Npro蛋白发生特异性反应,与宫晓炜[15]的研究结果一致。
本研究采用生物信息学方法对BVDV Npro蛋白进行生物信息学分析,并进行了原核表达及多克隆抗体制备,结果表明,Npro是一种外膜蛋白,具有亲水性,不存在信号肽,二级结构主要以β折叠与无规则卷曲为主;成功构建了pET-28a-Npro重组质粒并表达了重组Npro蛋白,纯化后蛋白纯度达95%,可被鼠源Anti-his标签抗体识别;制备的多克隆抗体具有较好的特异性。但目的蛋白以包涵体形式存在,给后续蛋白纯化及纯化后蛋白的复性带来难度,因此,在后续试验中,我们将对原核表达条件进行优化,如诱导时间、温度、诱导剂浓度及表达载体等,以期使目的蛋白以可溶性形式表达,为后续进一步研究BVDV Npro蛋白的功能奠定基础。

