重组猪尿酸氧化酶基因突变及其对聚乙二醇化的影响
李欢,杨玉莹,李国攀,王席,胡基雄,荣明轩,荣俊
1.长江大学动物科学学院,湖北 荆州 434025;2.长江大学生命科学学院,湖北 荆州 434025
尿酸氧化酶(urate oxidase,oruricase,UOX,EC 1.7.3.4)是嘌呤降解过程中的一个关键酶,能将血液中溶解度极低的尿酸氧化成尿囊素,排出体外。许多物种中均发现有UOX的存在,但在鸟类、爬行动物及高等哺乳动物(灵长类包括人类)等生物的进化过程中,由于UOX基因发生突变,因此不能合成有活性的UOX。而且由于人类排泄尿酸的能力非常有限,当机体内尿酸蓄积超过阈值时,可能出现高尿酸血症(hyperuricemia,HUA)[1-2]。目前HUA正成为一个严重的公共卫生问题,不仅是引起痛风的重要生化基础,而且与高血压、高脂血症、动脉粥样硬化、肥胖、胰岛素抵抗的发生密切相关;随着HUA和痛风病的发病率升高,心脑血管疾病、代谢综合征及肾脏疾病患者的死亡率增加[3]。
在人类HUA和痛风病的治疗过程中,UOX能快速且大幅度降低人体的尿酸含量[4]。从黄曲霉中提取的天然UOX具有培养周期长、产率低、活性不高,且易受病原体污染等缺陷[5]。经基因重组技术得到的UOX有较强的免疫原性,会引发机体产生综合抗体,降低药用效果,甚至引起严重的过敏反应。对UOX制剂进行聚乙二醇(polyethylene glycol,PEG)化修饰能在很大程度上减轻或消除纯酶治疗的不良反应[6]。国内外尝试用可溶性惰性聚合物如PEG与其结合来解决或者缓解尿酸酶药用过程中的问题。培戈洛酶是经FDA批准的一种重组PEG化UOX,是目前痛风治疗的一种特效药物,但临床研究显示,该药物的抗体发生率也高达92%,已被FDA在说明书中给予黑框警告[7]。因此,加快开发具有自主知识产权的新药物如新型UOX药物迫在眉睫,且具有潜在的市场前景和社会效益。
有研究表明,重组猪尿酸氧化酶(recombinant porcine urate oxidase,rPUOX)能短期内快速分解尿酸降低血尿酸水平,但仍然存在一定的抗原性,因此对其进行修饰改造后才能实现临床上长期多次用药[8]。蛋白质改造在发现蛋白质功能位点与开发新型蛋白方面做出了许多贡献[9];目前常用PEG对蛋白药物进行化学修饰,此方法可在不改变药物性质的前提下降低药物的免疫原性,对延长蛋白质在血浆中的半衰期及增加蛋白质的稳定性、在水中的溶解度等方面均起到了明显作用[10]。至目前为止,蛋白质的PEG化广泛采用N-端氨基修饰和赖氨酸(Lys)残基的ε-氨基修饰,因为赖氨酸残基是蛋白质中含量最多的氨基酸残基之一,约占10%,且多位于蛋白质分子的表面,远离蛋白活性中心[11]。基于上述原因,通过基因改造使蛋白质非功能区氨基酸突变为赖氨酸(Lys),从而实现可与单甲氧基PEG(mPEG-succinimidyl carbonate)偶联的ε-氨基数的增加,为屏蔽酶分子表面更多的抗原决定簇提供可能。在HUA动物选择方面,由于鸡在尿酸合成和代谢方面与人类相似,诱发及自发HUA较为常见,鸡的痛风病模型被认为较符合人类痛风发病的过程,在HUA模型研究方面地位突出,是较理想的实验动物之一[12]。
本研究前期已经完成对编码rPUOX的基因进行有目的改造,获得了高效表达及纯化的未改造的rPUOX和通过改造增加了1个赖氨酸残基的rPUOX-215。本文通过PEG化修饰改造前后的rPUOX,分析两者在鸡体内的降尿酸效果和抗体变化,评价改造后的rPUOX对PEG化的影响,对改进UOX在动物体内的治疗效果和降低免疫原性发挥重要作用。
1 材料与方法
1.1 菌株 E.coli BL21(DE3)/pET28a-rPUOX由长江大学生命科学学院生物医药研究所保存(该菌种应用的相关技术己申请专利保护,专利号:2008-10225598.9);E.coli BL21(DE3)/pET28a-rPUOX-215工程菌及E.coli BL21(DE3)/pET28a由该所构建并保存。
1.2 主要试剂及仪器 Rabbit anti-Chicken IgG/HRP购自北京博奥森生物技术有限公司;TMB单组份显色液购自北京索莱宝科技有限公司;单甲氧基聚乙二醇琥珀酰亚胺碳酸酯mPEG-SC(相对分子质量:5 000;批号:SC-05191001)购自北京凯正联合医药技术有限公司;Trans2K Plus DNA Marker(100~5 000 bp)购自北京全式金生物技术有限公司;非预染蛋白质marker(14.4~116 kD)购自上海碧云天生物技术有限公司;EA-11型血糖尿酸测试仪和尿酸测试条为三诺生物传感股份有限公司产品;IMARK酶标仪、数字化凝胶成像系统购自美国Bio-Rad公司;UV-2450紫外-可见光分光光度计购自日本岛津公司;DEAE-Sepharose Fast Flow和Sephacryl S 300HR层析填料购自美国GE Healthcare公司。
1.3 鸡蛋及雏鸡 SPF种鸡蛋购自宁波纯派农业科技有限公司,动物合格证号:SCXK(浙)2019-0006,SPF鸡由该鸡蛋孵化,饲养于长江大学生命科学学院动物实验中心。选择14日龄SPF级雏鸡24只(雄性11只,雌13只),体重(221.1±5.2)g,用购自荆州市正荣生物饲料股份有限公司的粗蛋白成分较高的510肉用仔鸡前期配合饲料(主要成分及含量:粗蛋白质≥21%,粗灰分≤10.0%,粗纤维≤6.0%,钙0.7%~1.5%,总磷≥0.5%,食盐0.3%~0.8%,蛋氨酸≥0.40%)适应性喂养1周后,分笼单独饲养,自由采食、饮水。每天采血测定尿酸浓度,记录波动情况,剔除健康状况不良的雏鸡。
1.4 r P U OX的PE G化 将E.coli BL21(DE3)/pET-28a-rPUOX和E.coli BL21(DE3)/pET28a-rPUOX-215经0.6 mol/Lα-乳糖诱导剂32℃诱导表达12 h,表达产物经DEAESepharose Fast Flow和Sephacryl S 300HR柱层析纯化,纯化产物经12%SDS-PAGE分析纯度。用0.1 mol/L pH 10.83的碳酸缓冲液将纯化的rPUOX、rPUOX-215配制成约5 mg/mL的酶溶液,25℃条件下,按蛋白与mPEG摩尔比=1∶20加入mPEG-SC,磁力搅拌器搅拌至充分混合,用Sephacryl S 300HR柱凝胶过滤层析纯化去除修饰完成后剩余基团,并将缓冲液换成0.1 mol/L pH 7.4的PB,收集洗脱峰酶液,经12%SDS-PAGE分析。纯化样品经0.22μm滤膜过滤除菌后分装,4℃保存备用。
1.5 实验动物分组及给药 取体重约200 g的21日龄健康雏鸡21只,随机分为3组,每组7只(雄性3只,雌性4只),分别为20×5K PEG-rPUOX-215组(实验1组)、20×5K PEG-rPUOX组(实验2组)和空白对照组。实验1、2组均按10 U/kg(体重)于鸡翼静脉处注射酶制剂,空白对照组注射0.9%生理盐水,间隔7 d注射1次,共注射4次(周期28 d)。试验前1 d,于鸡翼根静脉处采血并测定基础血浆尿酸含量。每次注射前和注射后24 h、7 d,分别采取静脉血500μL于1.5 mL EP管中,37℃恒温培养箱放置30 min;2 500×g低速离心10 min;分离上层血清样品,于-20℃保存,用作UOX活性和抗UOX抗体的检测。
1.6 鸡血尿酸含量测定 采用EA-11型血糖尿酸测试仪和尿酸测试条,具体操作按使用说明书进行。实验鸡于后肢远端静脉处或背部、胸部、腿部两侧毛细血管采血,每个血样数据为3次重复测定结果的均值。尿酸测试条检测原理:采用干化学法,血样中的尿酸与反应区固有的特殊化学物质接触后产生微电流,测试仪检测微电流的强弱转换成尿酸浓度。取出的试纸条应在3 min内完成测试,测试环境温度15~35℃,相对湿度不大于80%。检测的血浆尿酸范围在181~1 180μmol/L之间,如果测试结果低于181μmol/L,仪器显示LO;高于1 180μmol/L,仪器显示HI。
1.7 鸡血清U OX活性检测 每次注射后24 h采血,用酶反应-紫外分光光度法检测鸡血清酶活性。检测方法及活力单位定义参照文献[13]:在25℃条件下,取2 mL溶解有0.001%尿酸的0.2 mol/L pH 8.4硼酸-硼砂缓冲液于石英比色杯中,加入新分离的鸡血清,充分混匀后反应1 h;反应前后置UV-2450紫外-可见分光光度计中,于293 nm处测定吸光度,并以0.2 mol/L硼酸-硼砂缓冲液作为空白对照。活力单位定义为:在标准条件下(25℃),每小时催化1μmol尿酸生成尿囊素所需要的酶量为1.0个单位(IU)。按下式计算UOX活性。
UOX活性[IU/(mL·h)]=(ΔA×VT×df)/(12.2×VE)
式中IU/(mL·h)为每毫升UOX活力单位数;ΔA为每小时293 nm波长下的吸光度下降值;VT为反应液总体积(mL);df为稀释倍数;12.2为尿酸在293 nm波长下的微摩尔消光系数;VE为UOX液体积(mL)。
1.8 鸡血清抗U OX抗体的检测 采用间接ELISA法,每组检测重复2次。用pH 9.5的碳酸盐缓冲液作为包被缓冲液,将包被抗原rPUOX和rPUOX-215稀释至工作浓度(10μg/mL),加至96孔酶标板中,100μL/孔,每个样品均作3个平行,置4℃过夜;弃孔内液体,用pH 7.2磷酸盐缓冲液洗板5次,弃孔内液体,控干酶联板,加入封闭液(2%BSA+1×PBS-T),100μL/孔,4℃放置过夜;将封闭液甩出拍干,干燥固定后盖上保鲜膜,置4℃保存备用;加入鸡血清,用抗体稀释液(2%BSA+1%木糖+1×PBS-T)按1∶400稀释,100μL/孔,10×PBS-T作为对照,37℃温育结合30 min;用10×PBS-T充分洗涤拍干,加入兔抗鸡HRP酶标二抗(1∶10 000稀释),100μL/孔,37℃保温放置30 min;洗涤方法同上,加入TMB单组分底物显色液(蓝色),100μL/孔,置暗处37℃反应10 min;加入2 mol/L H2SO4(红色)终止液,100μL/孔,15 min内用酶标仪于450 nm波长处测定A值。判断标准:以待测孔的A450值大于或等于阴性对照孔的2.1倍者,即S/N大于或等于2.1,判为阳性。
1.9 统计学分析 采用IBM SPSSStatistics软件分析系统(26.0版)统计处理各组检验数据。所有数据用平均值±标准差()表示,多组间数据比较采用One-way ANOVA单因素方差分析,组间两两比较方差齐时采用LSD检验或S-N-K检验,方差不齐时采用Tamhane′s T2或Dunnett′s T3检验,以P<0.05为差异有统计学意义。
2 结果
2.1 纯化产物及PE G修饰鉴定DEAESepharose Fast Flow和Sephacryl S 300HR柱层析纯化后产物经12%SDS-PAGE分析显示,未修饰的rPUOX和rPUOX-215单亚基相对分子质量均约为33 000,rPUOX和rPUOX-215酶制剂纯度均大于90%;经PEG修饰后,rPUOX和rPUOX-215的相对分子质量大多集中在93 000,修饰产物活性保持率均约在80%。见图1。
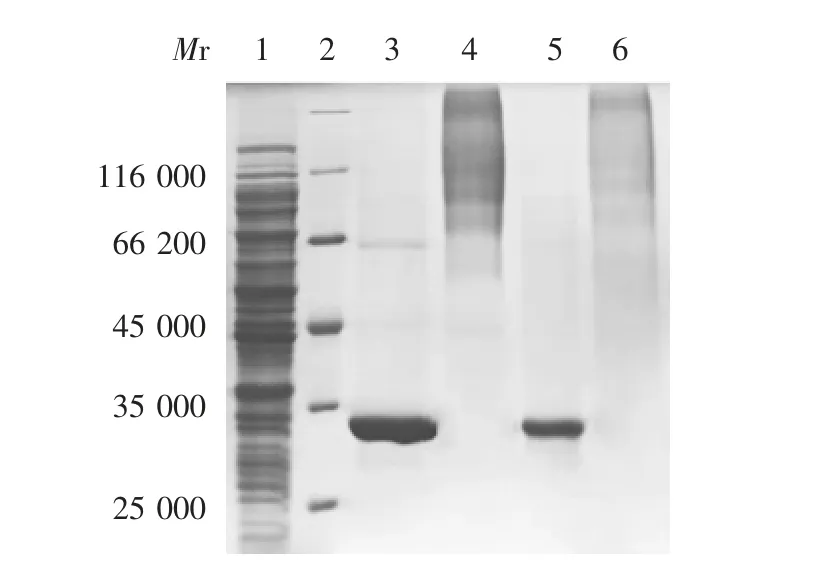
图1 改造前后蛋白的修饰结果Fig.1 Modification of rPUOX and rPUOX-215
被修饰的赖氨酸残基数约12个,即rPUOX和rPUOX-215均获得充分修饰,且与改造后的20×5K PEG-rPUOX-215修饰效果相比,未改造的20×5K PEG-rPUOX有少部分低相对分子质量的修饰产物分布在4 500~66 200,表明20×5K rPUOX-215的修饰度更高。
2.2 注射酶制剂血尿酸浓度变化
2.2.1 第1次注射 实验1组在给药后24 h鸡血尿酸含量降幅最大,为34%(F=19.829,P<0.01),且维持120 h较注射前持续下降17.3%;实验2组在给药后48 h鸡血尿酸含量降幅最大,为23.5%(F=1.518,P>0.05),同样维持120 h较注射前持续下降5.8%。实验1和2组均能维持显著低于空白对照组尿酸浓度的作用时间为72 h(F=3.505,P<0.05)。见图2。

图2 第1次注射前后鸡血尿酸浓度比较Fig.2 Chicken blood uric acid concentration after the 1st injection
2.2.2 第2次注射 实验1组在给药后6 h鸡血尿酸含量降幅最大,为37.6%(F=12.972,P<0.01),且维持24 h较注射前持续下降20.7%;实验2组在给药后6 h降幅最大,为31.1%(F=7.190,P<0.05),同样维持24 h较注射前持续下降5.8%。实验1组维持显著低于空白对照组尿酸浓度的作用时间为24 h(F=6.918,P<0.05),实验2组仅维持6 h(F=12.022,P<0.01)。见图3。

图3 第2次注射前后鸡血尿酸浓度比较Fig.3 Chicken blood uric acid concentration after the 2nd injection
2.2.3 第3次注射 实验1组在给药后6 h鸡血尿酸含量降幅最大,为28.1%(F=5.333,P<0.05),且维持24 h较注射前持续下降;实验2组在给药后6 h降幅最大,为43.4%(F=14.326,P<0.01),同样维持24 h较注射前持续下降。实验1组维持显著低于空白对照组尿酸浓度的作用时间为24 h(F=9.724,P<0.05),实验2组仅维持6 h(F=18.102,P<0.01)。见图4。

图4 第3次注射前后鸡血尿酸浓度比较Fig.4 Chicken blood uric acid concentration after the 3rd injection
2.2.4 第4次注射 实验1和2组给药后6 h,实验鸡血尿酸含量分别降低10.6%和16.8%,与注射前相比差异无统计学意义(F分别为11.917和2.972,P>0.05);两组均仅能维持6 h低于空白对照组的尿酸浓度,且差异均无统计学意义(F=1.968,P>0.05)。见图5。另外,与空白对照组相比,实验1组前3次注射能维持低血尿酸浓度的时间均为120 h;实验2组前3次注射维持作用时间逐渐减少,分别为120、96和72 h。

图5 第4次注射前后鸡血尿酸浓度比较Fig.5 Chicken blood uric acid concentration after the 4th injection
综上所述,20×5K PEG-rPUOX-215和20×5K PEG-rPUOX酶制剂直接注入鸡体内,均能使血尿酸浓度在短期内下降且维持一定时间的药效。与20×5K PEG-rPUOX组相比,20×5K PEG-rPUOX-215组检测鸡血尿酸浓度较注射前下降幅度大,维持降尿酸作用的时间较长,表明修饰改造后的rPUOX降低鸡体内血尿酸水平效果更显著,并且可增加药效学时间,半衰期较长,在体内更稳定,具有较持久的药效。
2.3 鸡血清U OX活性 4次注射后24 h,空白对照组均未检测到UOX活性。前3次注射后24 h,实验1组检测到鸡血清中UOX活性为1.98~3.69[IU/(m L·h)],对应24 h鸡血尿酸含量下降11.5%~34%;实验2组检测到鸡血清中UOX活性为2.15~4.16[IU/(m L·h)],对应24 h鸡血尿酸含量下降12.3%~18.5%。第4次注射后24 h,各组基本均检测不到UOX活性。
综上所述,3次注射后24 h,实验1和2组均能测到鸡血清中的UOX活性,且两种酶活性均较低,结合免疫原性分析,由于20×5K PEG-rPUOX-215和20×5K PEG-rPUOX均可刺激机体产生抗体,该抗体导致部分酶分子与鸡体内特异性抗体结合而失去活性。
2.4 鸡血清抗U OX抗体 注射前各组鸡血清中抗UOX抗体测定均为阴性。注射后14 d,部分达到阳性水平,实验1组鸡抗体阳性率为28.6%(2/7),实验2组鸡抗体阳性率为42.9%(3/7);21和28 d,实验1和2组的鸡抗体阳性率分别为85.7%(6/7)和100%(7/7);空白对照组抗体检测均为阴性。见表1。空白对照组注射前后A450值无明显差异,S/N值也未达到阳性水平。实验1和2组注射后14 d,抗体A450值均上升缓慢;21和28 d,抗体A450值均上升较快,且实验1组抗体A450值低于实验2组。见图6。

表1 实验鸡血清样品抗rPUOX-215、rPUOX抗体测定结果(S/N值阳性鸡数)Tab.1 Determination results of antibodies against rPUOX-215 and rPUOX in blood samples of chicken(numbers of chicken with S/N values indicating positive results)
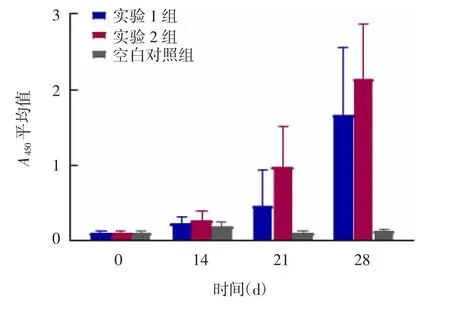
图6 注射后各组鸡血清抗PEG化rPUOX-215和rPUOX抗体A450平均值Fig.6 Mean A450 values of antibodies against PEG-rPUOX-215 and PEG-rPUOX in serum of chickens in various groups after injection
综上所述,20×5K PEG-rPUOX-215和20×5K PEG-rPUOX酶制剂均具有一定的抗原性,能刺激鸡体产生相应抗体,5K PEG并不能有效屏蔽重组UOX的抗原性。实验1组鸡体内的抗体产生速率和水平均低于实验2组,表明改造修饰后的重组UOX免疫原性有所降低。
3 讨论
近年来,痛风和HUA的发病率持续上升,与糖尿病、高血压、肥胖或高胆固醇血症等几乎所有的成人病均密切相关,也可能导致肾障碍、动脉硬化、脑中风、心脏病等严重疾病,是非常重大的代谢异常症状,已严重威胁人们的身体健康[14-15]。重组UOX在治疗HUA上有巨大应用前景,但如何消除或降低免疫原性及提高其药代药效显得尤为重要,成为制约其大规模应用的主要原因。现今,关于蛋白质改造的研究日益增加,蛋白质的定点突变和融合蛋白的研究得到快速发展,PEG修饰技术已成为蛋白质改造的重要修饰策略[16-17],其主要具有以下优势:①通过蛋白质共价偶联PEG分子,增大蛋白药物相对分子质量,避免被肾小球过滤;②能够屏蔽蛋白质免疫位点,减少人体免疫负反应;③由于PEG分子的包裹,阻碍蛋白酶的降解;④PEG分子能增加药物在体液中的溶解度;⑤通过与药物间的化学键在体内随时间水解,达到缓慢释放药物的特性。因此,活化的PEG与蛋白质分子相偶联,不仅能将蛋白质本身的特性完整保留下来,还可使蛋白质各种生物化学性质发生改变,包括半衰期延长、血浆清除率降低、抵抗蛋白酶水解能力提高、免疫原性降低等[18-19]。
匡红艳等[8]研究表明,rPUOX注入实验动物鸡体内,能快速分解尿酸,降低血尿酸水平,但仍然存在一定的抗原性,对其进行修饰改造后才能实现临床上长期多次用药。朱莹莹等[20]从rPUOX的PEG化本身探讨了不同因素对修饰效率和修饰程度的影响,但并未进行动物应用研究。相关研究表明,rPUOX裸酶制剂与PEG-rPUOX酶制剂分别作用于实验动物,PEG-rPUOX延长了药物作用及达到抗体阳性标准的时间,证明PEG化有降低rPUOX抗原性的作用[21]。为进一步研制低免疫原性的rPUOX制剂,本课题基于对rPUOX基因序列的分析,选取rPUOX上非保守序列且不参与酶活性中心构成的位点,设计重叠引物,采用SOE-PCR技术,突变效率高[22],且使用高保真DNA聚合酶,可有效降低错配率,避免产生移码突变。将蛋白质非活性位点的氨基酸残基突变为赖氨酸(Lys),进而在蛋白分子表面引入更多游离氨基,实现了mPEG修饰位点的增加;同时为尽可能避免影响蛋白活性,以小相对分子质量的PEG-SC-5KD进行修饰,实现了对抗原位点的特异性覆盖,最大限度保留了蛋白活性,与理论上修饰度越高,活性越低的趋势基本一致[23];修饰氨基数目与SHERMAN等[24]报道的猪UOX酶分子表面可被修饰的赖氨酸残基12~13个相对应,即rPUOX和rPUOX-215均得到了充分修饰。然后,从实验动物应用方面对改造前后的猪UOX的PEG化进行探讨,研究对修饰作用效果的影响。整体来看,与未改造20×5K PEG-rPUOX相比,基因改造后20×5K PEG-rPUOX-215酶制剂,能够提高药物作用效果,延长半衰期,相对降低免疫原性,为后期进一步探索PEG修饰改造的优化方案及动物实验研究提供了参考。
尽管PEG-rPUOX-215具有较为明显的临床应用优势,但需要指出的是,由于对酶制剂采用的是单链线性PEG分子修饰,且对蛋白质赖氨酸(Lys)残基的化学修饰属于随机修饰,加之每个ε-氨基的反应活性不同,出现各种不同修饰程度的酶蛋白均匀,难以分辨出明确的蛋白条带。另外,改造前后的UOX制剂PEG修饰后,作用于实验性SPF鸡体内,整体降尿酸效果不明显,推测由于注射前经过一系列处理,最终造成酶活性降低的原因如下:①将蛋白基因序列通过重叠延伸PCR构建的rPUOX-215突变蛋白,由于表达量低等原因,表达后蛋白活性与改造前相比有所下降;②本研究选择的氨基酸突变位点在其他动物UOX的氨基酸序列中有出现赖氨酸(Lys),而不同动物表达的UOX活力具有差异,猪体内UOX活力在哺乳动物中较高,突变也可能会造成表达蛋白活力下降;③小相对分子质量PEG因过度修饰造成产物活性降低[25],且关于PEG修饰产物目前缺乏明确的质量标准和对其结构确证的相关设备及分析手段,因此后续还需通过酶切、HPLC、质谱、Ed-man降解的序列分析等方法联合使用进行确认[26]。
从机体产生抗体的一般规律来看,初次反应时,可溶性抗原在第1周就有少量抗体出现,2~3周再次注射相同抗原后,因原有的部分抗体与再次注射的抗原结合,可使原有抗原量降低,随后抗体大量增加[27]。可见,PEG化对功能蛋白抗原性的屏蔽作用未达到理想预期,分析影响免疫原性的因素如下:①重组蛋白的翻译后修饰可能形成新的抗原表位;②蛋白药物受外界条件影响,包括氧化、脱氨基、降解、变性、聚集等,会导致新的抗原表位形成,纯化过程中残留的宿主细胞蛋白及其他杂质可能引起免疫原性反应;③注射剂量大引起免疫原性等。除上述原因外,PEG本身及修饰位点和数量也可能是影响免疫原性的一个原因,mPEG-SC是针对赖氨酸(Lys)残基的随机位点修饰,容易造成分子结构的不均一性,这可能是引起抗PEG抗体出现和血液清除速率加快的原因之一[28-30]。
此外,目前对实验动物HUA造模无确定方法,而本研究采用高蛋白复合饲料诱导鸡HUA模型,可能由于饲料中蛋白及钙含量均较高,饲喂时对肾脏损伤较大,导致动物精神状态不佳;且禽类个体间由于雌雄性别差异及身体机能的强弱,对高蛋白饲料的吸收效果也不尽相同;另外,进食、饮水不均衡造成个别鸡尿酸水平差异偏大,对实验结果产生一定影响[31-33]。需要说明的是,第1次注射后24和48 h,实验1和2组的尿酸水平与空白对照组相比差异并不明显,推测由于鸡日龄太小,首次注射采用静脉注射且注射剂量较大,导致动物出现严重的应激反应,进而引起生理和心理反应,造成动物精神不振,采食饮水也受到影响;随着动物对刺激部分出现全适应,应激反应逐渐消失,细胞活动和抵抗力增强,鸡体内环境也恢复正常,因此在72 h,实验1和2组尿酸水平与空白对照组相比差异均显著。第3次注射后6 h,虽然两个酶制剂组较空白对照组均显著降低,但由于注射前两组间差异显著,无法直接比较降尿酸效果的优劣;注射前两组与空白对照组相比差异均无统计学意义,因此可通过结合组间统计结果,衡量两者降尿酸效果,发现第3次注射后6 h,两个酶制剂组较空白对照组均显著降低,且实验1组尿酸值较低,同样说明20×5K PEG-rPUOX-215更能有效分解鸡体内尿酸。第4次注射6 h后,两组酶制剂较空白对照组均有降低,但差异无统计学意义;由于实验1组与空白对照组差异显著,难以准确比较给药后两组酶制剂的作用效果,推测由于长期饲喂同种高蛋白饲料对实验鸡的肾脏造成损伤,因此其精神状态变差,采食量减少,导致体内尿酸值无法恢复至正常水平。
本研究结果表明,基因改造后PEG化修饰的rPUOX,对提高PEG化的抗原屏蔽作用有明显的效果,为研制可大规模用于临床的低免疫原性新型UOX奠定了基础。

