PCOS患者卵泡液外泌体miRNA谱差异表达及生物信息学分析
温惠慧,冯云,张丽娜,张迅轶,纪亚忠*
(1.同济大学附属同济医院,上海 200065;2.上海市普陀区妇婴保健院,上海 200060)
多囊卵巢综合征(PCOS)是青春期及育龄期女性常见的生殖功能障碍与糖代谢异常并存的内分泌紊乱性疾病,发病率达6.1%~19.9%,以月经稀发、排卵障碍、高雄激素血症和高胰岛素血症等为主要临床表现[1]。由于稀发排卵或无排卵,常常伴发不孕的问题[2]。研究表明不同类型的PCOS患者,如肥胖、高黄体生成素(LH)、高雄激素及胰岛素抵抗(IR),其辅助生殖技术(ART)的助孕结局均较非PCOS患者差,虽然发生机制各有特点,但不同的病理生理异常相互作用,最终多反映为卵母细胞质量下降,表现为PCOS患者ART治疗的临床妊娠率低、早期自然流产率高等特点[3]。
PCOS患者卵母细胞成熟障碍可能与卵泡液中某些细胞因子的异常使卵泡液微环境发生变化相关[4-5]。由于卵母细胞的发育潜能直接决定胚胎结局[6],因而通过间接研究卵母细胞生长发育的微环境,有助于寻找到评估胚胎发育潜能的新方法。因此,加强对卵泡液微环境的深入探索分析,有利于改善ART结局。
外泌体(exosome)最早是由细胞内多泡体与细胞膜融合后,释放到细胞外基质中的一种直径约30~150 nm的膜性囊泡[7]。现有疾病研究已经发现,有些微小RNA(miRNA)会通过外泌体到达其他细胞组织,为一些癌细胞营造一个适合转移的微环境,从而促进癌细胞转移,造成癌症患者较差的预后效果;因此,外泌体miRNA可以成为某些疾病的特殊标志物[8-10]。本研究通过比较PCOS不孕患者及卵巢功能正常不孕患者卵泡液中外泌体miRNA的差异表达,探讨可以用来预测胚胎质量的生物标志物。
材料与方法
一、研究对象
卵泡液来源:收集2017年9月至2018年2月在同济大学附属同济医院生殖医学中心接受ICSI助孕的24例女性不孕症患者的卵泡液,包括12例PCOS患者(PCOS组)和12例卵巢功能正常的不孕症患者(对照组)。
纳入标准:PCOS组:诊断标准参照国际通用的鹿特丹2003诊断标准[11],即至少满足以下两个条件:(1)高雄激素血症;(2)不排卵或排卵减少;(3)卵巢多囊。12例PCOS组患者年龄≤35岁,平均29岁,月经第2~3天基础窦卵泡计数(AFC)平均25.3个,基础睾酮(T)平均1.7 ng/ml。对照组:选择同期行ICSI治疗的不孕症患者,不孕因素为输卵管因素或男方因素。其年龄≤35岁,平均29.4岁,月经第2~3天AFC平均16.8个,基础T平均0.2 ng/ml。排除标准:(1)促排卵周期数>6;(2)体质量指数(BMI)≥25 kg/m2;(3)卵泡刺激素(FSH)>25 U/L;(4)存在子宫内膜异位、卵巢储备功能下降、染色体易位、复发性流产及脆性X染色体综合征等影响卵母细胞质量的疾病。
本研究通过同济大学附属同济医院伦理委员会批准,并获得患者的同意及签署了知情同意书。
二、主要试剂和仪器
1.主要试剂:RiboTMExosome Isolation Reagent(广州锐博生物);CD63(BD 557288)、CD81(BD 551108)单克隆抗体(BD,美国);TRIzol reagent(Invitrogen,美国);HiSeq Rapid SBS Kit V2(50 cycle)、HiSeq Rapid SR Cluster Kit V2(Illumina,美国)。
2.主要仪器:低温高速离心机(Thermo,美国);ZETASIZER Nano series-Nano-ZS(Malvern,英国);Accuri C6 flow cytomenter(BD,美国);Agilent 2200 TapeStation(芯片类型:HS D1000 Reagent)(Agilent Technologies,美国);高通量测序仪Hiseq2500(Illumina,美国)。
三、卵泡液标本收集与处理
所有患者均采用标准长方案促排卵治疗。当双侧卵巢至少有3个优势卵泡直径≥16 mm或者2个优势卵泡直径≥17 mm或1个优势卵泡直径≥18 mm时停用Gn,当日晚21点肌肉注射HCG 6 000 U。36 h后,在阴道超声引导下穿刺取卵,使用16-G双腔采卵针经后穹隆穿刺抽吸卵泡液,于培养皿中用巴斯特吸管将卵泡液中的卵母细胞吸出。收集第1管无血染的澄清卵泡液,同时标记该卵泡液对应的卵母细胞。4℃低温离心机下1 500g离心15 min,取上清液-80℃冻存待测。
四、卵泡液分组
不同成熟期卵母细胞的miRNA表达谱不同[12],只留取含成熟卵母细胞(MⅡ期)的卵泡液。取卵后1~2 h去除卵丘,使卵裸化,观察卵母细胞的成熟度。采用ICSI方法授精后,放入37℃、6%CO2培养箱中培养,16~18 h后观察受精情况,见到2个原核(PN)和第2极体(Pb2)为正常受精,≥3PN或未见PN为异常受精,第3天(D3)观察胚胎情况(剔除3PN及以上的异常受精胚胎)。根据形态学参数包括胚胎卵裂速度、胚胎中碎片所占体积百分比和卵裂球对称性对早期胚胎进行分级(一共4级)和Gardner评分[13],Ⅰ、Ⅱ级定义为优质胚胎,Ⅲ、Ⅳ级定义为非优质胚胎。将两组研究对象的卵泡液依据D3胚胎质量分为优胚组[PCOS-1(n=11)、对照-1(n=15)]和非优胚组[PCOS-2(n=11)、对照-2(n=15)],对应的卵泡液等量混合形成4个25 ml卵泡液池。
五、卵泡液外泌体的提取与鉴定
1.卵泡液外泌体提取:使用外泌体提取试剂盒RiboTMExosome Isolation Reagent制备外泌体样本,严格参照说明书进行相应操作,即可得到外泌体。
2.外泌体的鉴定:(1)纳米粒子轨迹分析(NTA):按照仪器操作规程检测外泌体颗粒大小和浓度;(2)流式细胞仪检测外泌体表面蛋白标志物:取2份卵泡液外泌体提取物,加入100 μl过滤后的PBS,密封后冰上保存,1份进行CD63和CD81抗体染色,标记为CD63和CD81,另外1份不加抗体作为阴性对照,标记为NC;按照仪器操作规程上机检测。
六、外泌体miRNA高通量测序与分析
1.小RNA的文库构建、测序与分析:使用TRIzol reagent Invitrogen试剂盒分别提取4份外泌体总RNA(包括miRNA)。采用Qubit 2.0、Agilent 2200方法检测样品的RNA浓度和完整性,4份样品总RNA浓度比较差异无统计学意义(P>0.05),在20~30 nt均有较高的分布。检测合格后,以1 μg Total RNA/≥50 ng small RNA起始量进行文库构建。主要步骤为:3’adaptor连接;5’adaptor连接;第一链cDNA合成;PCR扩增;用凝胶电泳法获取插入片段在18~40 nt左右的cDNA文库,并用Agilent 2200 TapeStation进行文库质检。纯化后cDNA峰值在160 bp,库检合格。用HiSeq Rapid SR Cluster Kit V2试剂盒进行聚类分析最终生成小RNA文库。
采用Illumina HiSeq 2500对所得文库进行高通量测序,将测序所得的原始数据进行过滤,去除接头序列、污染部分及低质量序列获得干净序列(clean reads),将clean data与多种ncRNA数据库进行比对,进而注释出已知的ncRNA(miRNA、rRNA、tRNA、snRNA、snoRNA)。并与 miRBase数据库[miRBase version 21(www.mirbase.org)]中人所有miRNA前体及成熟体序列比对,对各样本已知miRNA计算表达量,采用RPM标准化。用edger软件进行样本间的差异表达分析,并计算P值。以|-log2(Fold Change)|≥1且P值<0.05作为筛选标准。文库的构建、测序与分析均由广州锐博生物科技有限公司完成。
2.miRNA的靶基因预测及功能注释:使用miRanda、miRDB和miRTarBase三款软件共同预测结果作为miRNA的候选靶基因。使用KOBAS软件(http://kobas.cbi.pku.edu.cn/index.php)对预测靶基因进行GO功能和KEGG信号通路富集分析,分别通过超几何分布、Fisher Exact Test计算P值,以P值<0.05为显著性阈值。
Cytoscape_v3.8.2软件数据库是一个独立的软件工具,构建miRNA-mRNA相互作用网络图并标注关键节点miRNA,节点基因为关键基因。
结 果
一、卵泡液外泌体鉴定结果
NTA结果显示,分离纯化组分的粒径主峰值为114.7 nm,平均粒径30.1 nm,20~200 nm粒径所占百分比62.9%(图1A);流式细胞仪检测结果显示,卵泡液提取物中CD63和CD81两个膜蛋白均有阳性信号,CD63和CD81阳性率分别为82.8%和98.9%(图1B)。以上特性表明,外泌体提取成功。
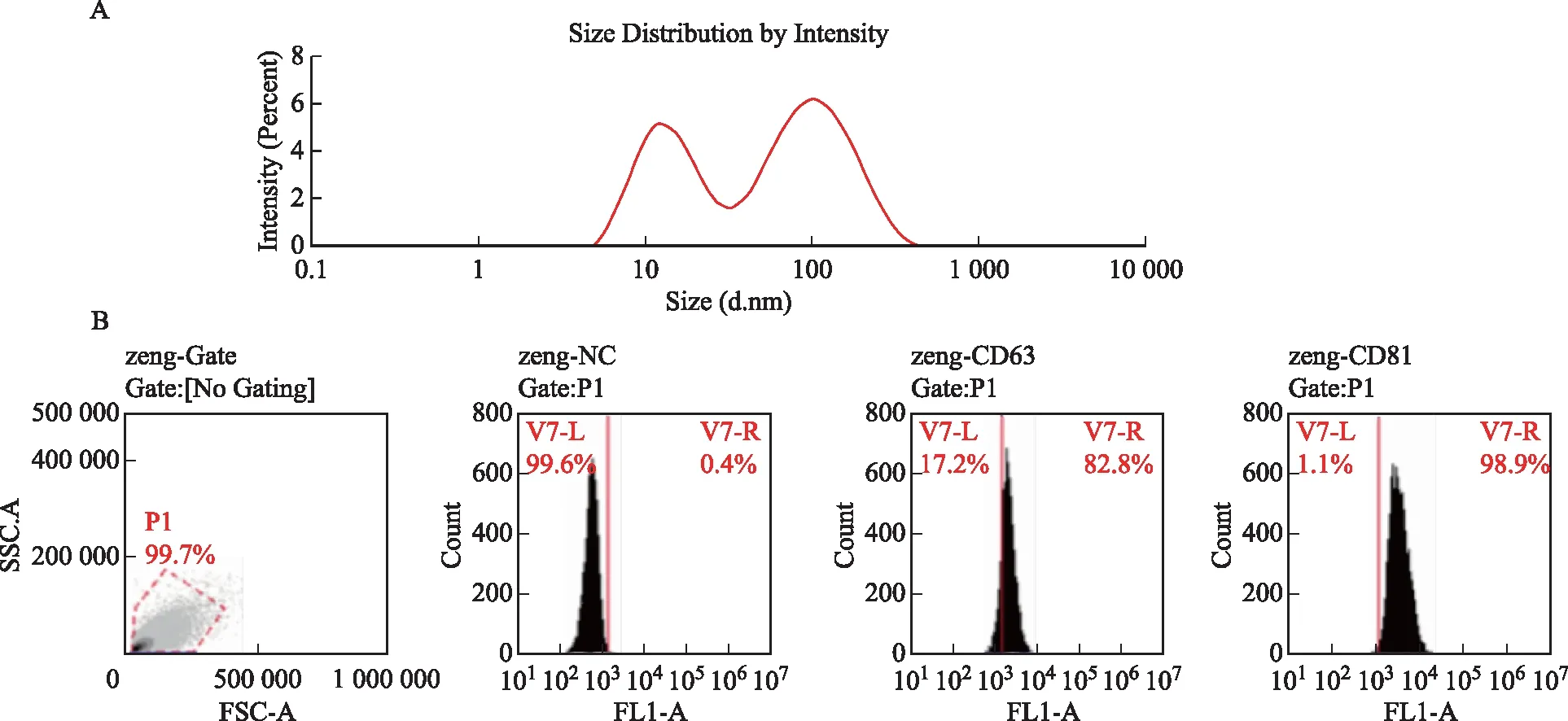
A:卵泡液外泌体粒径峰度分布图;B:外泌体CD63和CD81的流式图图1 卵泡液外泌体的鉴定
二、卵泡液外泌体miRNA的表达差异情况
测序结果显示,PCOS-1比较PCOS-2,对照-1比较对照-2,后取交集,有328个共表达的外泌体miRNA(图2)。当P<0.05且|-log2(Fold Change)|≥1时,卵泡液中存在9个显著表达差异的外泌体miRNA。与优胚组相比,非优胚组中的外泌体miRNA有7个表达上调,2个表达下调(表1)。

图2 卵泡液外泌体miRNA韦恩图(共表达)

表1 共表达的卵泡液外泌体miRNA差异表达谱
分析PCOS组,当P<0.01且|-log2(Fold Change)|≥2,卵泡液中存在120个表达差异显著的外泌体miRNA。与PCOS-1组相比,PCOS-2组中外泌体miRNA有57个表达上调,63个表达下调,聚类分析热图如图3所示,火山图如图4A所示。
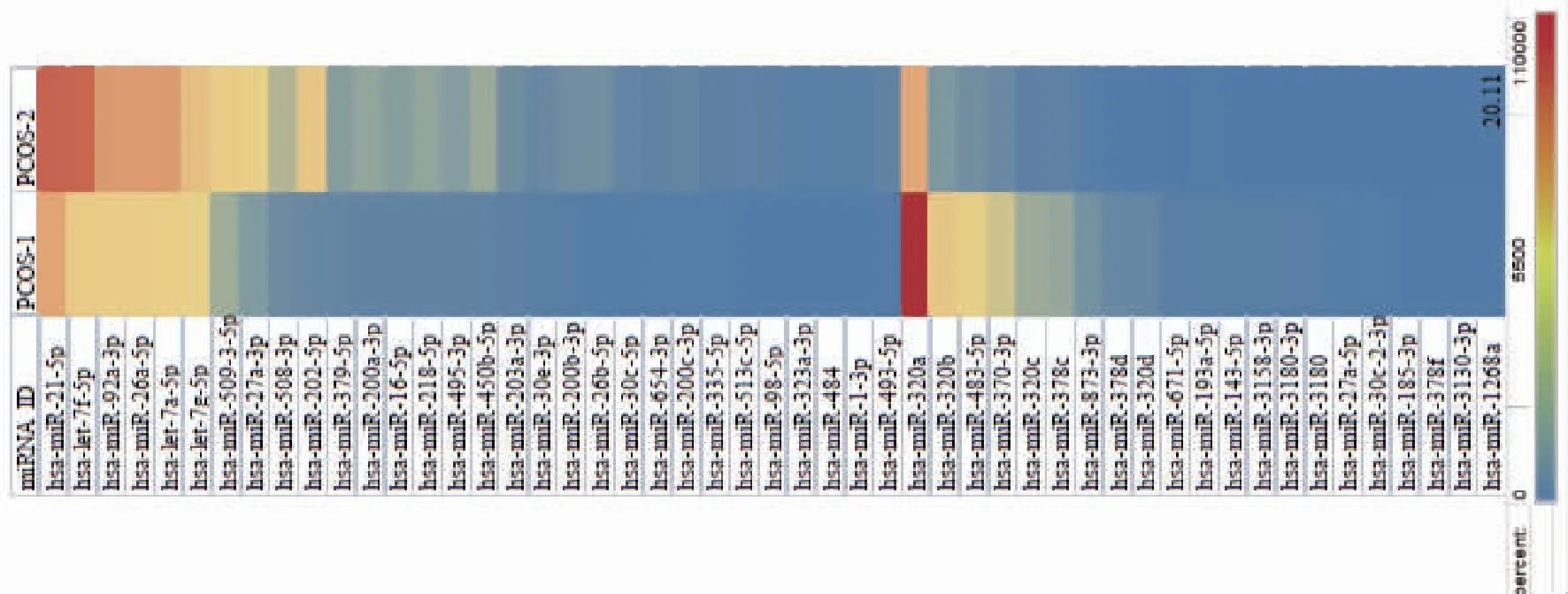
图3 PCOS-1与PCOS-2差异表达外泌体miRNA的聚类分析热图(Top30)
分析对照组,当P<0.01且|-log2(Fold Change)|≥2,卵泡液中存在8个表达差异显著的外泌体miRNA。与对照-1组相比,对照-2组中外泌体miRNA有5个表达上调,3个表达下调(图4B)。

图4 差异表达外泌体miRNA的火山图
三、差异表达外泌体miRNA的生物信息学分析
1.靶基因预测:使用miRanda、miRDB和miRTarBase软件对共表达的差异miRNA即hsa-miR-200a-3p、hsa-miR-135a-5p、hsa-miR-141-3p、hsa-miR-200a-5p进行靶基因预测,一共预测到427个靶基因,对这些靶基因基因进行GO分析,结果显示基因主要涉及蛋白结合、核酸结合等分子功能。KEGG分析发现,主要参与P13K-Akt、调节干细胞多能性的信号通路(图5)。

图5 共表达的差异miRNA靶基因的GO富集和KEGG通路分析
PCOS组中差异miRNA靶基因预测显示,一共预测到3 241个靶基因,对这些基因进行GO富集分析,结果显示基因主要参与细胞代谢调控、细胞大分子代谢、细胞调控等生物过程,涉及离子结合、DNA结合、酶活性等分子功能。KEGG通路分析发现,主要富集在丝裂原活化蛋白激酶(MAPK)、P13K-Akt、FoxO、粘着斑激酶(focal adhesion,FAK)、雷帕霉素靶分子(mTOR)、Ras/MAPK胰岛素信号通路、AGE-RAGE信号通路以及癌症、细胞周期等信号通路(图6)。

图6 PCOS组中差异表达miRNA靶基因的GO富集和KEGG通路分析
2.靶基因网络分析:采用Cytoscape软件构建miRNA-mRNA网络,发现共表达的差异miRNA中,hsa-miR-200a-3p、hsa-miR-141-3p共同参与调控大多数基因,对靶基因构建相互作用网络,根据MCC评分预测出GRB2、H2AFZ、PDE4D等关键基因(图7)。
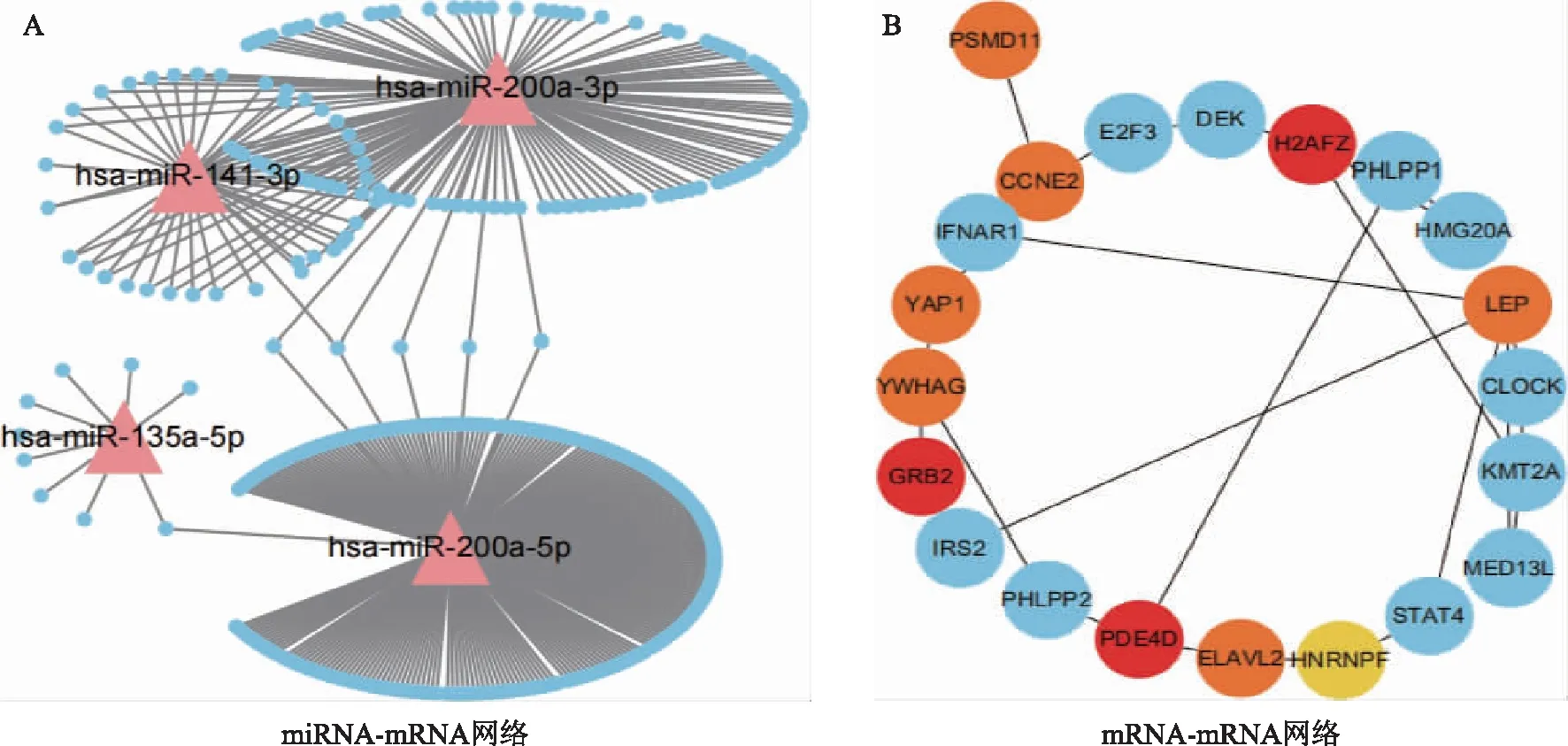
图7 miRNA-mRNA网络图及mRNA-mRNA可视化图(共表达)
PCOS组,采用Cytoscape软件构建miRNA-mRNA网络及靶基因相互作用网络,根据MCC评分预测出hsa-miR-26b-5p、hsa-miR-218-5p、hsa-miR-483-5p、hsa-miR-320b、hsa-miR-320c等关键miRNA及UBE2K、UBE2H、VHL、PARK2等关键基因(图8)。

图8 miRNA-mRNA和mRNA-mRNA可视化相互作用图(PCOS组)
讨 论
卵母细胞发育、成熟直至卵子排出除受下丘脑-垂体-卵巢轴调节外,卵巢内微环境的改变也对卵泡的发育有着至关重要的影响,并通过自分泌、旁分泌的调控途径影响着卵泡的生长发育[14-15]。有研究表明,由于miRNA在血清中稳定性好,耐受核酸酶活性,并且容易检测[16],血清中的miRNA可以作为PCOS的一种非侵入性的生物标志物。然而,Long等[17]认为大多数miRNA和来自于PCOS患者卵巢组织中的miRNA并不进入血液,血清中的miRNA表达情况并不能有效反应卵巢最基础状态的改变。另外,血清是一种成份复杂的混合物,要识别miRNA的细胞起源比较困难。因此,卵泡液中miRNA的研究也许对于揭示PCOS患者卵泡发育机制提供了新策略。
本项研究中,我们运用深度测序分析了卵泡液外泌体miRNA的表达谱,证明了人卵泡液外泌体中存在miRNA。同时发现,PCOS患者的外泌体miRNA表达数目明显高于健康对照组,同时两组间其表达量也存在明显差异,这可能与卵巢功能有关。通过Illumina HiSeq 2500测序平台分析两组患者的外泌体miRNA表达谱,PCOS组,筛选出120个差异表达miRNA,与PCOS-1组相比,PCOS-2组有57个表达上调,63个表达下调。与对照-1组相比,对照-2组有5个表达上调,3个表达下调。这说明与对照组相比,PCOS卵泡液外泌体miRNA表达谱发生了显著的表达变化。
采用生物信息学技术分析差异表达的miRNA的生物学功能,预测其调控机制。我们先采用miRanda、miRDB和miRTarBase三款软件预测差异表达miRNA的候选靶基因。hsa-miR-200a-3p、hsa-miR-141-3p作为关键miRNA,共同调控靶基因参与P13K-Akt、调节干细胞多能性等信号通路。动物实验表明,P13K-AKT信号通路与始基卵泡的激活密切相关[18]。第10号染色体上磷酸酶和张力蛋白同源缺失的基因(PTEN)对P13K-AKT信号通路起负反馈调节作用。PCOS组,hsa-miR-26b-5p、hsa-miR-218-5p、hsa-miR-483-5p、hsa-miR-320b、hsa-miR-320c等关键miRNA调控关键靶基因参与代谢、细胞增殖相关的多个信号通路。已有研究报道,在卵泡闭锁过程中,miR-26b呈现高表达,miR-26b可以促进细胞DNA的断裂引起颗粒细胞的凋亡[19],卵泡闭锁是由颗粒细胞凋亡促发的。miR-200家族成员包括miR-200a、miR-200b、miR-200c等,Hasuwa等[20]研究了miR-200b在雌性小鼠不孕与生育中的作用,发现miR-200b表达上调抑制LH的生物合成。此外,hsa-miR-200a-3p可能通过参与Wnt信号通路来调节卵母细胞的发育,主要表现为抑制胚胎发育[21]。
在女性生殖系统中,hsa-miR-320a表达水平与卵母细胞发育情况紧密相关,其表达水平的正常维持是卵母细胞发育的必要条件。hsa-miR-320在血浆、卵泡液、颗粒细胞中均表达,其靶基因RAB5B基因在PCOS病因中具有重要作用,并可能通过抑制转化生长因子β(TGFβ)信号通路而减少雌激素分泌。hsa-miR-320a在成熟卵母细胞的卵泡液中表达水平更高[22]。hsa-miR-320a、hsa-miR-320b与雌激素水平呈正相关,通过转染miR-320模拟物可以提高雌二醇的分泌[23]。说明非优质胚胎所对应的卵母细胞微环境中,雌激素水平表达量较低。另外,hsa-miR-320a可能通过胰岛素P13K信号通路降低胰岛素敏感性。
本研究将PCOS和卵巢功能正常患者的卵泡液依据D3胚胎情况进行分组,与既往文献中仅比较PCOS和正常患者卵泡液外泌体miRNA差异表达不同,发现PCOS卵泡液外泌体miRNA表达水平在胚胎质量不同的情况下会有差异,这可能受卵母细胞成熟度影响。对卵泡液外泌体miRNA的研究将有助于理解卵母细胞与卵泡微环境之间相互作用机制和卵母细胞生长发育过程,筛选合适的外泌体miRNA作为预测卵母细胞质量的生物标志物也会为ART带来创新。

