GnRH激动剂长方案和拮抗剂方案中HCG日孕酮与获卵数比值对后续FET周期妊娠结局的影响
吴静,巨瑛,黄剑磊,李博,王晓红
(空军军医大学唐都医院妇产科生殖医学中心,西安 710038)
随着辅助生殖技术(ART)的发展,HCG日孕酮(P)水平与体外受精-胚胎移植(IVF-ET)技术助孕结局的关系一直备受关注。多数研究认为,HCG日升高的P水平因改变子宫内膜容受性而影响新鲜移植周期的妊娠结局[1-3]。然而,亦有研究提出提前升高的P水平是“过早黄素化”的表现,可能影响胚胎发育[4-5],该影响是否对后续冻融胚胎移植(FET)的妊娠结局产生负面效应,目前尚有争议[6-7]。既往研究多关注HCG日P水平对FET周期整体人群的作用关系,而对不同促排卵(COS)方案不同P水平的分层分析较少;且考虑到HCG日P水平具有多卵泡的累积效应,与卵巢反应有关[8]。因此,本研究将HCG日P/获卵数(O)比值作为妊娠结局的变量指标,回顾性分析促性腺激素释放激素激动剂(GnRH-a)长方案及拮抗剂方案中HCG日P/O比值变化对后续FET周期妊娠结局的影响,探索不同COS方案中P/O比值的合适区间,以期为ART临床提供参考。
资料与方法
一、研究对象与分组
采用回顾性研究,选取2017年10月至2019年12月在空军军医大学唐都医院生殖医学中心行FET的患者为研究对象。纳入标准:(1)取卵次数≤2次;(2)COS方案为GnRH-a长方案或拮抗剂方案;(3)胚胎移植次数≤2次;(4)移植胚胎中至少有1个优质或者中等质量胚胎。排除标准:(1)宫腔粘连或子宫畸形;(2)因各种因素行胚胎种植前遗传学检测(PGT)的周期;(3)双移植周期;(4)失访或数据缺失。
最终纳入符合标准的2 321个周期,根据COS周期HCG日P/O比值不同,将研究对象分为3组:Ⅰ组,0.02≤P/O≤0.17,764个周期;Ⅱ组,0.17
二、研究方法
1.COS周期:所有研究对象均选用IVF或卵胞浆内单精子注射(ICSI)技术助孕,COS方案为GnRH-a长方案或拮抗剂方案,具体实施流程参考既往研究[9]。当主导卵泡直径≥18 mm或至少3枚卵泡直径≥17 mm,同时参考激素水平扳机,注射重组人绒毛膜促性腺激素(rHCG,艾泽,默克,瑞士)250 μg和/或注射用HCG(珠海丽珠)5 000~10 000 U,34~37 h后行经阴道B超下穿刺取卵术。
2.胚胎培养与评估:根据病史及取卵取精结果选择IVF或ICSI受精,受精后16~18 h查看受精结果。对于正常受精的合子继续于培养箱培养3~5 d。根据中华医学会生殖医学分会实验室学组共识和Istanbul共识[10-11],卵裂期胚胎评估为3个级别:优质胚胎、中等胚胎、差等胚胎。囊胚评分采用Gardner评分标准[12]进行评价,发育为二期以上则判定为囊胚,分为优质囊胚、中等囊胚和差等囊胚。我中心将优质卵裂胚/囊胚及中等卵裂胚/囊胚视为可利用胚胎,可利用胚胎均采用玻璃化冷冻技术保存备用。
3.FET:月经周期规律、排卵正常者选用自然周期(NC),月经周期不规律或排卵障碍者选择微刺激方案(OI)或激素替代周期(HRT)进行子宫内膜准备。卵裂期胚胎解冻后培养4~5 h移植,囊胚解冻后培养2 h移植。移植术后第13~15天查血β-HCG,β-HCG>10.0 U/L为HCG阳性。HCG阳性者在移植术后28~30 d首次行阴道B超检查,观察宫内是否可见孕囊,有孕囊者判断为临床妊娠,同时核实孕囊数目。随访妊娠情况至孕20周以后。
4.收集资料及主要观察指标:收集一般临床资料包括:女方年龄、体质量指数(BMI)、抗苗勒管激素(AMH)、基础窦卵泡数(AFC)、不孕类型、不孕年限、不孕因素;COS方案、HCG日激素水平、卵母细胞成熟度(MⅡ卵数/获卵总数)及受精方式等;FET周期移植日子宫内膜厚度和形态、移植胚胎数及质量等。主要观察指标包括:临床妊娠率(临床妊娠周期数/移植周期数)、持续妊娠率(持续妊娠周期数/移植周期数)、流产率(流产周期数/临床妊娠周期数),异位妊娠率(异位妊娠周期数/临床妊娠周期数)及着床率(着床数/移植胚胎数)。
三、统计学分析

结 果
一、三组患者临床基本情况比较
患者一般资料分析显示:女方年龄、AMH、AFC、COS方案、HCG日E2及P水平、促性腺激素(Gn)总量及获卵数3组间有显著性差异(P<0.05),BMI、不孕因素、不孕年限、不孕类型、精子来源、卵母细胞成熟度及受精方式3组间无显著性差异(P>0.05)(表1)。FET周期中,移植日子宫内膜厚度及形态、移植胚胎数、移植胚胎类型及质量3组间均无显著性差异(P>0.05)(表2)。
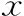
表1 不同P/O比值各组患者一般资料比较[(-±s),n(%)]

续表

表2 不同P/O比值各组患者胚胎移植情况比较[(-±s),n(%)]
二、两种COS方案中P/O比值对妊娠结局影响的对比分析
单因素分析结果显示:拮抗剂方案中不同P/O比值的Ⅰ组、Ⅱ组、Ⅲ组间,FET周期的着床率、临床妊娠率及持续妊娠率均呈下降趋势,且每两组间差异有统计学意义(P<0.05);而在GnRH-a长方案患者中3组间妊娠结局无显著性差异(P>0.05)(表3)。
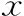
表3 不同P/O比值各组FET周期妊娠结局比较[(-±s),n(%)]
多元回归模型矫正基线资料后,不论长方案还是拮抗剂方案,随着P/O比值升高,后续FET周期妊娠结局均未见显著变化(P>0.05)(表4)。

表4 多元回归模型矫正基线资料后不同COS方案不同P/O比值对FET妊娠结局的影响分析
三、两种COS方案中不同P/O亚组对妊娠结局影响的交互作用分析
将两种COS方案中不同P/O亚组间的妊娠结局行分层分析及交互作用检验,结果显示:在P/O Ⅰ组和Ⅱ组中,不论长方案或拮抗剂方案,随着P/O比值升高,妊娠结局均未见统计学差异(P>0.05)(图1,图2)。在拮抗剂方案的Ⅲ组中,随着P/O比值升高,临床妊娠率呈显著下降趋势[OR=0.61,95%CI(0.01,0.89),交互P值=0.026],而流产率、异位妊娠率及持续妊娠率差异均无统计学意义(P>0.05)(图3)。

GnRH-a为长方案;GnRH-ant为拮抗剂方案;Interaction P-value为交互作用检验的P值图1 Ⅰ组中两种COS方案不同P/O比值变化对FET周期妊娠结局影响的分析

GnRH-a为长方案;GnRH-ant为拮抗剂方案;Interaction P-value为交互作用检验的P值图2 Ⅱ组中两种COS方案不同P/O比值变化对FET周期妊娠结局影响的分析

GnRH-a为长方案;GnRH-ant为拮抗剂方案;Interaction P-value为交互作用检验的P值图3 Ⅲ组中两种COS方案不同P/O比值变化对FET周期妊娠结局影响的分析
讨 论
在COS过程中,外源性FSH可诱导卵巢颗粒细胞上黄体生成素受体(LHR)的表达,特别在卵泡晚期,超生理水平的FSH和E2协同作用致LHR大量表达,颗粒细胞对LH或LH类似物更加敏感。即使GnRH-a或拮抗剂控制内源性LH处于低水平,但与大量LHR结合仍会导致P水平的升高[13]。目前认为,HCG日异常升高的P水平通过改变子宫内膜种植窗口期基因谱的异常表达而降低内膜容受性,进而影响新鲜周期胚胎移植的妊娠结局[2-3,14]。
另有研究表明,HCG日升高的P水平对胚胎发育亦有负面作用,特别当HCG日P≥4.0 noml/L时,可明显影响卵子及胚胎质量[15]。2019年马媛等[16]对6 414个周期进行回顾性分析证实,HCG日P水平的升高会降低可利用胚胎率。这种对胚胎的负面影响是否会持续到后续的FET周期,目前研究较少。一项囊括了7 229个周期的研究发现FET周期的妊娠结局不受提前升高的HCG日P水平的影响[6]。而另一项纳入3 400个周期的回顾性分析结果显示,HCG日高P水平降低了可用胚胎率,因此降低了后续周期的累积活产率[7]。
由于不同的作用原理,上述差别在不同的COS方案中是否一致尚不清楚。目前临床较常用的COS方案是GnRH-a长方案及拮抗剂方案。Santos-Ribeiro等[17]研究显示,拮抗剂方案患者当HCG日P≤1.56 nmol/L或>4.68 nmol/L时活产率明显降低。Orvieto等[18]认为长方案HCG日P升高的发生率较拮抗剂方案高。此外,考虑HCG日P水平与卵巢反应、多个卵泡的累积效应有关[19],因此研究升高的P水平对卵子和胚胎质量及后续FET周期的影响,应以HCG日P水平/获卵数的比值,即每个卵子对应的P水平为自变量指标更准确[20-21]。目前探讨P/O比值与FET周期妊娠结局关系的报道甚少,可参考的分组依据亦较少。有文献认为P/O比值对妊娠结局影响的cut-off值为0.38[22],还有研究将分组切点定为0.34[23]。本研究将Ⅱ组与Ⅲ组间的分组切点定为0.34,与文献中类似。为探索更精确的P/O比值区间,又将<0.34的研究对象分为两组,因此本研究中将研究对象一共分为3组,切点分别为0.17及0.34。
单因素统计结果显示:随着P/O比值增高,拮抗剂方案组FET周期着床率、临床妊娠率及持续妊娠率均处于下降趋势。然而矫正基线数据后,不论长方案或拮抗剂方案,其后续FET周期妊娠结局均不受P/O比值变化的影响,与目前多数研究[6,16]结论一致。本研究进一步对两种COS方案的不同P/O比值亚组间进行细化的分层分析,发现在P/O高值组,拮抗剂方案组中随着HCG日P/O比值升高,后续FET周期临床妊娠率呈下降趋势,而长方案组不受影响。既往此类研究多以整体人群为研究对象,未进行不同COS方案的不同P/O比值组间的分层分析。而分层分析后长方案与拮抗剂方案妊娠结局的不同,考虑可能与两种方案不同的作用机理相关。
GnRH-a长方案在使用外源性Gn前经过了垂体降调节,即连续小剂量的GnRH-a与垂体GnRH受体结合使受体消耗,最终垂体脱敏抑制内源性Gn的分泌,使体内LH保持相对稳定的低水平,较好地抑制早发型LH峰的发生,降低卵泡黄素化发生率。GnRH拮抗剂通过与内源性GnRH竞争性结合受体,迅速减少垂体Gn分泌,而这种竞争性结合是可逆的,去除用药后48 h即可解除对垂体的抑制。该方案摆脱了恢复周期较长的降调节作用,对垂体抑制较小,故LH水平略高或早发型LH峰发生率较高[24]。高的LH水平与晚卵泡期卵泡上大量表达的LHR相结合致使P水平上升,因此卵泡黄素化发生率增加,潜在的卵子质量及胚胎质量下降,可能导致拮抗剂方案后续FET周期临床妊娠率下降。
2017年一项体外试验研究表明,FSH可刺激体外培养的卵巢颗粒细胞中3β-羟基类固醇脱氢酶(3β-HSD)的表达并增加其酶促活性,从而将孕烯醇酮转化为P,促进颗粒细胞中P的合成和输出[25]。相较于拮抗剂方案,GnRH-a长方案对垂体抑制较深,Gn用量多[26]。因此,长方案中高剂量的Gn刺激卵巢,促使生成P的酶表达及活性进一步增加,导致高水平P累积,渗漏到体循环中使血清P水平升高,而非卵泡黄素化。故同样的P/O高值组,两种方案每卵泡对应的P水平上升原理不同可能是导致后续FET周期妊娠结局不同的重要原因。
2017年Cochrane数据库中的meta分析结论提示:不同子宫内膜准备方案对种植率、临床妊娠率、继续妊娠率及活产率的影响几无差别[27],因此本研究在设计时未考虑子宫内膜准备方案对妊娠结局的影响。2020年Gerber等[28]对17 830个周期统计分析的结果显示:Gn总量过高可能通过改变子宫内膜容受性而降低新鲜周期移植的活产率,而FET周期的妊娠结局无明显变化,此结论与既往研究[29]一致,同时该文献中回归分析的结果显示:不论新鲜移植周期还是FET周期,妊娠结局均不受Gn刺激时长的影响。因此,本文亦未将Gn天数纳入统计分析。
综上所述,应用GnRH-a长方案促排卵后续FET周期妊娠结局不受HCG日P/O比值影响;而拮抗剂方案中,在P/O高值组,随着其比值升高,后续FET周期临床妊娠率有下降趋势。因此,应用拮抗剂方案促排卵应密切关注HCG日P水平。若既往出现HCG日P升高史,再次COS可首选GnRH-a长方案,以获得较优的妊娠结局。但本研究仍有一定局限性,尚需多中心、前瞻性的研究对后期活产率及妊娠期并发症行全面的统计分析以进一步证实这一结论。

