右星状神经节注入外源性神经生长因子对糖尿病大鼠室性心律失常的影响
刘超,王志苗,胡和生,陈明友,穆伟,徐振兴,闫素华,薛梅
山东第一医科大学第一附属医院(山东省千佛山医院)心血管病学山东省医药卫生心律失常重点实验室,济南250000
心脏自主神经病变(CAN)是糖尿病(DM)最常见的并发症之一[1-4]。目前,糖尿病心脏自主神经病(DCAN)的病因尚不明确,但神经生长因子(NGF)水平降低已被证实参与了DCAN 的发生。IEDA等[5]研究显示,心脏组织NGF 表达降低是DM 神经病变的原因之一。前期研究显示,DM 大鼠心脏组织NGF 蛋白表达降低不均匀与心脏交感神经异质性的发生有关,提示心脏组织NGF 蛋白表达可能参与了室性心律失常(VAs)的发生发展[6-7]。目前为止,关于治疗DCAN 继发VAs 的相关研究较少。有研究将外源性NGF 注入患有心肌梗死犬的右星状神经节,发现其QT 间期(QTc)缩短,且VAs 发生率降低[8]。2019 年1 月—2020 年3 月,本研究向DM 大鼠右星状神经节注入外源性NGF,观察其对大鼠左、右心室交感神经和VAs的影响,为DCAN 的治疗提供新思路。
1 材料与方法
1.1 材料 实验动物:雄性Wistar 大鼠70 只,7 周龄,体质量250~300 g,购自山东大学动物中心;标准条件下大鼠单只放置于温、湿度可控的房间里,自由摄食、摄水。主要试剂:链脲佐菌素(STZ)、3% 戊巴比妥钠购自美国Sigma 公司,酪氨酸羟化酶(TH)一抗购自美国Millipore 公司,牛血清白蛋白购自北京中杉金桥生物技术有限公司,Prime Script RT 试剂盒购自日本TaKaRa 公司。啮齿动物呼吸机(HX-300S)购自成都泰盟科技有限公司。
1.2 DM 模型建立及分组处理 将70 只雄性Wistar 大鼠适应性喂养1 周,随机分为对照组20 只、DM 组25 只和DN 组25 只。DM 组、DN 组通过向大鼠腹腔注射STZ 50 mg/kg的方法建立DM模型[7],对照组腹腔注射等体积生理盐水。DM 建模成功标准:腹腔注射STZ 后48 h 非空腹血糖>250 mg/dL。持续喂养第20 周时,DM 组和DN 组大鼠腹腔注射3% 戊巴比妥钠50 mg/kg 进行麻醉;以C7棘突的软骨突为大鼠右星状神经节标志,DN组于此处注射外源性NGF 20 μg/kg,NGF 分3 次注射,每3 d 注射1次,DM 组于此处注射等量生理盐水[9-10]。随后再持续喂养4周,共喂养24周,期间每周记录大鼠体质量及空腹血糖,血糖过高者给予鱼精蛋白胰岛素腹腔注射,维持血糖在350~450 mg/dL,剔除过于瘦弱和血糖超过600 mg/dL 的大鼠,最终对照组14 只、DM组19只和DN组19只。
1.3 心脏电生理检查
1.3.1 VAs 诱发情况 各组持续喂养24 周后进行麻醉,用啮齿动物呼吸机进行气管内插管机械通气辅助呼吸,开胸后将电极植入右心室心外膜表面,用该电极进行标准化的刺激方案[11]。以120 ms 的周期长度(S1)进行8 次节律性搏动以诱导VAs,然后以略短于120 ms 的间隔进行1~3 个额外刺激(S2、S3、S4);设置刺激强度为起搏阈值的2 倍,刺激时长为5 ms。使用生物信号采集系统(BL-420S)执行并进行记录,实验方案在10 min内完成,发生单形性室性心动过速、多形性室性心动过速、室扑和室颤均视为成功诱发VAs,记录三组大鼠VAs诱发情况。
1.3.2 QTc、QT 离散度(QTd)测量 在1.3.1 行电生理检查时测量并记录三组大鼠的QTc、QTd。在QRS 波群开始到T 波回到等电线的3 个连续搏动中测量QTc,QTc=QT/RR,以最长QTc减去最短QTc的绝对值计算QTd。基线QTc 和QTd 均使用Bazett 公式进行校正。
1.4 左、右心室TH 阳性神经纤维分布及密度检测 采用免疫组化法。各组大鼠电生理检查完毕后,处死取出心脏,生理盐水洗净。取一部分左、右心室组织,10% 甲醛固定24 h,石蜡包埋,5 μm 厚度进行切片。将石蜡切片去石蜡,重新水化,3%H2O2溶液中孵育,PBS 洗涤10 min 以灭活内源性过氧化物酶。92~98 ℃条件下,将玻片在0.1% 柠檬酸缓冲液中浸泡15 min,冷却至室温后用PBS 洗涤。牛血清白蛋白封闭,加入抗TH 一抗(稀释比例1∶500),孵育2 h;加入辣根过氧化物酶标记的二抗,室温孵育20 min;DAB显色试剂盒检测免疫反应产物。将切片用苏木精复染,显微镜下观察可见TH 阳性神经纤维染色呈棕色,以TH 阳性神经纤维染色情况表述左、右心室交感神经的分布特征。 使用Image-Pro plus 6.0 软件识别TH 阳性神经纤维,TH阳性神经纤维密度=标记的神经纤维面积/视野总面积[12]。每只大鼠均选取左、右心室共6个切片,并选择至少3个视野计算平均TH阳性神经纤维密度。
1.5 左、右心室组织TH、NGF mRNA 表达检测采用Real-time PCR 法。取各组新鲜的左、右心室组织,TRIzol 法提取总RNA,Prime Script RT 试剂盒进行逆转录。通过SYBR Premix Ex Taq 进行实时PCR 检测。引物序列:TH 上游引物5′-ACTGGAGGCTGTGGTATTTGAG-3′,下 游 引 物5′-GAGACAAGGAGGAGGAGGGTTTTG-3′;NGF 上 游 引 物5′-TCGCTCACTCCACTATCCACT-3′,下游引物5′-AGCTCAACAGGGCAAGCATAC-3′;内参GAPDH 上游引物5′-ACAGCAACAGGGTGGTGGAC-3′,下游引 物5′-TTTGAGGGTGCAGCGAACTT-3′。 PCR 反应条件:95 ℃预变性5 s,95 ℃变性5 s,60 ℃退火/延伸30 s,重复后两步循环40 次。采用2-ΔΔCt法[13]计算TH、NGF mRNA 相对表达量。
1.6 统计学方法 采用SPSS18.0 统计软件。计量资料以±s表示,多组间比较采用方差分析,组间和组内比较分别采用成组t检验和配对t检验。P<0.05为差异有统计学意义。
2 结果
2.1 三组大鼠VAs 发生率及QTc、QTd 比较 对照组、DM 组和DN 组VAs 发生率分别为7.1%(1/14)、42.1%(8/19)、10.5%(2/19),DM 组VAs 发生率及QTc、QTd 均高于对照组和DN 组(P均<0.05);对照组和DN 组VAs 发生率及QTc、QTd 比较差异均无统计学意义(P均>0.05)。见表1。
表1 三组大鼠QTc、QTd比较(ms,± s s)
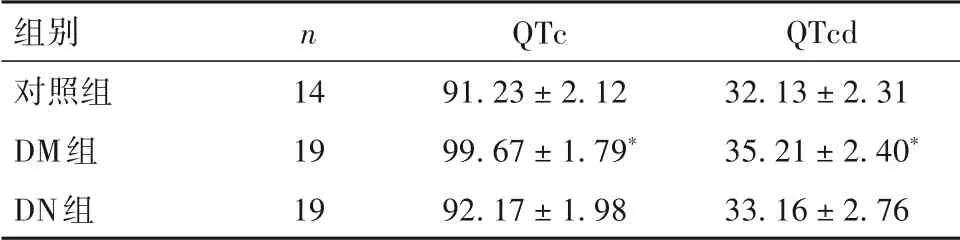
表1 三组大鼠QTc、QTd比较(ms,± s s)
注:与对照组及DN组比较,*P<0.05。
组别对照组DM组DN组n 14 19 19 QTc 91.23 ± 2.12 99.67 ± 1.79*92.17 ± 1.98 QTcd 32.13 ± 2.31 35.21 ± 2.40*33.16 ± 2.76
2.2 三组大鼠左、右心室TH 阳性神经纤维分布及密度比较 DM 组右心室TH 阳性神经纤维密度低于左心室(P<0.05),对照组和DN 组的左、右心室TH 阳性神经纤维密度比较差异均无统计学意义(P均>0.05);在相同心室,DM 组TH 阳性神经纤维密度均低于对照组和DN 组(P均<0.05),对照组和DN 组TH 阳性神经纤维密度比较差异均无统计学意义(P均>0.05)。见表2。TH 阳性神经纤维分布情况:对照组TH 阳性神经纤维主要分布在血管周围,并表现为沿相邻肌纤维蛋白的纵轴走行,左心室神经纤维多粗于右心室(图1A、B);DM 组左、右心室TH 阳性神经纤维分布特征与对照组相似,但密度及神经纤维直径低于对照组(图1C、D);DN 组左、右心室TH 阳性神经纤维分布情况、密度及直径均接近对照组(图1E、F)。

图1 三组TH阳性神经纤维分布情况(免疫组化法)
表2 三组大鼠左、右心室TH阳性神经纤维密度比较(± s s)

表2 三组大鼠左、右心室TH阳性神经纤维密度比较(± s s)
注:与同组左心室比较,*P<0.05;与对照组及DN 组相同心室比较,#P<0.05。
组别对照组DM组DN组n 14 19 19左心室2 412.0 ± 119.8 1 658.0 ± 129.8#1 889.0 ± 110.9右心室2 298.0 ± 112.0 1 012.0 ± 154.2*#1 780.0 ± 98.6
2.3 三组大鼠左、右心室TH、NGF mRNA 表达比较 DM 组右心室TH、NGF mRNA 相对表达量均低于左心室(P均<0.05),对照组和DN组的左、右心室比较差异均无统计学意义(P均>0.05);在相同心室,DM组TH、NGF mRNA相对表达量均低于对照组和DN 组(P均<0.05),对 照 组 和DN 组TH、NGF mRNA 相对表达量比较差异均无统计学意义(P均>0.05)。见表3。

表3 三组大鼠左、右心室TH、NGF mRNA表达比较(x ± s)
3 讨论
交感神经系统在心脏的正常生理功能中起关键作用[12-15]。前期研究发现,DM 可导致心脏中NGF表达的不均匀下降,导致相应区域内交感神经分布不对称,从而发生DCAN,进一步引起VAs 发生率升高[6]。在具有DCAN 的DM 患者中,交感神经的不均匀分布可引起心肌的不对称电重构,从而增加了心脏电生理的异质性和分散性,以上均可导致QTc 延长和VAs 发生率升高[16-18]。本研究结果显示,DM 组VAs 发生率及QTc、QTd 均高于对照组,说明DM 可促进大鼠QTc、QTd升高及VAs的发生,与WHITSEL等[19]研究结果一致。
儿茶酚胺是人体内一种重要的神经递质,由酪氨酸经过一系列反应合成而来;TH 是此过程第一个催化酶,也是限速酶,其检测为阳性的部位可代表交感神经的分布。本研究结果显示,DM 组大鼠左、右心室TH 阳性神经纤维密度和TH mRNA表达均显著低于对照组,且DM 组左心室中TH 阳性神经纤维密度和TH mRNA 表达高于右心室;提示DM 大鼠存在明显的左、右心室交感神经异质性,结合DM 组VAs 发生率较对照组显著增加,QTc、QTd 较对照组显著延长,推测可能是右心室明显的去神经化导致DM 大鼠左心室交感神经相对亢进。为了减少DM 大鼠左、右心室之间的交感神经分布和电生理的异质性,本研究将NGF 注入右星状神经节。结果显示,DN 组左、右心室TH 和NGF mRNA 表达无显著差异,说明其左、右心室交感神经异质性和NGF 的分布异质性均消失;在相同心室中,DN 组VAs 发生率、QTc、QTd 均明显低于DM 组,TH 阳性神经纤维密度和TH mRNA 表达均明显高于DM 组,并与对照组比较无明显差异;表明NGF 注入右星状神经节后,DM 大鼠左心室和右心室之间交感神经支配的异质性得到缓解,QTc、QTd 降低,从而减少了VAs 的发生。
分析右星状神经节注入外源性NGF 减少DM 大鼠VAs 发生的相关机制,一是可能与来自右星状神经节的传入交感神经纤维导致左星状神经节中交感神经被抑制有关[20];其次可能与NGF 注入右星状神经节导致右心室交感神经过度亢进,从而降低左、右心室之间的电生理异质性有关[8]。在DM 大鼠中,外源性NGF 可能会增加轴突和神经元的再生,改善神经内膜血流量,并刺激神经生长,这些均可能导致心室尤其是右心室的区域性交感神经再生。随着心室左右电生理异质性的修复,QTc逐渐降低,心脏对电刺激的反应性也降低。因此,DM大鼠的VAs发生率也显著降低,但是其具体的机制仍有待进一步研究。
综上所述,DM 大鼠存在左、右心室交感神经去神经化的不均衡性及交感神经分布的异质性,使该区域出现电生理的不稳定性,表现为QTc、QTd 明显延长和VAs 发生率增加;右星状神经节注入外源性NGF 可通过降低左、右心室交感神经异质性及缩短QTc、QTd而减少DM大鼠VAs的发生。

