利妥昔单抗联合个案管理的延伸护理在非霍奇金淋巴瘤患者治疗中的应用研究
张涵博,张 晨,赵新玲,郝彩琴
(北京肿瘤医院移植与免疫治疗中心,北京 100142)
非霍奇金淋巴瘤可发生于淋巴造血系统、淋巴器官、淋巴结外淋巴组织等部位,异质性较强,引发此病的因素有很多,如感染、遗传、放射线刺激等,也可能和机体自身的免疫功能有关。目前,非霍奇金淋巴瘤的治疗方法有手术切除、全身化疗、局部放疗及生物免疫学方法等,环磷酰胺、长春新碱、吡柔比星等药物联合化疗为非霍奇金淋巴瘤目前的主要化疗方案,对于初治患者能取到满意的疗效,但对于复发或侵袭性非霍奇金淋巴瘤患者效果不佳[1]。利妥昔单抗是一种CD20抗原嵌合型单克隆抗体,可作用于B细胞,有助于提高肿瘤细胞对化疗药物的敏感性,从而提高肿瘤患者的临床疗效[2]。此外,大多非霍奇金淋巴瘤患者由于受到身体、精神的双重压力,容易产生一系列负性情绪,导致患者治疗依从性较差,进而影响治疗效果,故患者治疗期间需予以适当的护理干预,个案管理的延伸护理结合患者实际需求开展个体化护理服务,有助于强化治疗效果[3]。本研究旨在探讨利妥昔单抗联合个案管理的延伸护理对非霍奇金淋巴瘤患者免疫功能及血清乳酸脱氢酶(LDH)、血管内皮细胞生长因子(VEGF)、胸腺嘧啶核苷激酶 -1(TK-1)水平的影响,现报道如下。
1 资料与方法
1.1 一般资料 按照随机数字表法将2018年6月至2020年6月于北京肿瘤医院就诊的80例非霍奇金淋巴瘤患者分为对照组与观察组,各40例。对照组患者中男性、女性各20例;年龄23~58岁,平均(42.60±3.10)岁;临床分期[4]:Ⅱ期11例,Ⅲ期16例,Ⅳ期13例。观察组患者中男性、女性分别为21、19例;年龄22~59岁,平均(42.68±3.14)岁;临床分期:Ⅱ期12例,Ⅲ期16例,Ⅳ期12例。两组患者一般资料比较,差异无统计学意义(P> 0.05),组间具有可比性。纳入标准:符合《中国恶性淋巴瘤诊疗规范(2015年版)》[5]中的相关诊断标准者;经病理学、细胞学、淋巴细胞结检查确诊者;预计生存时间 >6个月者等。排除标准:近4周内进行过放、化疗及免疫治疗者;有化疗禁忌证者;合并呼吸系统疾病、免疫系统功能障碍者;伴其他血液肿瘤(白血病、骨髓异常增生综合征等)者;伴重要脏器功能异常、全身感染性疾病、自身免疫性疾病者;肿瘤已经侵犯中枢神经系统者等。患者及家属均知情并签署同意书,且本研究经北京肿瘤医院医学伦理委员会审核并批准。
1.2 方法
1.2.1 治疗方法 给予对照组患者单纯化疗,注射用环磷酰胺(瀚晖制药有限公司,国药准字H20093391,规格:0.1 g/支)0.8 g/m2+注射用硫酸长春新碱(瀚晖制药有限公司,国药准字H20043326,规格:1 mg/支)1.5 mg/m2+注射用盐酸吡柔比星(深圳万乐药业有限公司,国药准字H10930105,规格:10 mg/支)40 mg/m2静脉滴注,1次/3 d;同时予以醋酸泼尼松片(长春长红制药有限公司,国药准字H22022036,规格:5 mg/片)口服,60 mg/次,1次/d。观察组在对照组的基础上予以利妥昔单抗注射液[Roche Diagnostics GmbH,注册证号J20170002,规格:100 mg/10 mL]375 mg/m2静脉滴注,1次/周。3周为1个疗程,两组均治疗6个疗程。化疗期间给予患者保护胃黏膜、止吐等常规对症治疗,若患者出现不良反应则减少药物剂量。
1.2.2 护理方法 两组患者在化疗期间均给予个案管理的延伸护理干预,具体包括:①建立档案,为所有非霍奇金淋巴瘤患者建立个人档案,详细记录其姓名、性别、文化水平、病情、治疗情况、治疗方案认可度、疾病认知度、联系方式(微信/QQ号、电话号)等,对患者各方面情况进行综合评估,并据其具体情况制定个体化管理与护理措施,询问其院外护理需求。②心理干预,根据评估情况,选择合理的沟通方式和话题,疏解患者恐惧、悲观、担忧等不良情绪,并在治疗间歇期,以舒缓音乐为背景,引导患者想象,尝试放松训练,缓解神经功能紊乱引发的不适。③健康教育,运用面对面讲座、健康教育手册、视频文件等方式对患者和家属进行健康宣教,通过微信/QQ群,定期将健康知识、自我护理技能、自我管理方法等发送到群里,同时积极主动与患者互动,提醒患者定期进行学习,耐心解答患者提出的问题,每周至少1次;帮助患者了解疾病基础知识、治疗方法与效果、常见并发症及处理方法等,然后帮助患者树立治疗、改变不良行为的信心;定期组织座谈会,倾听患者的诉求,和家属共同寻找解决的方法。④行为干预:根据患者自身情况制定个体化作息、饮食、功能锻炼规划等,可通过微信/QQ等进行监测,同时嘱患者家属协助患者按计划完成目标。⑤建立社会家庭支持系统,调动家庭其他成员或者患者好友鼓励支持患者,帮助患者树立回归社会与家庭的信心,树立家属自身强大的心理状态,在患者面前不叹气、不哭泣,通过自身的坚强帮助患者重拾信心。
1.3 观察指标 ①临床疗效。完全缓解(CR)∶所有临床上、影像学上可检测的病灶消失,持续稳定时间 >28 d;部分缓解(PR)∶CT扫描病灶缩小 >50%,无新病灶产生;病情稳定(SD)∶病灶增大 ≤ 25%或缩小 ≤ 50%;疾病进展(PD)∶病灶增大 >25%或出现新的病灶[5]。客观缓解率 = CR率+PR率。②免疫功能。采集两组患者治疗前后空腹静脉血3 mL,3 000 r/min离心10 min取血清,以免疫比浊法检测血清补体C3、C4及免疫球蛋白A(IgA)、免疫球蛋白M(IgM)、免疫球蛋白G(IgG)水平。③血清学指标。血液采集与血清制备方法同②,以酶联免疫吸附试验检测血清LDH、VEGF、TK-1水平。④治疗期间不良反应(脱发、恶心呕吐、骨髓抑制、白细胞减少、肝功能损害)发生情况比较。
1.4 统计学方法 采用 SPSS 21.0统计软件进行数据处理,计数资料以[ 例(%)]表示,采用χ2检验;计量资料以(±s)表示,采用t检验。以P< 0.05为差异有统计学意义。
2 结果
2.1 临床疗效 治疗后观察组患者的客观缓解率显著高于对照组,差异有统计学意义(P< 0.05),见表1。
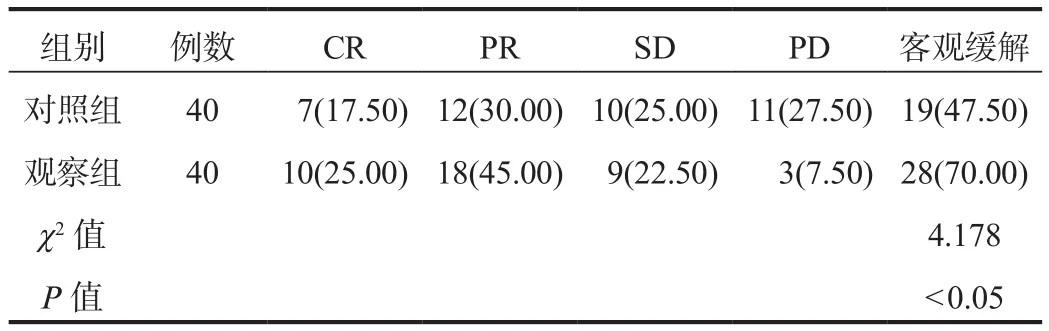
表1 两组患者临床疗效比较[ 例(%)]
2.2 免疫功能 治疗后,两组患者血清IgA、IgG、IgM及C3、C4水平较治疗前均显著降低,且观察组患者C3、C4水平显著低于对照组,差异均有统计学意义(均P< 0.05),两组患者治疗后血清IgA、IgG、IgM水平经比较,差异均无统计学意义(均P> 0.05),见表2。
表2 两组患者免疫功能比较( ±s, g/L)
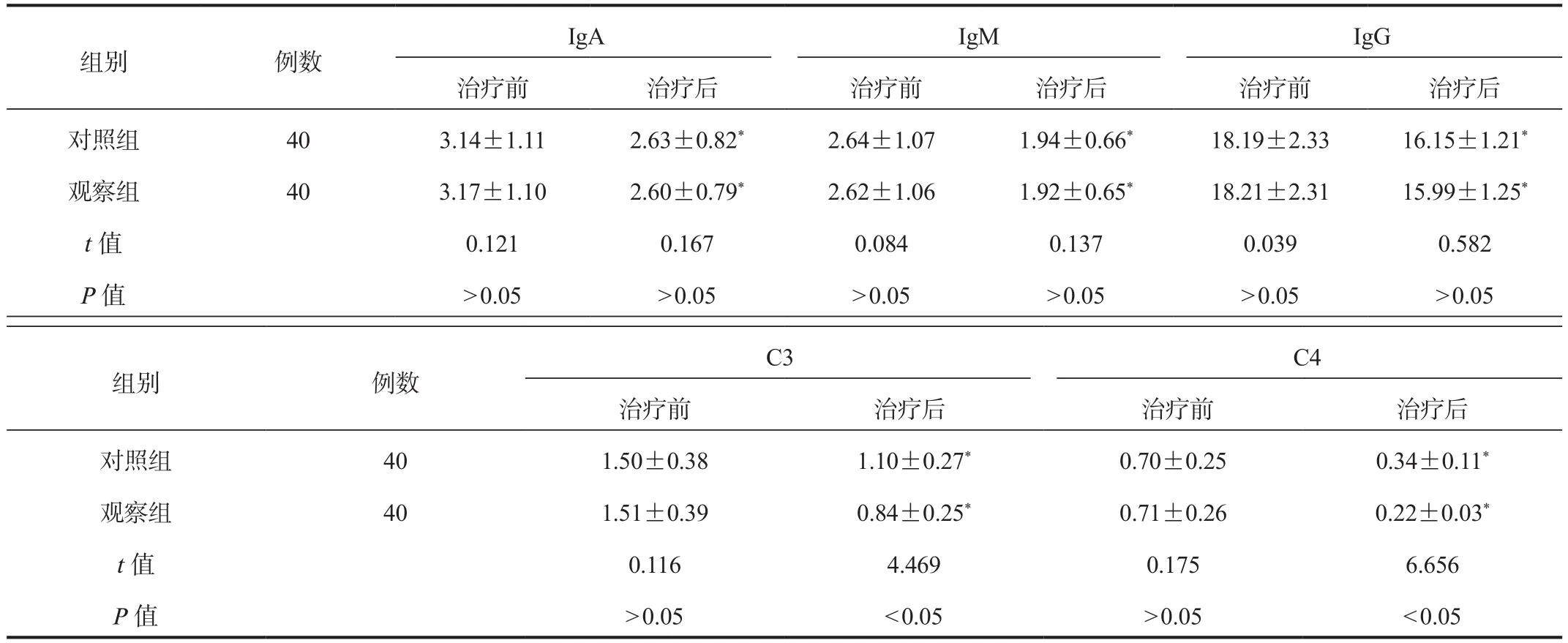
表2 两组患者免疫功能比较( ±s, g/L)
注:与治疗前比,*P < 0.05。IgA:免疫球蛋白A;IgM:免疫球蛋白M;IgG:免疫球蛋白G。
组别 例数IgA IgM IgG治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 40 3.14±1.11 2.63±0.82* 2.64±1.07 1.94±0.66* 18.19±2.33 16.15±1.21*观察组 40 3.17±1.10 2.60±0.79* 2.62±1.06 1.92±0.65* 18.21±2.31 15.99±1.25*t值 0.121 0.167 0.084 0.137 0.039 0.582 P值 > 0.05 > 0.05 > 0.05 > 0.05 > 0.05 > 0.05组别 例数C3 C4治疗前 治疗后 治疗前 治疗后对照组 40 1.50±0.38 1.10±0.27* 0.70±0.25 0.34±0.11*观察组 40 1.51±0.39 0.84±0.25* 0.71±0.26 0.22±0.03*t值 0.116 4.469 0.175 6.656 P值 > 0.05 < 0.05 > 0.05 < 0.05
2.3 血清学指标 治疗后两组患者血清LDH、VEGF、TK-1 水平较治疗前均降低,且观察组显著低于对照组,差异均有统计学意义(均P< 0.05),见表3。
表3 两组患者血清学指标比较( ±s)

表3 两组患者血清学指标比较( ±s)
注:与治疗前比,*P < 0.05。LDH:乳酸脱氢酶;VEGF:血管内皮细胞生长因子;TK-1:胸腺嘧啶核苷激酶 -1。
组别 例数LDH(U/L) VEGF(pg/mL) TK-1(pg/mL)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 40 352.87±53.58 112.31±16.52* 312.73±25.37 203.14±16.47* 4.36±0.49 2.47±0.31*观察组 40 351.96±52.57 61.18±10.33* 313.76±24.33 118.36±10.25* 4.33±0.52 1.73±0.27*t值 0.077 16.597 0.185 27.640 0.266 11.385 P值 > 0.05 < 0.05 > 0.05 < 0.05 > 0.05 < 0.05
2.4 不良反应 治疗期间两组患者各项不良反应发生率比较,差异均无统计学意义(均P> 0.05),见表4。
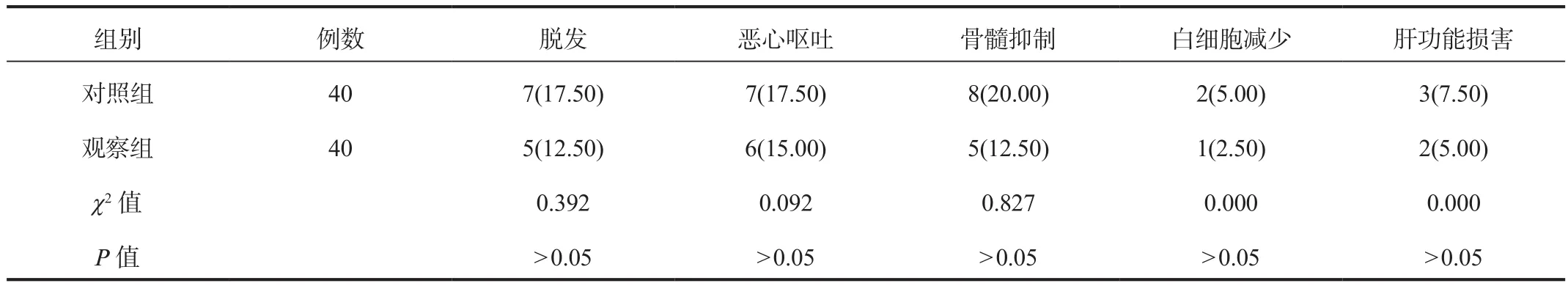
表4 两组患者不良反应发生率比较[ 例(%)]
3 讨论
非霍奇金淋巴瘤属于免疫系统恶性肿瘤,但其发病机制尚未完全明确,该疾病典型的临床症状为颈部和锁骨上出现无痛性、进行性增大的淋巴结,部分患者还会出现发热、消瘦、盗汗等全身症状。化疗为非霍奇金淋巴瘤最常用的治疗方法,可延长患者生存期,并改善其预后,但部分患者的化疗敏感性较低,且化疗期间部分患者可出现耐药、复发等情况,使得患者疗效欠佳[6]。此外,非霍奇金淋巴瘤患者随着化疗周期增加,不良反应亦随之增加,从而进一步加重患者癌因性疲乏程度、心理负性情绪等,加之患者治疗期间因缺乏专业性指导、疾病认知度较低等因素,不利于患者治疗的顺利进行,容易影响治疗效果,故治疗期间予以适当干预对改善患者治疗效果至关重要。个案管理的延伸护理可通过开展个体化护理服务,根据患者实际需求予以针对性心理干预、健康教育、行为干预等,有助于帮助患者树立治疗信心,进而提高治疗效果[7]。
利妥昔单抗作为第一代针对CD20的人鼠嵌合性单克隆抗体,可以特异性地结合淋巴细胞上的CD20抗原杀伤肿瘤细胞[8]。个案管理的延伸护理可根据每个患者不同的需求进行干预,从而满足患者的心理需求,减轻患者心理恐惧感,促使患者积极配合治疗,提高患者依从性,从而提高治疗效果。本研究结果显示,与对照组相比,观察组患者的客观缓解率显著升高,而观察组患者血清C3、C4水平显著降低,两组患者血清IgA、IgG、IgM水平经比较,差异均无统计学意义,提示在非霍奇金淋巴瘤治疗中,应用利妥昔单抗联合个案管理的延伸护理可明显抑制患者肿瘤细胞增殖,提高临床疗效,降低患者机体内补体水平,但对机体免疫球蛋白无显著影响。分析其原因为补体C3、C4参与肿瘤的生理进展活化阶段,患者免疫功能降低时,体液免疫会对应升高,导致补体水平升高,而利妥昔单抗注射液通过补体依赖性发挥作用,进而降低补体水平。
LDH是糖降解酶,其水平越高说明肿瘤细胞增殖能力越强,而随着患者病情不断进展,一旦对周围组织产生侵袭、浸润可刺激机体释放大量LDH,进而形成恶性循环;VEGF水平升高可增加肿瘤细胞侵袭性、促进血管形成而导致病情进展;TK-1则可调控细胞周期,反映细胞增殖状况[9]。利妥昔单抗是抗CD20的嵌合型抗体,其能通过抗体依赖细胞介导的细胞毒作用、补体依赖的细胞毒性等作用,有效发挥细胞毒作用,诱导肿瘤细胞凋亡;同时,利妥昔单抗还可提高肿瘤细胞对于化疗药物的敏感性,其与单纯化疗联合运用可克服耐药性,增强化疗药物对于肿瘤细胞的杀伤作用[10]。本研究结果显示,观察组患者血清LDH、VEGF、TK-1水平均显著低于对照组,提示在非霍奇金淋巴瘤治疗中,利妥昔单抗联合个案管理的延伸护理对肿瘤新生血管和细胞增殖均有明显抑制作用,进而有助于延长患者生存期。
综上,在非霍奇金淋巴瘤治疗中,应用利妥昔单抗联合个案管理的延伸护理可明显抑制肿瘤细胞增殖,提高临床疗效,同时降低机体内补体水平,调节血清学指标,且不增加各项不良反应的发生,值得进一步研究与推广。

