lncRNA HOTAIR靶向调控miR-424的表达水平对卵巢癌细胞生物学行为的影响
段丽娜,杨晶晶,蒋友琴,罗贤琳,刘杰,李颖
1遵义医科大学第三附属医院妇科,贵州遵义 563000;2遵义市第一人民医院妇科,贵州遵义 563000
目前,在全球女性恶性肿瘤中卵巢癌的发病率和死亡率均位居第四[1]。2017年,全球新发卵巢癌约42.8万例,死亡23.2万例[2]。发展中国家的卵巢癌发病率仍处于较高水平,其中85%的患者发现时已处于中晚期(阶段Ⅱ-Ⅲ),在阶段Ⅲ的高达60%[3-4]。卵巢癌进展至晚期或复发后,其预后相对较差。长链非编码RNA(long noncoding RNA,lncRNA)是近年来新发现的一类影响肿瘤转移、复发的生物学标志物[5]。lncRNA存在于人体体液中,是常用的诊断生物标志物[6-7]。然而,目前尚不清楚lncRNA是否为卵巢癌诊断及治疗的有效生物标志物。HOX转录反义RNA(HOX transcript antisense RNA,HOTAIR)是由位于染色体12q13.13上的人HOXC基因座表达翻译的核苷酸分子组成,可将多梳抑制复合物2(polycomb repressive complex 2,PRC2)募集到特定的HOXC基因座靶基因上,产生表观遗传沉默转移抑制的效果[8-9]。晚期卵巢癌中存在HOTAIR表达水平的异常增高[10],且HOTAIR是卵巢癌患者出现远处转移及晚期死亡的危险因素之一[11]。miR-424被认为是胃癌、卵巢癌、结直肠癌、肝癌、乳腺癌等多种肿瘤的调控因子[12]。因此,探讨miR-424与HOTAIR在卵巢癌生物学行为中的作用具有重要意义。
本研究检测了卵巢癌组织中HOTAIR的表达水平,分析HOTAIR表达水平与卵巢癌患者总体存活时间的关系,以及调节下游miRNA表达活性对卵巢癌细胞生长及侵袭的影响,旨在探讨HOTAIR在卵巢癌患者中的生物学表达特性,进而分析其未来应用于临床的可能。
1 材料与方法
1.1组织细胞的培养及实验动物 收集2018年1-6月在遵义医科大学附属第三医院接受卵巢癌手术的60例患者的卵巢癌(n=60)及随机配对卵巢良性肿瘤组织(n=60)样本。所有患者均签署知情同意书,且本研究已获得遵义医科大学附属第三医院伦理委员会批准。卵巢癌细胞系A2780细胞购自美国模式培养物集存库,保存于遵义医科大学实验室,在含有10%胎牛血清的RPMI 1640培养基中生长。4~6周龄BALB/c雌性裸鼠12只,SPF级,体重(17.5±2.0) g,购自遵义医科大学实验动物中心[许可证号:SCXK(贵)2014-0038],于遵义医科大学实验动物中心SPF级动物饲养房饲养[使用许可证:SYXK(贵)2014-0165]。实验过程符合国家及单位有关实验动物的管理和使用规定。
1.2细胞实验分组 将A2780卵巢癌细胞转染小干扰RNA(small interfering RNA,siRNA)构建的siRNAHOTAIR(si-HOTAIR)细胞作为实验组,将转染siRNA-NC(si-NC)的A2780细胞作为对照组,实验组为敲除HOTAIR基因组的细胞,对照组为未敲除HOTAIR基因组的细胞。
1.3实时定量聚合酶链反应(qRT-PCR)检测mRNA表达水平 分别提取卵巢癌及配对卵巢良性肿瘤组织中的总RNA。采用TaqMan MicroRNA反转录试剂盒进行反转录以合成cDNA有义链。然后在qRTPCR系统中进行PCR反应,以β-actin为内参照。反应条件:95 ℃预变性10 min;95℃变性15 s、60 ℃退火32 s;循环50次后检测其熔解曲线。分析各样本Ct值,采用2–ΔΔCt法计算mRNA的相对表达量。实验重复3次。HOTAIR引物:正向5'-GTGGCTAU CTAATCTAGTCGAGCAAACT-3',反向5'-CCTAT GTTCTGATGCGGCAGTGCAAAGT-3';miR-424引物:正向5'-TTGAGCTATCTAAGTTAGCTGACAAT CG-3',反向5'-GCCTAGCTGAGCTACUAAGGGCG AGCA-3'。
1.4双荧光素酶实验测定miR-424荧光素酶活性将野生型(WT)及突变型(MUT)的重组质粒分别转染至A2780卵巢癌细胞中,分别命名为野生型miR-424、突变型miR-424,采用双荧光素酶报告系统测定其荧光素酶活性情况。实验重复3次。野生型miR-424引物:正向5'-GCATGCTAGCTACGGCGG AAAAGCTACT-3',反向5'-ATGCTAGCTAGGGACG GCCAGCACCTATC-3';突变型miR-424引物:正向5'-TCTGATGCTGATGCTAGCGATCGAAA-3',反向5'-GGATGCGGAAACTGAGCTAAAGCGAA-3'。
1.5细胞划痕实验检测HOTAIR对细胞迁移行为的影响 使用200 μl无菌移液器尖端以标准方式将单层细胞划伤,创建无细胞区域。将培养基吸出并使用干净冲洗液冲洗后,再用新鲜的完全培养基在37 ℃条件下继续孵育24 h。24 h后记录并拍照细胞迁移情况。实验重复3次。
1.6Transwell侵袭实验检测HOTAIR对细胞侵袭行为的影响 将1×105个细胞悬浮于200 μl无血清RPMI 1640培养基中,然后接种到上室中。在下室中添加含有胎牛血清的培养基,继续在细胞培养箱中孵育24 h后,除去小室顶部表面上的细胞。底部表面上的细胞用4%多聚甲醛固定,0.1%结晶紫染色后计数入侵细胞数。实验重复3次。
1.7流式细胞仪检测HOTAIR对细胞凋亡行为的影响 将转染的细胞以5×104/孔接种于96孔板中。24 h后用siRNA-HOTAIR(si-HOTAIR)进一步处理细胞48 h,然后用膜联蛋白和碘化丙啶染色,并采用流式细胞仪检测细胞凋亡情况。
1.8裸鼠体内成瘤实验检测HOTAIR对动物体内成瘤的影响 将4~6周龄裸鼠随机分为实验组和对照组,每组6只。将1×106个si-HOTAIR细胞和si-NC细胞分别注射至实验组和对照组裸鼠的下腹部皮下区域。8周后检测裸鼠肿瘤异种移植物的体积及生长情况。移植物大小根据以下公式计算:肿瘤体积=1/2(最短直径)2×最长直径。
1.9统计学处理 采用SPSS 22.0软件进行统计分析。计量资料以±s表示,两组间比较采用t检验;计数资料以例(%)表示,组间比较采用χ2检验;HOTAIR与临床病理参数间的关系采用Pearson'sχ2检验进行分析。P<0.05为差异有统计学意义。
2 结 果
2.1HOTAIR在卵巢癌组织中的表达情况及生存率分析 qRT-PCR结果显示,卵巢癌组织中HOTAIR mRNA表达水平明显高于良性卵巢肿瘤组织(58.64±6.32vs. 6.35±0.02,t=11.09,P<0.05)。对60例卵巢癌患者的生存曲线分析结果显示,HOTAIR高表达患者的远期生存率低于低表达的患者,差异有统计学意义(P<0.05,图1)。

图1 不同HOTAIR表达水平患者的生存率分析Fig.1 Expression of HOTAIR in ovarian cancer and analysis of survival rate
2.2HOTAIR与卵巢癌患者临床病理参数之间的关系 不同年龄段的卵巢癌患者HOTAIR表达水平差异无统计学意义(χ2=11.70,P>0.05);随着卵巢癌病理分期增高,卵巢癌组织中HOTAIR的表达水平明显升高(χ2=11.64,P<0.05);有淋巴结转移的患者较无淋巴结转移患者卵巢癌组织中HOTAIR的表达水平升高,差异有统计学意义(χ2=12.23,P<0.05)(表1)。

表1 卵巢癌组织中HOTAIR表达水平与临床病理特征之间的关系Fig.1 Relationship of the expression of HOTAIR to the clinicopathological features in tissues of patients with ovarian cancer
2.3双荧光素酶实验检测HOTAIR与miR-424的关系 本实验使用生物信息学预测工具(Targetscan)进行分析发现,HOTAIR存在与miR-424相互关联的可能,两者有较为相似的结合序列(图2A)。双荧光素酶实验结果显示,与对照组相比,实验组可抑制野生型miR-424的荧光素酶活性(0.42±0.08vs.1.06±0.11,t=11.38,P<0.05,图2B),而对突变型miR-424的荧光素酶活性无明显影响(1.04±0.10vs.1.05±0.08,t=11.38,P<0.05,图2B)。
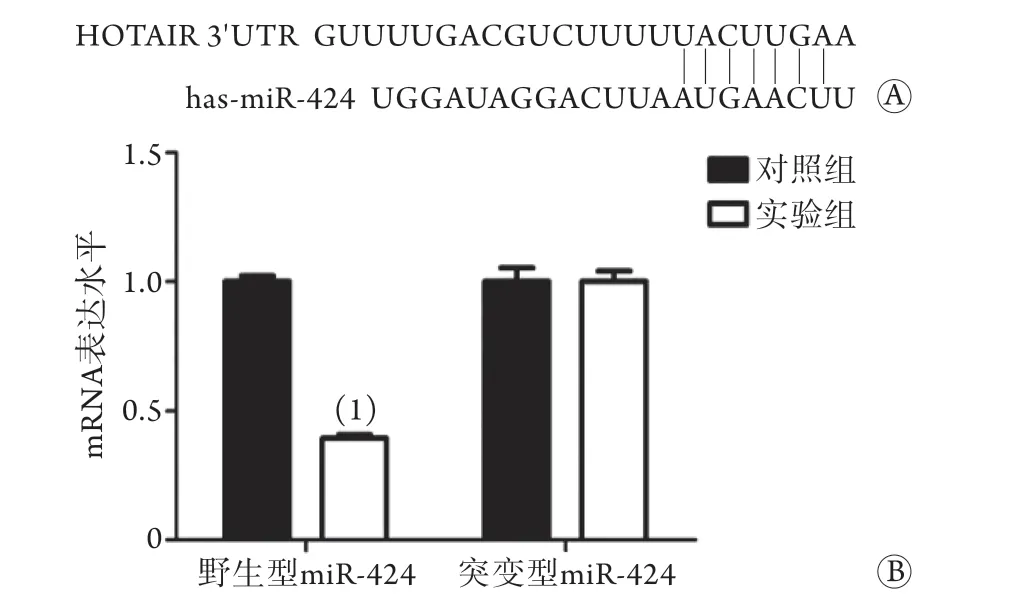
图2 双荧光素酶实验检测HOTAIR与miR-424之间的相互关系Fig.2 Dual luciferase assay to detect the relationship between HOTAIR and miR-424
2.4HOTAIR表达对卵巢癌A2780细胞迁移能力的影响 划痕实验结果显示,实验组细胞24 h的迁移距离明显短于对照组[(21.21±3.08) μmvs.(92.34±8.65) μm,t=12.34,P<0.05],差异有统计学意义(图3)。

图3 划痕实验检测HOTAIR对卵巢癌细胞迁移能力的影响(×40)Fig.3 Effect of HOTAIR on migration ability of ovarian cancer cells detected by scratch test (×40)图中标记为测量宽度
2.5HOTAIR表达对卵巢癌细胞侵袭行为的影响结晶紫染色结果显示,实验组的细胞侵袭率明显低于对照组(28.63%±5.59%vs. 275.36%±21.62%,P<0.05,图4)。

图4 HOTAIR对卵巢癌细胞侵袭行为的影响(结晶紫染色,×40)Fig.4 Effect of HOTAIR on the invasion behavior of ovarian cancer cells (Crystal violet staining, ×40)
2.6HOTAIR表达对卵巢癌细胞凋亡行为的影响
流式细胞术检测结果显示,实验组细胞凋亡率明显高于对照组(30.2%±2.12%vs. 7.31%±2.01%,t=10.64,P<0.05,图5)。

图5 HOTAIR对卵巢癌细胞凋亡的影响Fig.5 Effect of HOTAIR on the apoptosis of ovarian cancer cells
2.7HOTAIR对裸鼠体内移植瘤生长的影响实验组裸鼠体内肿瘤的直径及数目均小于对照组,与对照组比较,实验组移植瘤的肿瘤体积[(0.85±0.06) cm3vs. (3.05±0.28) cm3,t=13.41,P<0.05]及重量[(1.12±0.08) gvs. (2.91±0.19) g,t=11.64,P<0.05]均明显降低(图6)。

图6 HOTAIR对裸鼠体内移植瘤体积及重量的影响Fig.6 Effect of HOTAIR on the growth of transplanted tumors in nude mice
3 讨 论
除研究卵巢癌的新型诊断标志物以外,进一步了解卵巢癌进展及转移的分子机制对于开发更有针对性、更有效的治疗方法至关重要[13-14]。lncRNA HOTAIR在卵巢癌过表达或修饰的各种基因和蛋白中发挥重要调控作用[15-16]。本研究分析了卵巢癌患者、卵巢癌细胞系及小鼠异种移植模型中HOTAIR表达的意义,结果显示,与无淋巴结转移者相比,有淋巴结转移的患者肿瘤中HOTAIR表达水平更高,提示高HOTAIR表达状态及淋巴结转移是影响预后的重要因素,HOTAIR可能在卵巢癌的发病机制中起重要作用。然而,本研究存在一些局限性:样本量相对较少;仅使用皮下异种移植模型来研究癌细胞的体内行为,与腹膜内移植肿瘤实验相比误差大(皮下植入的癌细胞允许快速和定量的肿瘤形成,更适合用于连续测量肿瘤的研究,而使用腹膜内和原位异种移植模型定量监测肿瘤生长本质上可代表更逼真的肿瘤微环境)[17-18]。
本研究按患者年龄、病理分期或淋巴结转移进行分层分析,发现不同年龄段的卵巢癌患者HOTAIR表达水平差异无统计学意义,而HOTAIR表达情况与病理分期、有无淋巴结转移有关。越来越多的证据表明,HOTAIR在细胞生长、肿瘤侵袭、癌症转移过程中具有重要作用[19-21]。本研究探讨了HOTAIR的潜在作用,与之前对临床卵巢癌标本的分析结果一致[8,22]。本研究发现,抑制HOTAIR表达后卵巢癌细胞的迁移及侵袭能力受到抑制,且细胞凋亡能力相对增强。此外,HOTAIR的表达与体外培养的卵巢癌细胞的迁移及侵袭能力呈正相关,且与小鼠体内移植瘤的生长呈正相关,提示HOTAIR是导致卵巢癌发生、发展的关键lncRNA之一,有望为临床卵巢癌靶向治疗策略的制定提供了参考。
综上所述,本研究结果提示,HOTAIR可为确定卵巢癌患者的临床病理学阶段及预后判断提供参考。此外,HOTAIR可通过调节miRNA的表达活性影响肿瘤细胞的生长及侵袭能力,可能是一种潜在的治疗靶点,有望为卵巢癌的治疗提供帮助。

