腹腔镜胃癌根治术中应用加速康复外科的Meta分析
张明凯,彭志浩,黄 海,孙宗科,李燕彬,曹连盟
(滨州医学院附属医院胃肠外科,山东 滨州,256603)
胃癌是常见的胃肠道恶性肿瘤之一,居全球癌症相关死亡的第三位[1]。目前,根治性手术仍是最佳治疗手段。随着技术的发展,腹腔镜胃切除术逐渐受到人们的青睐,与传统开放手术相比,具有较多优点,如疼痛明显减轻、术后早期下床、经口进食更早、肠道功能恢复更快、住院时间更短等[2]。加速康复外科(enhanced recovery after surgery, ERAS)理念自1997年由丹麦外科医生Henrik Kehlet首次提出[3],即为使患者快速康复,围手术期采取一系列措施,以减轻患者应激反应,促进胃肠功能恢复,减少并发症等;在多学科均已得到证实[4-6];然而在胃癌方面,对于ERAS联合腹腔镜胃切除术的治疗虽有报道,但样本量多较少,无法准确对ERAS联合胃癌切除术作出评判。本文通过查阅相关文献,采用Meta分析进行系统分析与评价,旨在评价ERAS联合腹腔镜手术治疗胃癌的价值。
1 资料与方法
1.1 文献收集 本研究收集的均为建库以来至2019年4月正式发表的相关文献,检索的数据库包括PubMed、Embase、Cochrane Library、Ovid以及ClinicalKey,采用主题词检索,主题词为:“Laparoscopy”“Stomach Neoplasms”“ERAS”“Fast Track Surgery”“Enhanced Recovery”。根据获得的报告,适当扩大检索范围,以确保未遗漏相关报告。
1.2 文献纳入标准 (1)胃癌;(2)自建库以来至2019年4月发表的关于ERAS联合腹腔镜与传统围术期护理相对照的临床研究;(3)至少报告以下结局指标之一:手术时间、术中出血量、术后离床活动时间、胃肠功能恢复时间(术后首次排气时间)、首次恢复流质饮食时间、术后住院时间、并发症、死亡率、费用及C反应蛋白(C reactive protein,CRP)表达水平等;(4)来自同一机构或作者的两项包含重叠患者的研究报告,纳入较高质量或最新发表的文献;(5)根据ERAS方案的指导原则,每项研究至少包含10个项目。
1.3 文献排除标准 (1)评论、海报、综述、动物实验研究等;(2)缺乏必要的统计分析数据;(3)同一机构或作者的重复研究;(4)缺乏实验组与对照组的直接对比。
1.4 数据提取与质量评价 由两名评价者对纳入文献进行独立提取并核对,如发现争议问题,则由第三名研究人员介入讨论,解决争议问题;如仍有争议,则提交讨论小组。提取的数据包括以下方面:作者、发表时间、事件类型、国家、样本量及术中、术后各项指标。病例对照研究采用纽卡斯尔-渥太华质量评价量表以双盲形式评价纳入的文献,量表范围0~9分;随机对照研究则根据Cochrane协作网工作组制定的Cochrane偏倚风险评价工具进行评价。
1.5 统计学处理 采用Review Manager 5.3进行操作,利用I2检验或Q检验进行异质性分析,若具有显著异质性,则采用随机效应模型;反之,采用固定效应模型。二分类数据采用比值比(odds ratio,OR)作为统计指标,连续型数据则根据是否采用相同的量表及计量单位分别采用加权均数差(weighted mean difference,WMD)或标准均数差(standardized mean difference,SMD)作为统计指标;通过漏斗图评价发表偏倚;二分类变量数据、连续变量数据均计算95%可信区间(confidence interval,CI)及P值,P<0.05为差异有统计学意义。
2 结 果
2.1 纳入文献的一般特征 本文初步检索到文献308篇,经过筛选,最终纳入12篇,包括8篇随机对照研究、4篇病例对照研究,见表1、表2,ERAS联合腹腔镜作为实验组,共413例;传统护理联合腹腔镜作为对照组,共420例。筛选流程见图1。
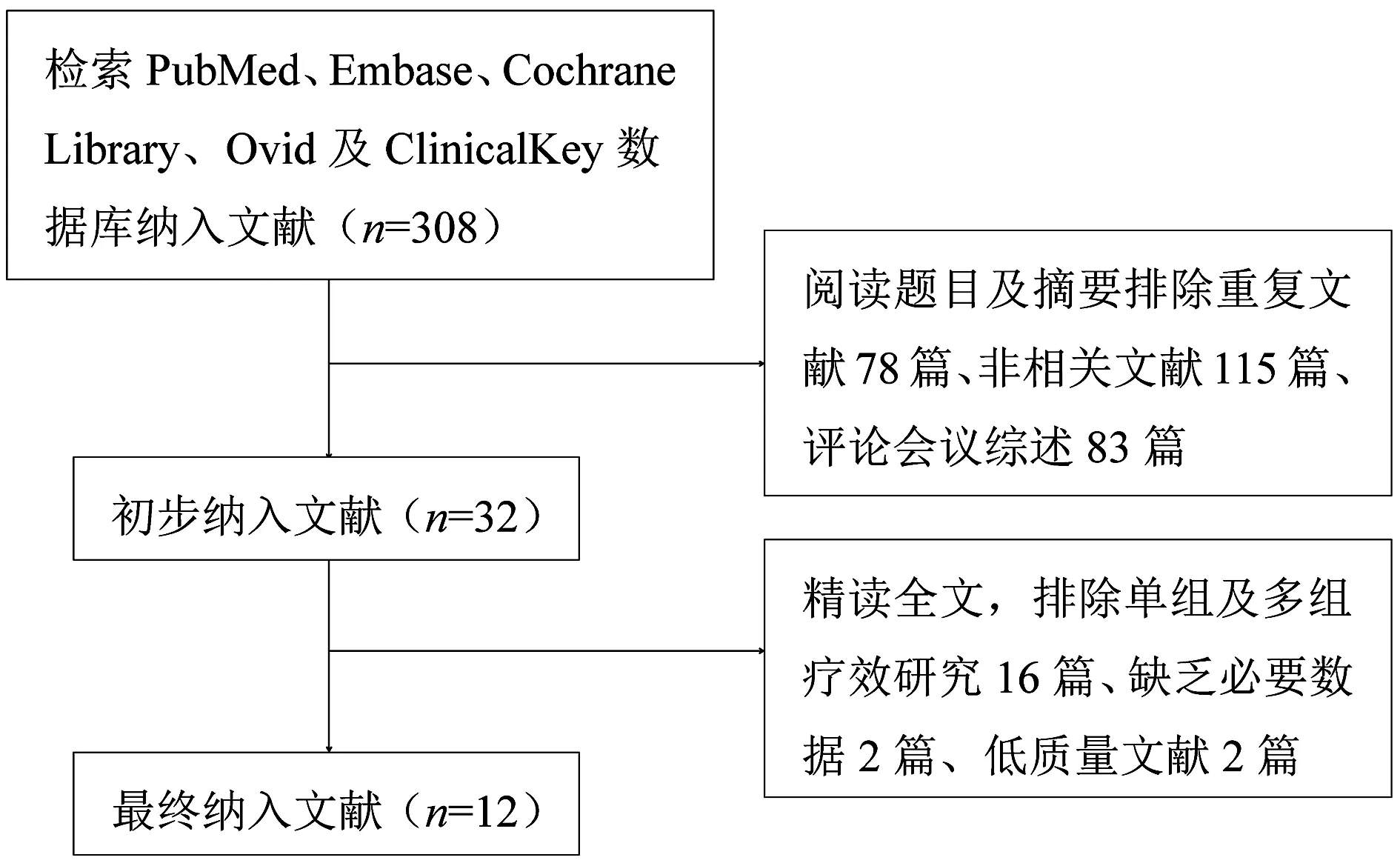
图1 文献筛选流程图

表1 纳入文献一般特征

表2 ERAS措施在纳入文献中的应用
2.2 质量评价 纳入的4篇[9,15,17-18]非随机对照研究均≥6分;纳入的8篇[7-8,10-14,16]随机对照研究中4篇讲明了具体随机方法;仅1项研究[11]明确提出非盲设计,其余对于受试者、实施者及评价者是否采用盲法均未充分描述,不能判断测量偏倚及实施偏倚;研究均未发生随访偏倚及报告偏倚。偏倚风险评价总结图见图2。

图2 偏倚风险评价总结图
2.3 临床结果分析
2.3.1 手术时间 纳入的研究中共10篇[7-14,16-17]涉及手术时间,结果显示无异质性(P=0.98,I2=0),采用固定效应模型,合并统计量WMD=1.45,95%CI=-2.67~5.57,P=0.49,差异无统计学意义。随机对照研究及病例对照研究亚组分析显示,两组差异无统计学意义(WMD=1.60,95%CI=-2.57~5.77,P=0.45;WMD=-4.59,95%CI=-31.28~22.10,P=0.74)。见图3。
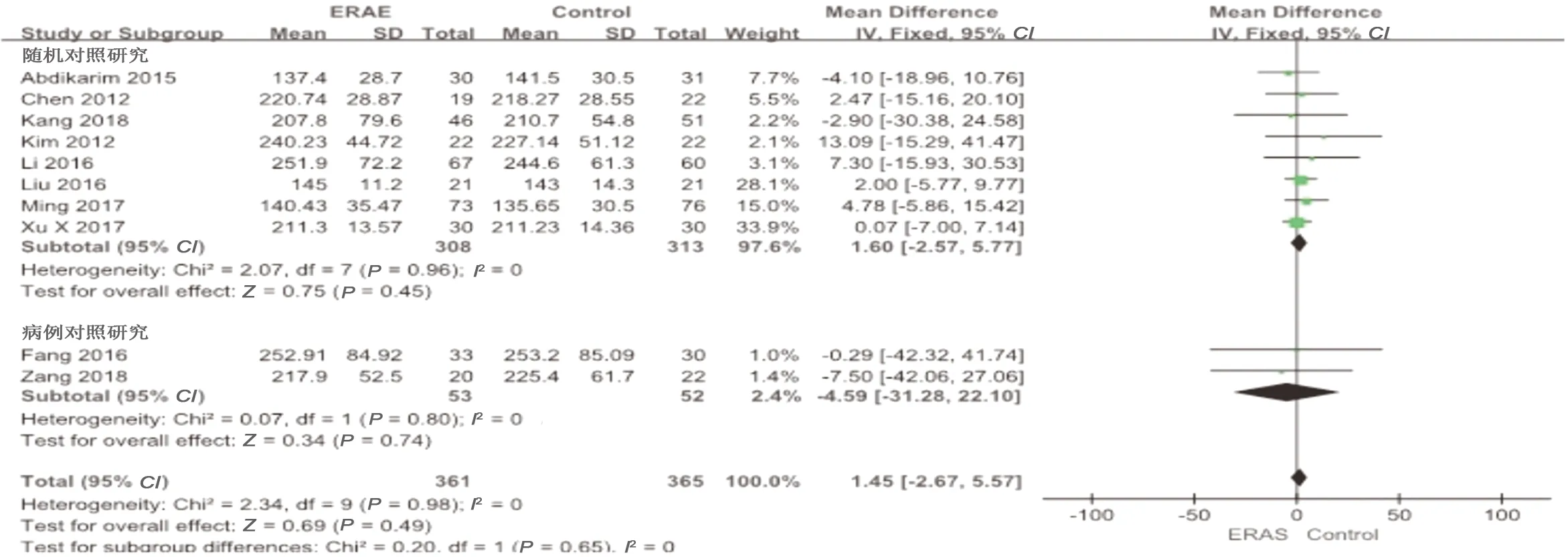
图3 两组手术时间的Meta分析结果
2.3.2 术中失血量 纳入的研究中共10篇[7,8,10-14,16-18]报道了术中失血量,结果显示,各研究间具有轻度异质性(P=0.20,I2=26%),采用固定效应模型,合并统计量WMD=-1.05,95%CI=-6.86~4.76,P=0.72,差异无统计学意义,随机对照研究及病例对照研究亚组分析显示,两组差异无统计学意义(WMD=-3.83,95%CI=-10.41~2.74,P=0.25;WMD=8.81,95%CI=-3.56~21.19,P=0.16)。见图4。

图4 两组术中失血量的Meta分析结果
2.3.3 术后离床活动时间 仅4篇[7,12,17-18]报道了术后离床活动时间,结果表明各研究间具有显著异质性(P=0.0002,I2=85%),采用随机效应模型,合并统计量WMD=-1.41,95%CI=-2.17~-0.65,P=0.0003,差异有统计学意义;随机对照研究及病例对照研究亚组分析显示,两组差异有统计学意义(WMD=-0.96,95%CI=-1.84~-0.07,P=0.03;WMD=-2.07,95%CI=-2.58~-1.56,P<0.00001)。见图5。

图5 两组术后离床活动时间的Meta分析结果
2.3.4 胃肠功能恢复时间 8项研究[9,11-13,15-18]报道了肠功能恢复时间,结果显示各研究间具有显著异质性(P<0.00001,I2=90%),因此采用随机效应模型,合并统计量WMD=-0.87,95%CI=-1.31~-0.43,P=0.0001,差异有统计学意义;随机对照研究及病例对照研究亚组分析显示,两组差异有统计学意义(WMD=-0.37,95%CI=-0.54~-0.21,P<0.00001;WMD=-1.46,95%CI=-1.68~-1.23,P<0.00001)。见图6。
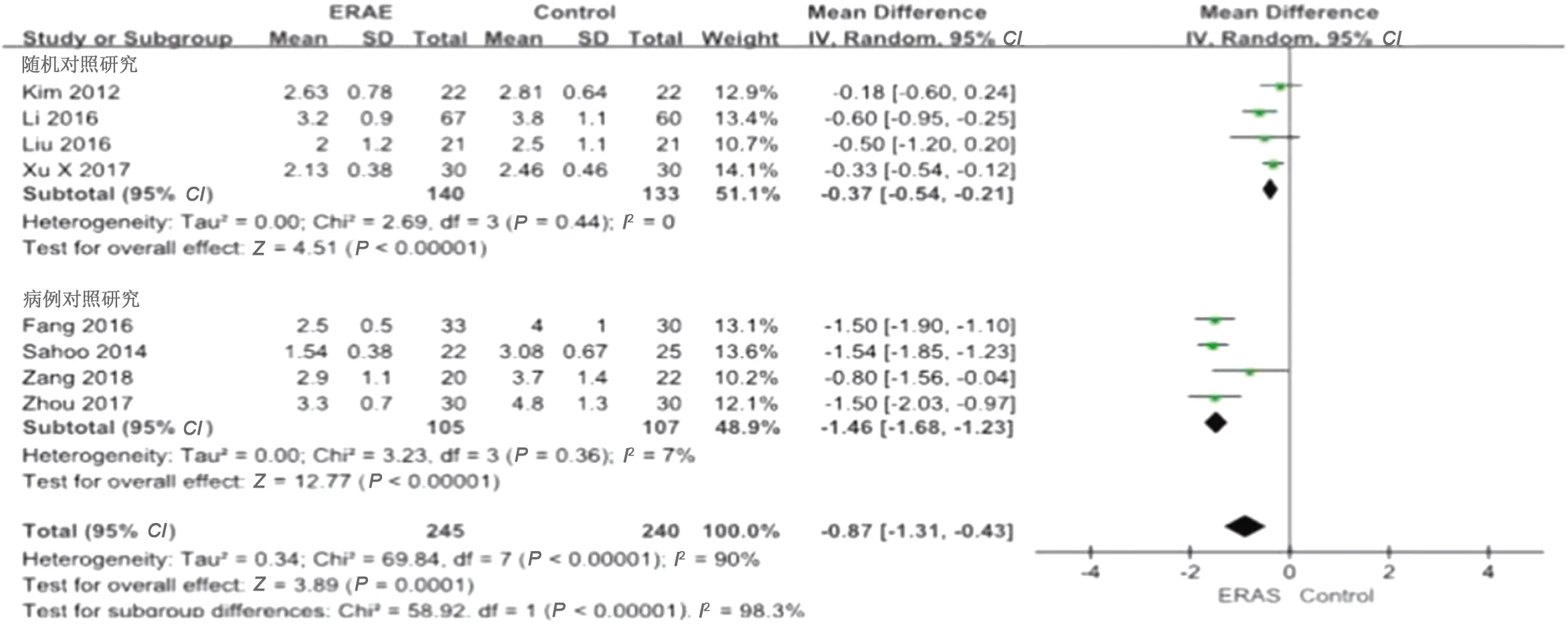
图6 两组术后肠功能恢复时间的Meta分析结果
2.3.5 术后恢复流质饮食时间 5篇文献[7,9,12,14,17]报道了术后恢复流质饮食时间,结果显示各研究间具有显著异质性(P<0.00001,I2=92%),因此采用随机效应模型,合并统计量WMD=-1.84,95%CI=-2.46~-1.21,P<0.00001,差异有统计学意义;随机对照研究及病例对照研究亚组分析显示,两组差异有统计学意义(WMD=-1.45,95%CI=-2.21~-0.69,P=0.0002;WMD=-2.50,95%CI=-2.91~-2.09,P<0.00001),即与传统组相比,ERAS组术后恢复流质饮食时间明显缩短。见图7。

图7 两组术后恢复流质饮食时间的Meta分析结果
2.3.6 术后住院时间 10篇文献[7,9,11-18]报道了术后住院时间,结果显示各研究间具有显著异质性(P<0.00001,I2=87%),因此采用随机效应模型,合并统计量WMD=-2.56,95%CI=-3.41~-1.72,P<0.00001,差异有统计学意义;随机对照研究及病例对照研究亚组分析显示,两组差异有统计学意义(WMD=-1.77,95%CI=-2.59~-0.96,P<0.0001;WMD=-3.77,95%CI=-5.34~-2.20,P<0.00001),即与传统组相比,ERAS组术后住院时间明显缩短。见图8。
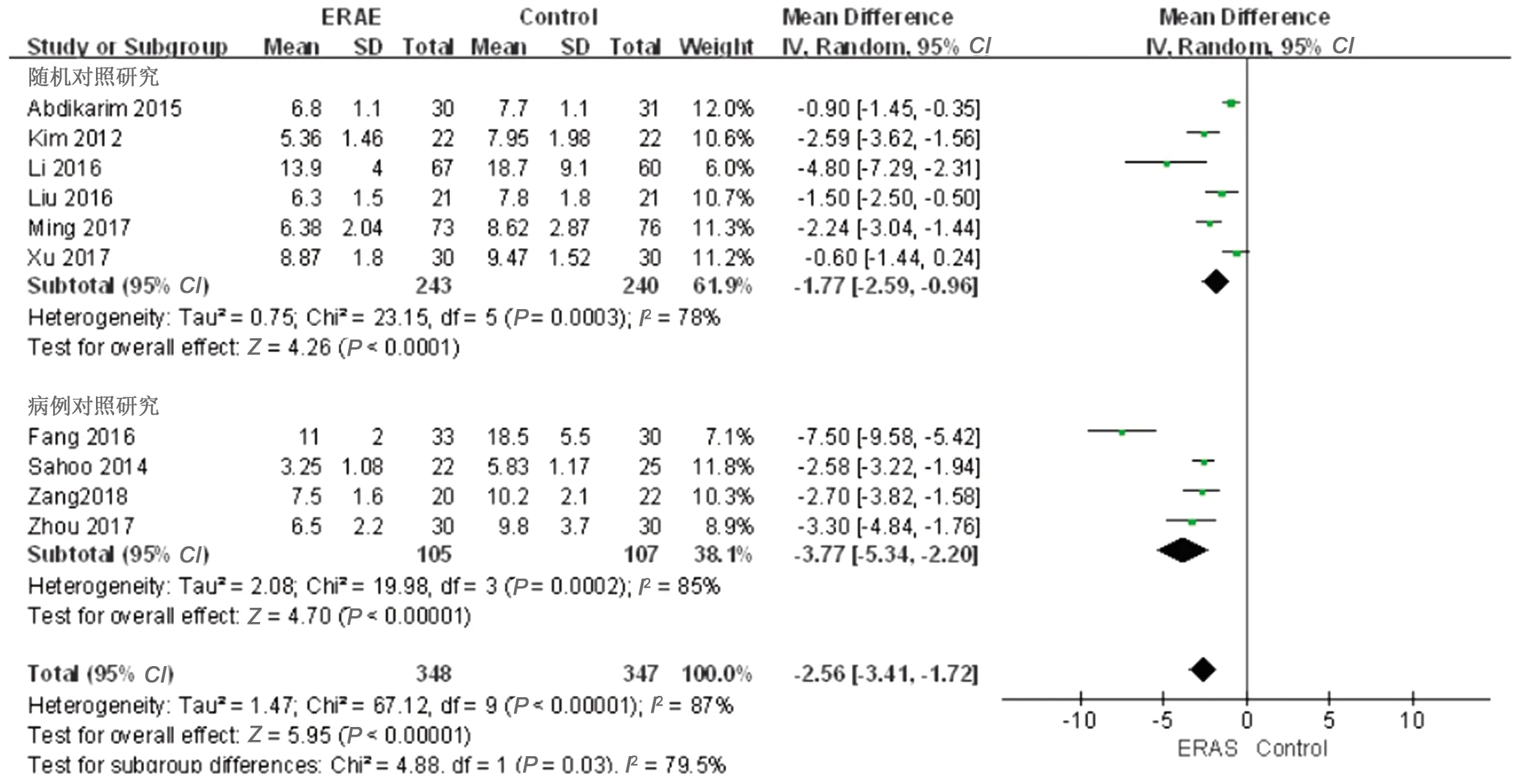
图8 两组术后住院时间的Meta分析结果
2.3.7 术后并发症及死亡率 11篇文献[7-14,16-18]报道了术后并发症,结果显示P=0.19,I2=26%,各研究间存在轻度异质性,采用固定效应模型,合并统计量OR=0.79,95%CI:0.51~1.21,P=0.27,差异无统计学意义;随机对照研究及病例对照研究亚组分析显示,两组差异无统计学意义(OR=0.87,95%CI:0.55~1.38,P=0.56;OR=0.41,95%CI:0.12~1.38,P=0.15)。见图9。此外,本文纳入的12项研究随访时间均≥30 d,患者术后均未发生死亡。
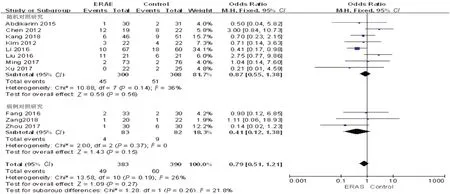
图9 ERAS组与传统组术后并发症Meta分析结果
2.3.8 住院费用 3篇文献[8,11,13]报道了住院费用,结果显示各研究间具有显著异质性(P=0.002,I2=83%),采用随机效应模型,合并统计量SMD=-1.12,95%CI=-2.07~-0.18,P=0.02,差异有统计学意义。见图10。

图10 两组住院费用的Meta分析结果
2.3.9 CRP表达水平 术后第1、3、4天ERAS组CRP水平低于对照组(WMD=-13.43,95%CI=-24.77~-2.09,P=0.02;WMD=-21.94,95%CI=-37.53~-6.35,P=0.006;WMD=-14.15,95%CI=-23.02~-5.28,P=0.002);术后第5天,两组CRP反应水平差异无统计学意义(WMD=-6.94,95%CI=-17.19~3.31,P=0.18)。见图11。
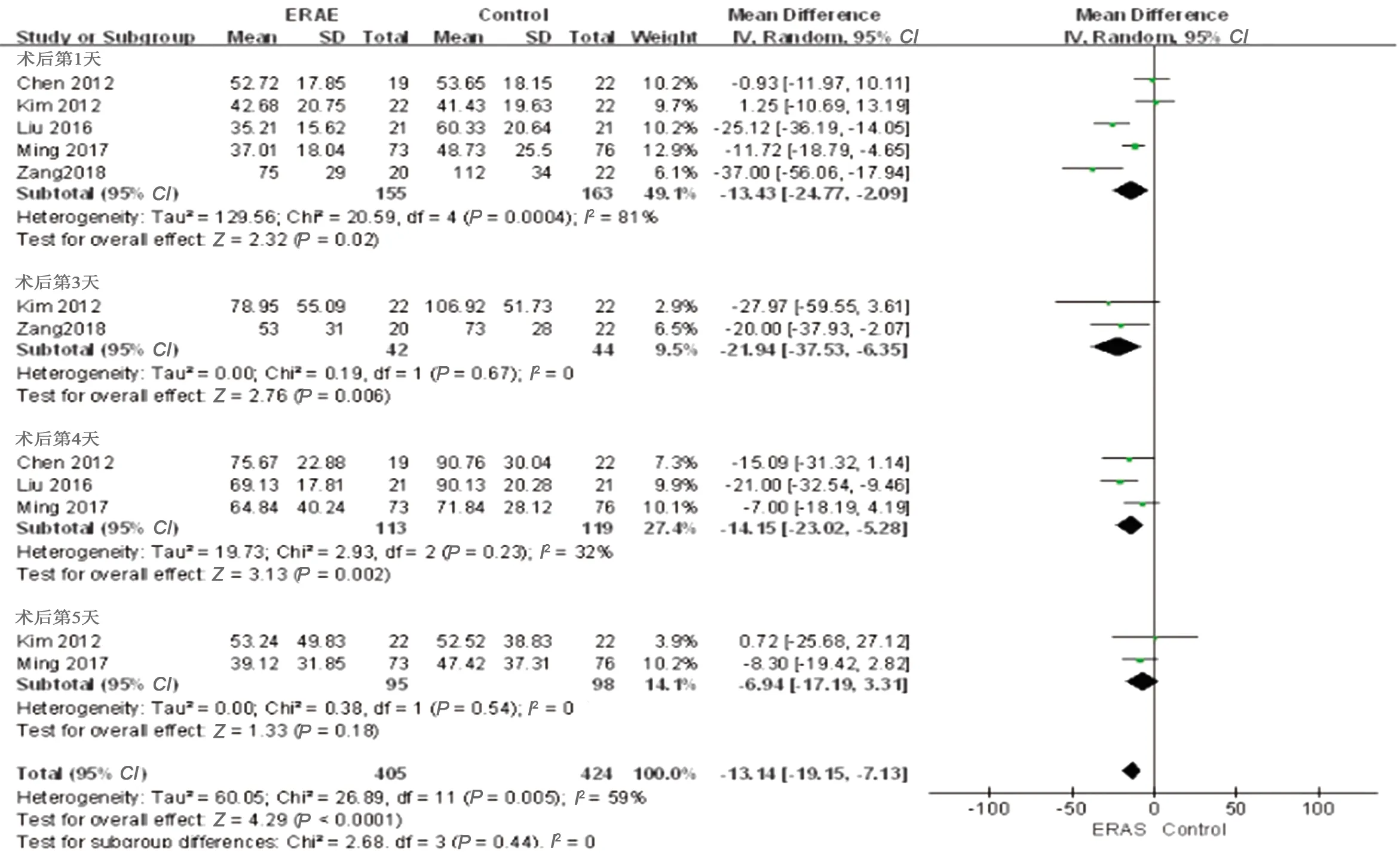
图11 两组术后CRP表达水平的Meta分析结果
2.4 偏倚风险评估 以术后并发症为指标,制作漏斗图评价本研究是否存在偏倚。结果显示,散点基本对称分布在漏斗图,仅有两项分布在漏斗图外,表明本次Meta分析存在发表偏倚的可能性较低。见图12。

图12 并发症漏斗图(横坐标:OR;纵坐标:SE(Log[OR]))
3 讨 论
ERAS是指由多科室相互协作,采取一系列围术期护理措施,包括术前准备、术中麻醉方式的转变、微创操作、控制液体量及术后多模式镇痛、早期经口进食、离床活动等,将其结合在一起,从而形成的新理念[19]。其核心在于减少患者围手术期应激反应,促进早期恢复。有学者对ERAS在胃癌治疗中的临床实用性及安全性进行了研究,但这些研究多受小样本及单因素限制,对其临床疗效尚不能全面评价;如Chen等[20]分析了4篇关于腹腔镜手术联合ERAS与传统处理、开腹手术联合ERAS与传统处理对比的文献,结果显示在腹腔镜及开腹手术中,ERAS组术后住院时间、术后排气时间缩短,住院费用及CRP降低;而术后并发症发生率差异无统计学意义。本研究中我们重点分析了两组患者术中及术后各项指标,截至目前,本文纳入关于ERAS联合腹腔镜手术的文献及样本量最多,此外进行了亚组分析,因此更利于评估ERAS联合腹腔镜手术治疗胃癌的安全性及有效性。
本研究对纳入的12篇相关文献进行了评价,结果显示,与传统护理组对比,ERAS组术后离床活动时间缩短,这可能与术后镇痛有关,ERAS组采用多模式镇痛方案,镇痛效果更佳,利于患者早期下床活动;此外,ERAS组术后首次排气时间、术后首次恢复流质饮食时间、术后住院时间短于对照组。研究发现,禁食可加强患者术后胰岛素抵抗,使其血糖升高[21],不利于患者术后切口及吻合口的恢复。相较传统手术前禁饮食,ERAS理念建议术前禁饮食,能在一定程度上加快术后胃肠功能恢复速度,而术后早期经口饮食容易被吸收,可促进胃肠蠕动,保护肠黏膜屏障功能。术中输注过多液体会导致胃肠道水肿,使胃肠功能恢复延迟[22],这也恰恰符合早期进饮食、限制术中过多液体量摄入等ERAS理念。此外,ERAS可减轻患者术后疼痛强度、机体的应激反应,利于促进胃肠道的蠕动,恢复肠功能,而且不会增加并发症,相对而言,比较安全[23];ERAS组术后早期CRP水平低于对照组,CRP是一种急性相蛋白,参与全身炎症反应,可反映患者创伤及应激反应,因手术创伤可导致促炎因子大量释放并激发炎症反应,通过ERAS组与对照组对比,表明ERAS可有效减少患者术后所致的全身炎症反应程度,从而促进康复速度,缩短住院时间。与对照组相比,ERAS组术后住院费用减少。随着患者离床活动时间缩短,肠蠕动恢复时间提前,住院时间缩短,患者可更迅速地回归到正常生活,更迅捷的康复不仅可减少床位的需要量,而且可减少治疗费用。但在手术时间、术中失血量及术后并发症方面,本研究通过对文献的评价讨论目前尚无证据表明ERAS联合腹腔镜胃癌根治术能缩短手术时间,也无理由认为ERAS联合腹腔镜胃癌根治术会减少失血量。
目前Meta分析仍存在一定不足,包括:(1)纳入相关研究样本量较少;(2)大部分研究均在亚洲进行,其结论可能无法代表西方国家;(3)部分结局指标可能存在偏倚,虽然本研究关于术后并发症的漏斗图表明未见明显发表偏倚;但漏斗图相对直观,无法得出客观的结论。
综上所述,ERAS联合腹腔镜胃切除术明显缩短了术后下床活动时间,促进胃肠功能恢复,缩短术后恢复流质饮食时间及术后住院时间,住院费用降低,术后应激反应减少,不会增加手术时间、术中失血量及术后并发症,为胃癌治疗开辟了新的方式。但仍需要多中心、大样本、高质量的随机对照试验评价ERAS方案在胃癌治疗中的临床价值,为ERAS的应用提供临床证据支持。

