胃癌患者术后反流性食管炎发生状况及影响因素
高德海
(信阳市第四人民医院 普外科,河南 信阳 464100)
胃癌因解剖位置特殊,对放、化疗敏感度不高,故临床仍以手术作为疾病的主要治疗手段,手术的实施可有效清除肿瘤组织,改善患者预后,延长患者的生存时间[1]。但仍有部分患者术后可伴发各种并发症,反流性食管炎是其中之一,不仅会影响手术整体效果,还会影响患者术后的生存质量,部分严重者甚至可导致营养不良,继而影响免疫功能,增加肿瘤复发和转移风险,从而影响患者生存期,增加病死风险[2-3]。可见早期预防的关键意义。目前,临床已有研究对比不同术式治疗胃癌患者的效果,结果显示,全胃根治术在预防术后反流性食管炎形成及术后3、5 年的生存率均优于近端胃癌根治术[4]。但现有关胃癌患者术后反流性食管炎发生影响因素的相关研究仍较少,不利于预防计划的拟定。基于此,本研究主要观察医院胃癌患者术后反流性食管炎发生状况,并分析术后反流性食管炎发生可能的影响因素,以指导临床早期预防。现报告如下。
1 资料与方法
1.1 一般资料
前瞻选取2018 年1 月至2019 年10 月信阳市第四人民医院接受手术治疗的84 例胃癌患者。84例患者中男45 例,女39 例;年龄40~58 岁,平均(49.14±2.05)岁;恶性肿瘤国际临床病理期分期(TNM)[5]:IA 期4 例,IB 期7 例,ⅡA 期11 例,ⅡB 期12 例,ⅢA 期15 例,ⅢB 期17 例,ⅢC 期18 例;手术类型:全胃根治术40 例、近端胃癌根治术44 例。伦理委员会对本次研究设计内容知情,并批准研究实施;患者及家属对研究内容知情同意。
1.2 入选标准
纳入标准:①符合《胃癌规范化诊疗指南(试行)》[6]中胃癌相关诊断标准,且均符合手术指征,接受手术治疗,并经手术病理结果确诊;②预计生存时间>3 个月;③TNM 分期为Ⅰ~Ⅲ期。排除标准:①伴有远处转移的患者;②其他恶性肿瘤;③既往有上消化道手术史;④合并其他脏器相关疾病的患者,如肝、肾衰竭等,难以耐受手术;⑤精神障碍导致无法完成资料调查的患者;⑥患者全身情况较差,难以耐受;⑦腹腔内合并腹水、大网膜与小肠系膜表面均有散在转移癌结节。
1.3 方法
1.3.1 术后反流性食管炎判定及分组方法 判定标准:参照文献[7],全部患者术后6 个月内出现呃逆、恶心、呕吐胆汁,胸骨后烧灼样疼痛;有口苦味或慢性喉炎表现;经胃镜检查可见消化液反流入试管,食管中下段及吻合口黏膜充血、水肿、糜烂表现即判定为术后反流性食管炎。根据术后反流性食管炎的判定标准,将发生术后反流性食管炎的患者纳入发生组,剩余患者纳入未发生组。
1.3.2 基线资料调查方法 自制基线资料调查问卷,详细记录两组患者一般情况,内容包括:①性别;②年龄;③体重指数(body mass index,BMI):划分为体重正常、肥胖或超重;④手术术式:划分为全胃根治术、近端胃癌根治术;⑤有无胆囊切除史;⑥消化道重建方式:划分为毕I 式三角吻合[Billroth-I(B-I)]、胆总管空肠吻合术[Rouxen-Y(R-Y)];⑦有无高血压:不同时间内连续三次收缩压>140 mmHg(1 mmHg=0.133 kPa),舒张压>90 mmHg,即判定为高血压;⑧有无糖尿病:空腹血糖升高>7.0 mmol/L,餐后2 h 血糖>11.1 mmol/L,即判定为糖尿病;⑨有无饮酒:每次摄入酒精量>10 g;⑩有无吸烟:一生连续或累计吸烟6 个月或以上;⑪肿瘤分期:划分为Ⅰ~Ⅱ期、Ⅲ期。
1.3.3 实验室指标检测方法 白蛋白:采集患者入院当天清晨空腹静脉血3 mL,进行离心处理,以1 500 r/min 的离心速度共离心10 min,离心完毕后取上清液待检。使用中国太阳生物提供的试剂盒测定白蛋白水平。
1.4 统计学方法
采用SPSS 24.0 软件进行数据处理,全部计量资料均经Shapiro-Wilk 正态性检验,符合正态分布的资料以均数±标准差()表示,组间用独立样本t检验;计数资料用百分率(%)表示,采用χ2检验,等级资料采用秩和检验;胃癌患者术后发生反流性食管炎的影响因素采用Logistic 回归分析检验。P<0.05 为差异有统计学意义。
2 结果
2.1 胃癌患者术后反流性食管炎发生状况
本研究纳入的84 例接受手术治疗的胃癌患者中,有18 例患者术后发生反流性食管炎,发生率为21.43%(18/84)。
2.2 发生组与未发生组患者基线资料、实验室指标比较
发生组的BMI(肥胖或超重)、手术术式(近端胃癌根治术)、胆囊切除史、消化道重建方式(B-I)占比均高于未发生组,差异有统计学意义(P<0.05),组间其他资料比较差异无统计学意义(P>0.05)。见表1。

表1 发生组与未发生组的基线资料、实验室指标比较
2.3 胃癌患者术后反流性食管炎发生影响因素的单项Logistic 回归分析
将2.2 组间基线资料比较结果显示差异有统计学意义的变量作为自变量纳入并进行变量说明,均为二分类变量,将术后反流性食管炎发生状况作为因变量(1=发生,0=未发生),行单项Logistic 回归分析结果显示,高BMI、手术术式(近端胃癌根治术)、胆囊切除史、消化道重建方式(B-I)均可能是胃癌患者术后发生反流性食管炎的影响因素,P<0.05)。见表2。
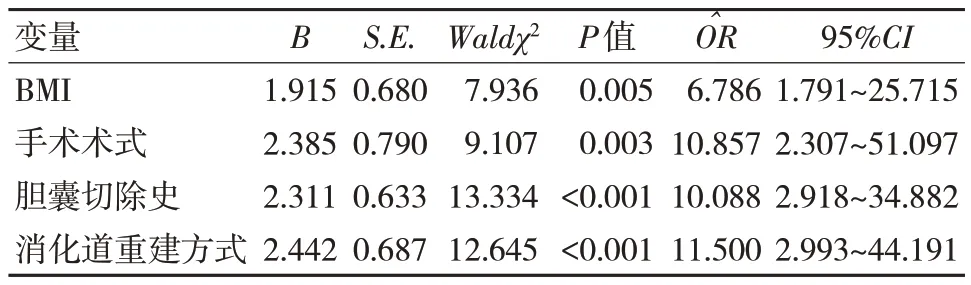
表2 胃癌患者术后反流性食管炎发生影响因素的单项Logistic 回归分析结果
2.4 胃癌患者术后反流性食管炎发生影响因素的多元回归分析
将胃癌患者全部基线资料纳入,并同时作为协变量,将术后反流性食管炎发生状况作为因变量(1=发生,0=未发生),建立多元Logistic 回归模型,在校正各个资料之间的相互影响后,多因素分析结果显示,高BMI、近端胃癌根治术、胆囊切除史、B-I 术式均是胃癌患者术后发生反流性食管炎的影响因素1,P<0.05)。见表3。

表3 胃癌患者术后反流性食管炎发生影响因素的多元回归分析结果
3 讨论
作为胃癌患者获得根治的唯一可能方法,手术可有效清除肿瘤细胞及组织,以达到延长患者生存期限,改善生存质量的目的,但部分患者术后可能发生反流性食管炎,是影响患者生存质量的主要并发症之一,可大幅增加患者不良结局风险[8-9]。
本研究纳入的84 例接受手术治疗的胃癌患者中,有18 例患者术后发生反流性食管炎,发生率为21.43%,提示胃癌患者术后发生反流性食管炎的风险高,早期预防尤为关键,而早期预防则需明确疾病发生的相关影响因素。本研究将全部可能的因素纳入,通过单因素与多因素分析发现,高BMI、近端胃癌根治术、胆囊切除史、B-I 均是胃癌患者术后发生反流性食管炎的影响因素。逐个分析上述影响因素导致反流性食管炎发生可能的原因。BMI:相较于其他BMI 正常或偏瘦的患者,肥胖患者术后食管下括约肌功能更易松弛,可为反流提供基础条件[10]。同时肥胖患者术后腹内压力较高,将影响胃排空,从而可增加反流,加之肥胖患者体内脂肪细胞因子含量较多,可进一步提高患者的胃酸水平,继而增加反流性食管炎发生风险[11]。对此,建议肥胖的胃癌患者应合理饮食、适当锻炼,尽可能将体重控制在正常范围内,以避免因肥胖、超重带来的反流性食管炎发生。近端胃癌根治术:近端胃癌根治术是胃癌治疗常用术式,相比于全胃根治术,近端胃癌根治术的操作更加简单,且手术范围更小,风险更低,并且术中可保留一定的残胃消化及内分泌功能,能够基本保持正常消化道结构[12-13]。但近端胃癌根治术在手术操作过程中需要将贲门部和腹段食管切除,这将导致正常贲门部抗反流生理屏障功能丧失,故会增加患者术后反流性食管炎风险[14]。同时,因残胃胃腔较小,胃蠕动和收缩功能等均存在异常,加上手术所致胃顺应性降低,而残胃的胃壁细胞仍可继续合成分泌胃酸,胃酸反流可进入食管内,破坏食管黏膜,使食管持续性处于痉挛状态,增加幽门部压力和胃排空阻力,继而引起幽门口水肿,延缓胃排空,进一步增加反流性食管炎的发生风险[15-16]。对此,建议胃癌患者接受手术前,应综合考虑患者病情及身体情况,尽可能选择合理的术式,避免近端胃癌根治术广泛施行,以减少反流性食管炎的发生。胆囊切除史:既往有胆囊切除史的胃癌患者因胆汁无法储存,胆汁将持续排至肠道内,而代胃肠管并无贲门、幽门的抗反流瓣作用,因此反流性食管炎发生风险较高[17]。B-I 式消化道重建:B-I 式消化道重建不仅难以治疗肿瘤直径>5 cm 以上的患者,且残胃剩余较少,残胃张力较大导致吻合困难,改变消化道正常解剖生理结构,残胃难以受到幽门及神经的支配,导致胃排空延迟,胆汁反流,从而易引起反流性食管炎[18]。对此,建议胃癌患者术前应结合患者实际情况与病情为其选择最佳的消化道重建方式,且对于既往有胆囊切除史的患者,术后应指导患者合理饮食,尽可能减少胆汁反流,必要时可采取预防性胆囊切除。
综上所述,部分胃癌患者术后仍有反流性食管炎发生高风险,可能与患者高BMI、近端胃癌根治术、胆囊切除史、B-I 消化道重建有关,临床可针对上述因素制定合理干预方案,如合理控制饮食、预防性胆囊切除等,可能对减少胃癌患者术后反流性食管炎发生有积极意义。

