熊果酸联合HDAC2抑制剂抑制人肝癌细胞系HepG2的增殖
唐加峰,何雪莲,夏 菁,熊 伟,李小山*
(1.重庆三峡医药高等专科学校,重庆 404120;2.重庆大学附属三峡中心医院,重庆 404100)
肝细胞癌(hepatocellular carcinoma,HCC)是全球最普遍和最致命的癌,其病死率在所有肿瘤中位居第二,主要的发病原因与慢性病毒性肝炎和酒精/非酒精性脂肪性肝炎等风险因素有关[1]。人们对疾病的防范意识缺乏和不良的生活方式,导致了肝癌的发病率正以惊人的速度上升[2]。尽管肝癌的医学研究取得了较大的进步,但是HCC的发病率和病死率仍然居高不下[3]。在2008年被批准用于治疗晚期肝癌的靶向小分子药物索拉非尼(sorafenib)一直是晚期HCC唯一的一线治疗药物。然而,在随后的数十年中,越来越多的临床研究表明,相当一部分肝癌患者对索拉非尼并不敏感。因而,真正受益于索拉非尼治疗的患者人数非常有限,因此索拉非尼的总体疗效远不能令人满意[4]。
熊果酸(ursolic acid,UA)是一种植物来源的五环三萜类化合物,存在于各种草药和水果中,UA可以用作治疗和预防多种疾病的替代药物。越来越多的证据表明,UA在各种癌细胞中表现出了良好的抗癌作用[5]。据报道,UA可以作用于人肝癌细胞HepG2,诱导细胞凋亡和周期阻滞[6];还可以通过内质网应激通路诱导肝癌SMMC-7721细胞凋亡[7]。而UA对肝癌细胞的组蛋白去乙酰化酶2(histone deacetylase 2,HDAC2)的作用却未见报道。因此,本研究主要探讨UA在肝癌细胞中对HDAC2的影响,以及联合使用HDAC2选择性抑制剂(santacruzamate A,SA)对HepG2肝癌细胞增殖的影响和可能机制。
1 材料及方法
1.1 材料
1.1.1 细胞系:正常肝细胞系L02、肝癌细胞系SMMC-7721、HepG2、PLC5(上海中乔新舟生物科技有限公司)。
1.1.2 药物与试剂 Ursonic acid (UA,纯度:98%)和Santacruzamate A(SA,纯度:99.72%)(MCE公司);二甲基亚砜(DMSO)、海克隆高糖培养基DMEM和南美胎牛血清(美国赛默飞世尔公司);BCA试剂盒、蛋白酶抑制剂、SDS-PAGE蛋白上样缓冲液(×5)、青-链霉素和RIPA裂解液(碧云天生物技术有限公司);PAGE凝胶快速制备试剂盒、双色预染蛋白标准和脱脂奶粉(上海雅酶生物医药科技有限公司);抗-HDAC2、-Ac-α-tubulin、-CDK2、-cyclin E1、-Bax、-Bcl-2、-cleaved-PARP和-GAPDH单克隆抗体(ABclonal公司);二抗(Cell Signaling Technology公司)。
1.2 方法
1.2.1 细胞的分组及处理:本研究主要以人肝癌细胞系HepG2作为研究对象,分为对照组(不含药物)、UA组(20 μmol/L)、SA组(10 nmol/L)和UA联合SA用药组(20 μmol/L UA+10 nmol/L SA)。在后续的实验中,每组细胞均用相应的药物处理48 h。
1.2.2 免疫印迹实验检测HDAC2的表达:分别取对数期增殖的正常肝细胞、PLC5、SMMC-7721及HepG2等肝癌细胞至1.5 mL的离心管中,加入细胞裂解液提取细胞总蛋白。然后用BCA蛋白浓度检测试剂盒测定每组的蛋白浓度。根据计算结果将总量为30 μg的4组蛋白样品进行SDS-PAGE电泳分离,然后,将蛋白转印至硝酸纤维素薄膜上,用脱脂奶粉在室温条件下封闭1 h,加入一抗(抗-HDAC2和-GAPDH抗体,均以1∶1 000的比例进行稀释),置于摇床4 ℃冰箱过夜。次日,取出硝酸纤维素薄膜,用TBST清洗3次,每次持续10 min,然后将硝酸纤维素薄膜放入与一抗相对应的二抗(1∶10 000稀释)中,置于摇床室温孵育1 h。取出硝酸纤维素薄膜,用TBST清洗3次,每次持续10 min。最后使用ECL蛋白免疫印迹成像系统检测蛋白的表达。
1.2.3 CCK8法检测HepG2细胞存活率:将对数期增殖的HepG2肝癌细胞,用胰蛋白酶消化并重悬后,取100 μL浓度为5×107/L的细胞悬液均匀的接种到96孔板中,并将每个浓度组设置3个复孔。待细胞贴壁后,将不同浓度的UA(0、2.5、5、10、20、40和80 μmol/L)加入到96孔板中,继续培养24和48 h后,加入CCK-8工作液10 μL/孔并继续放入细胞培养箱孵育1~2 h。最后,取出96孔板,用分光光度仪测定各实验孔在450 nm波长处的吸光度值(A),并根据吸光度值计算出细胞的存活率。细胞存活率=[(A实验组-A空白孔)/(A对照组-A空白孔)]×100%。
1.2.4 细胞克隆形成实验:取1mL 1×106/L的细胞悬液均匀的接种到6孔板中,每组设置3个复孔。处理结束后移除含药培养基,并加入新鲜的DMEM培养基继续培养,平均每3~5 d更换1次培养基,倒置显微镜下观察细胞形态学变化并拍照记录。约在14 d后出现可见细胞集落时终止培养。用磷酸缓冲液(phosphate buffer saline,PBS)溶液清洗去除培养基的6孔板,再加入4%多聚甲醛固定液固定5 min后,用PBS清洗并加入结晶紫染色液染5 min。待染色完成后用自来水清洗残留的染色液,拍照并计算细胞克隆形成数。克隆形成率(%)=克隆数/接种细胞数×100%。
1.2.5 流式细胞术检测细胞周期:取3 mL 1×106/mL的细胞悬液,均匀地接种到6孔板中,每组设置3个复孔。处理结束后,去除培养基并用PBS清洗1遍,用胰蛋白酶将细胞消化为单个细胞,然后离心完成之后,用500 μL提前预冷的75%的乙醇将细胞重悬固定过夜,加入碘化丙啶(propidium iodide,PI)试剂进行染色,PBS清洗之后用流式细胞仪检测细胞周期分布情况。
1.2.6 免疫印迹实验检测细胞增殖、凋亡及周期相关蛋白的表达:取对数期增殖的HepG2肝癌细胞,加入药物处理细胞。处理接受收集细胞,用1.2.2的方法提取蛋白进行免疫印迹实验。一抗(抗-AC-α-tubulin、-CDK2、-cyclin E1、-Bax、-Bcl-2、-cleaved-PARP和-GAPDH)抗体,以1∶1 000的比例进行稀释。
1.3 统计学分析

2 结果
2.1 HDAC2在肝癌细胞系中高表达
肝癌细胞系SMMC-7721、HepG2和PLC5细胞中HDAC2蛋白的表达水平显著高于L02正常肝细胞(P<0.01)(图1)。
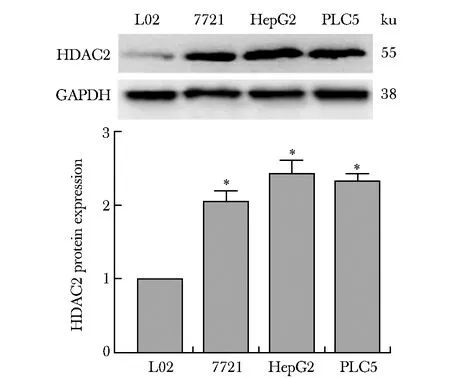
*P<0.01 compared with L02图1 Western blot检测肝癌和正常肝细胞系中HDAC2的表达Fig 1 Expression of HDAC2 in L02 and liver cancer cell lines was detected with Western n=3)
2.2 UA影响HepG2细胞的存活率
UA对HepG2细胞的增殖有较好的抑制作用,表现为剂量和浓度依耐性。UA处理HepG2 48 h的半数抑制浓度(IC50)约为20 μmol/L。因此,本研究选择20 μmol/L作为后续试验的处理浓度(图2)。
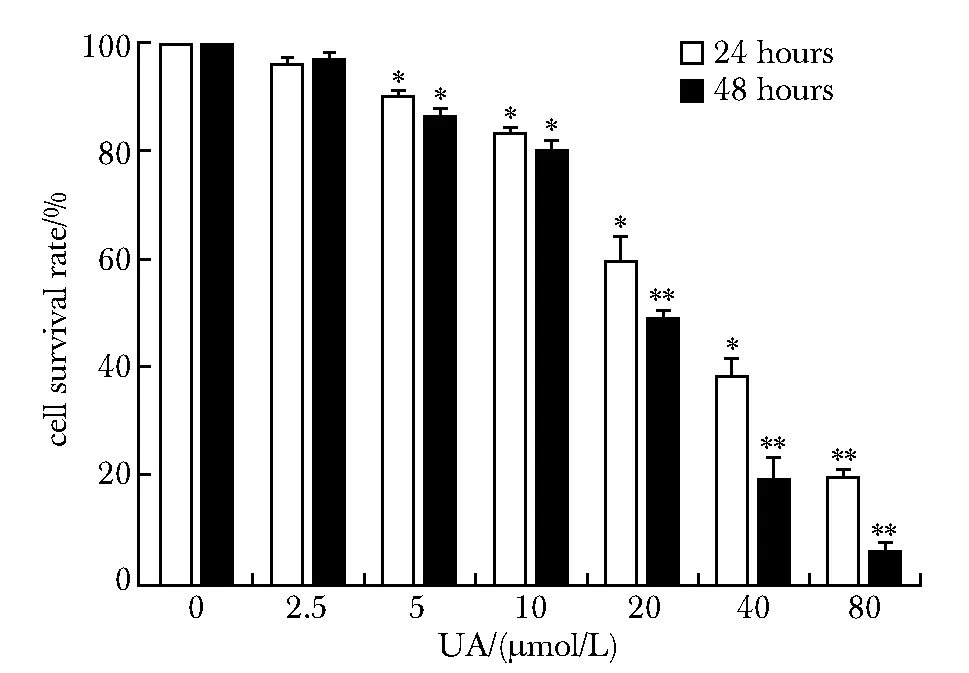
*P<0.05,**P<0.01 compared with control图2 UA对HepG2细胞增殖的影响Fig 2 Effect of UA on the proliferation rate of HepG2
2.3 UA、SA单药及联合用药对HepG2细胞形态和克隆形成能力的影响
在光镜下可以看到,未经处理的HepG2细胞呈聚集条索状,UA组细胞之间比较分散呈颗粒状,而UA和SA联合处理组可见细胞呈块状,且死亡并漂浮的细胞较多(图3)。单独使用SA组的细胞克隆形成能力没有受到明显抑制。而在单独使用UA或联合SA处理HepG2细胞后,细胞的克隆形成数明显低于对照组(P<0.01)(图4)。

图3 UA和SA对HepG2细胞形态的影响Fig 3 Effect of UA and SA on the morphology of HepG2 cells
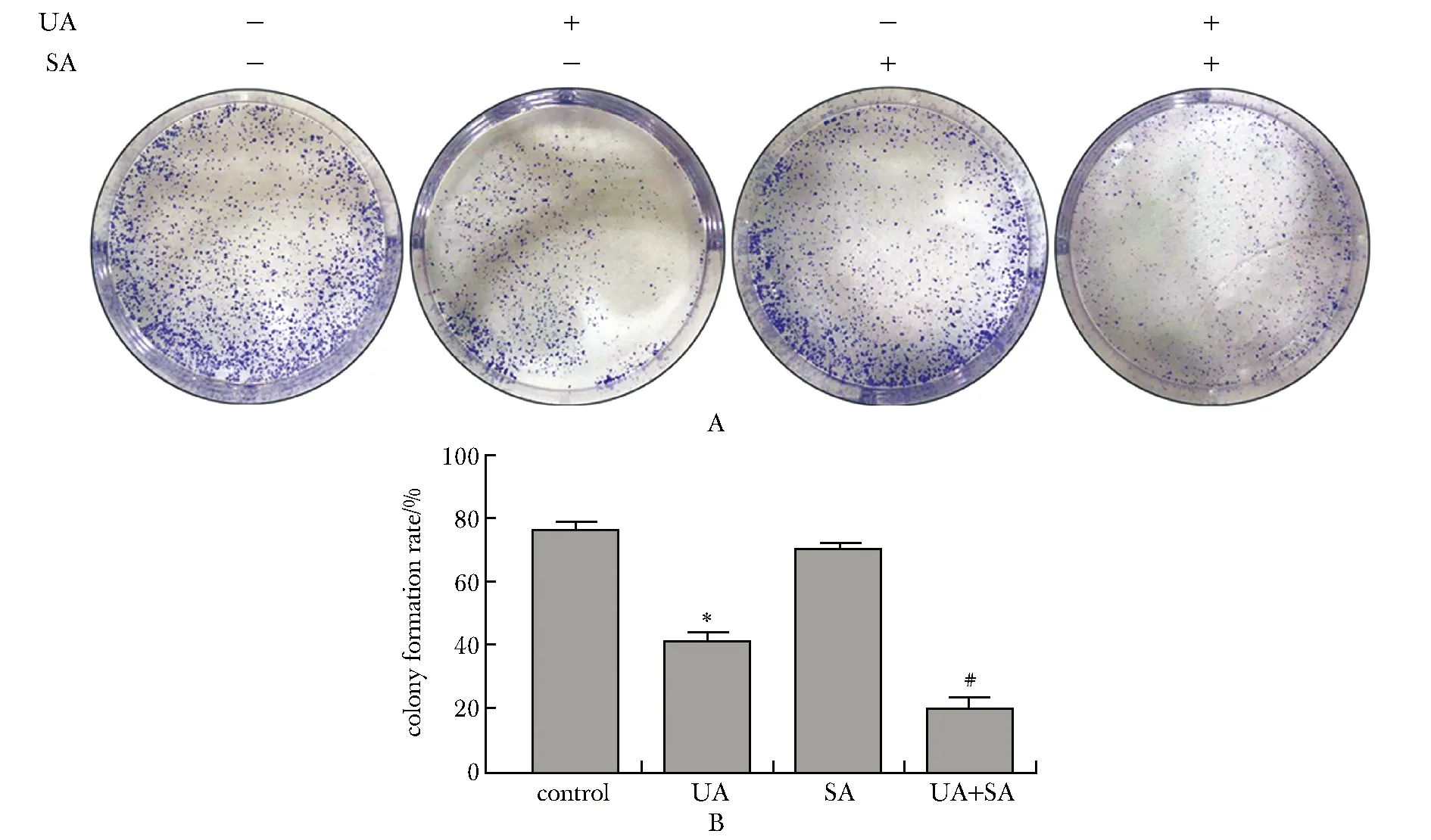
A.representative colony formation images of HepG2 cells;B.statistical analysis of cell colony formation of HepG2 cells;*P<0.01 compared with control;#P<0.01 compared with UA and SA图4 UA和SA对HepG2细胞克隆形成能力的影响Fig 4 Effect of UA and SA on the cloning ability of HepG2 cells n=3)
2.4 UA、SA单药及联合用药对HepG2细胞周期的影响
UA和SA均可将HepG2细胞周期阻滞于G1期,联合用药效果尤为明显(P<0.01)(图5)。
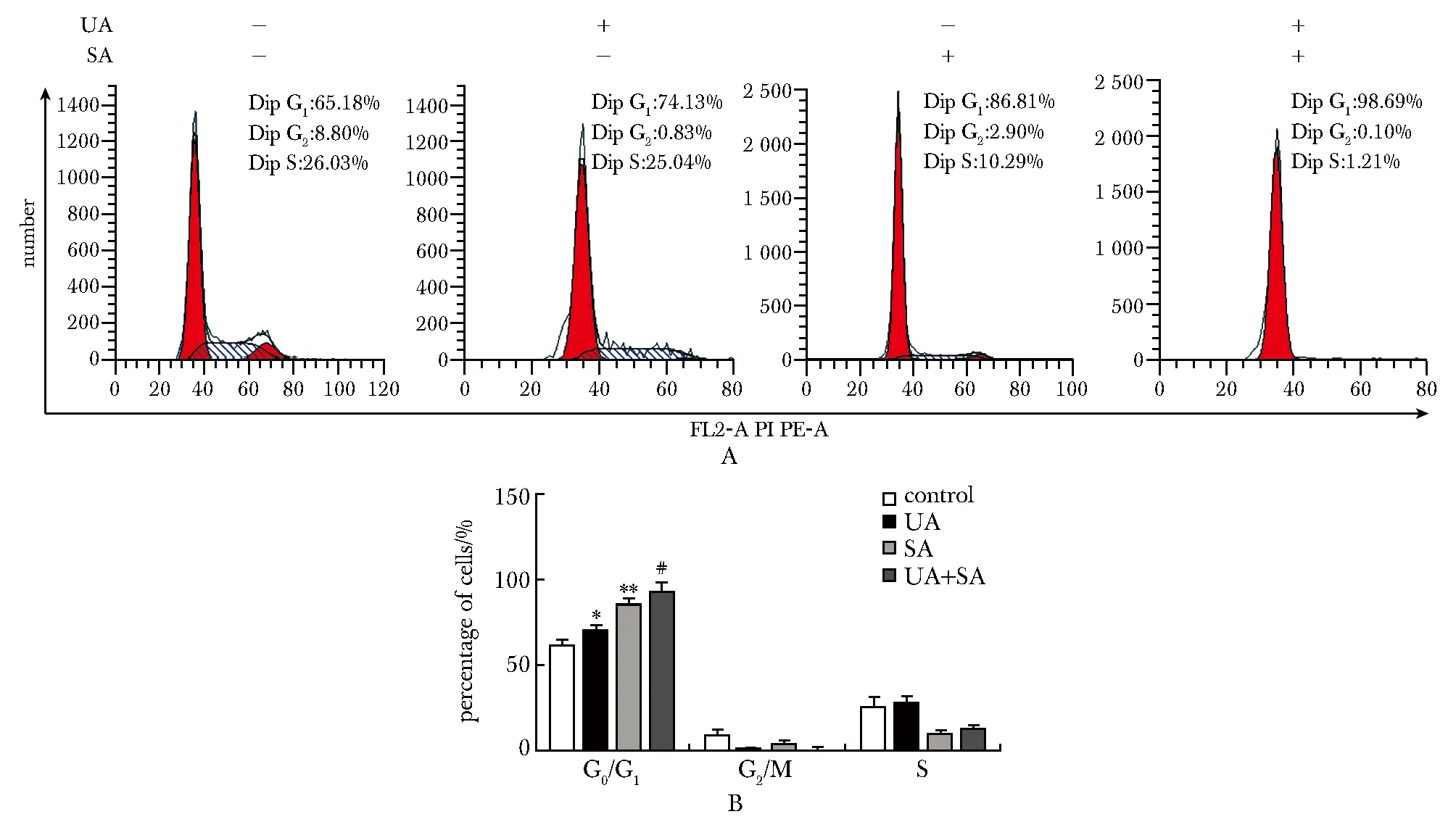
A.HepG2 cell cycle distribution images detected by flow cytometry;B.statistical analysis of cell cycle distribution in HepG2 cells;*P<0.05,**P<0.01 compared with control;#P<0.01 compared with UA and SA图5 UA和SA对HepG2细胞周期的影响Fig 5 Effect of UA and SA on cell cycle in HepG2 cells n=3)
2.5 UA、SA单药及联合用药对HepG2细胞乙酰化水平的影响
UA和SA均可降低HDAC2的蛋白表达水平,增加AC-α-tubulin的蛋白表达水平,且UA和SA联合用药组的抑制效果更为明显(P<0.01)(图6)。
2.6 UA、SA单药及联合用药对HepG2细胞周期、增殖与凋亡相关蛋白的影响
处理组与对照组相比,周期相关蛋白cyclin E1和CDK2表达水平,凋亡相关蛋白Bcl-2表达水平降低;Bax和cleaved-PARP表达水平则出现增高。两药联合组较其余各组变化尤其明显(P<0.01)(图6)。
3 讨论
UA是一种毒性低,分子质量小,脂溶性好的抗肿瘤活性化合物,近年来受到研究人员的广泛关注。有研究发现,熊果酸可降低HDACs下游蛋白在肝癌细胞中的表达[9]。HDAC2属于组蛋白脱乙酰基酶家族,在转录调节、细胞周期进程和发育事件中起重要作用[8]。本研究发现在肝癌细胞SMMC-7721、HepG2和PLC5中HDAC2的蛋白表达量均高于L02正常肝细胞。组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitor,HDACI)作为一类新型的靶向抗肿瘤药物,可通过调控细胞周期、促进细胞分化、诱导细胞凋亡、抑制血管生成等途径杀伤肿瘤细胞[10-11]。
本研究选用HDAC2选择性抑制剂SA联合UA来探究其对HepG2细胞的作用机制。首先,UA可以显著抑制HepG2细胞的增殖,表现为时间和浓度依赖性。在光镜下可见联合用药组细胞死亡较多,表现为分散和漂浮状。虽然单用SA组对细胞克隆形成能力影响不大,但UA组克隆形成数明显减少,而SA增强了UA 对HepG2细胞克隆形成能力的抑制作用。其次,UA、SA或两者联合使用均可降低HepG2细胞中HDAC2的蛋白表达水平,增加Ac-α-tubulin的蛋白表达水平。证明UA和SA均可通过降低HepG2的HDAC2蛋白的表达来增加细胞内的乙酰化水平。而抗细胞凋亡蛋白Bcl-2表达降低,促凋亡蛋白Bax和cleaved-PARP表达增加,表明UA和SA可引起HepG2细胞发生凋亡。CDK2和cyclin E1是调节细胞周期由G1进入S期的关键蛋白,当细胞周期被阻断在G1期时,CDK2和cyclin E1蛋白表达活性也会随之降低[12]。UA和SA均可降低CDK2和cyclin E1的蛋白表达水平,该结果表明UA和SA均可使HepG2细胞周期阻滞于G1期,而对S和G2/M期作用不大。
综上所述,UA对人肝癌细胞系HepG2的增殖有良好的抑制作用,其主要机制可能是通过抑制HDAC2的蛋白水平降低细胞内的乙酰化水平,进而影响到受HDAC2调控的与细胞凋亡或周期相关的蛋白表达,最终抑制了肿瘤细胞的增殖。因此,UA和SA (HDAC2i)的抗肿瘤作用机制有相似之处,UA可能是一种潜在的HDAC2抑制剂,在抗肝癌的研究中具有一定的应用前景。

