响应面优化酶法辅助提取边麻菇多糖工艺
陈 帅,王兆丰
(1.静宁县甘沟镇市场监督管理所,甘肃 静宁 743400;2.静宁县食品药品检验检测中心,甘肃 静宁 743400)
边麻菇,又称荷叶离褶伞(Lyophyllum decastes)、鹿茸菇、泥窝、荷叶蘑,属于伞菌目、口蘑科、离褶伞属,是一种非常珍贵的药食两用食用真菌。因生长在甘肃海拔2 600 m以上,无任何污染的野生环境中,有着很强的抗病性能及丰富的营养成分,是一种富含人体必需氨基酸、矿物质、维生素和多糖等营养成分的高蛋白、低脂肪健康食品。多糖作为重要活性成分之一,因其独特的功能特性而受到越来越多的关注,如抗肿瘤[1]、抗氧化[2]、调节肠道微生物群[3]、抗糖尿病[4]、免疫调节[5]、乳化[6]和降脂[7]作用等。
制备活性多糖的第一步是优化提取工艺。据报道,提取工艺对多糖的产量、化学性质、生物活性和应用领域有重要影响[8]。传统的热水提取法(HEM)具有操作简单、不需要特殊设备的优点,但其较高的提取温度和较长的提取时间可能对多糖的生物功能产生不利影响[9]。超声辅助提取法(UEM)可以通过超声空化效应破坏细胞壁。而酶辅助提取法(EEM)通过酶解降解细胞壁,可以促进多糖产量的提高[10]。超声波酶辅助提取法作为一种新的提取技术,结合了UEM法和EEM法的优点,已应用于多糖的提取。
EEM法的反应条件相对温和,环保、高效、低能耗、易操作是EEM法的优势。通常情况下,酶解温度、酶解时间、酸碱度、酶用量、液固比等因素都会影响胞外多糖的提取率。响应面法是一种有效的数理统计方法,用于优化变量的影响和变量之间的相互作用对响应数据的影响,被广泛应用于获得提取多糖的最佳条件[11]。本研究采用响应面法中的Box-Behnken设计对提取条件进行优化,以期为边麻菇多糖应用及开发提供一定的参考。
1 材料和方法
1.1 试验材料
边麻菇,购自肃南市场。在50 ℃下干燥后,将干燥的子实体粉碎成粉末用于多糖提取。
果胶酶(酶活≥30 U/mg)、纤维素酶(酶活≥30 U/mg)、木瓜蛋白酶(酶活≥400 U/mg)、复合酶由果胶酶、木瓜蛋白酶和纤维素酶按等比例(质量比1∶1∶1)组成。
1.2 试验方法
1.2.1 酶辅助法提取边麻菇多糖
称取一定量边麻菇粉末按照一定比例加入去离子水,加入一定量复合酶,调节pH值,在温度50 ℃酶解一定时间后,将提取物以5 982 r/min离心15 min,减压浓缩上清液至原体积的1/4,加入无水乙醇沉淀浓缩后的上清液,使其终浓度为75%(体积分数),4 ℃静置12 h;随后以5 982 r/min离心15 min获得沉淀,先后用乙醚、无水乙醇和丙酮洗涤沉淀。由氯仿和正丁醇以4∶1(V/V)的比例组成Sevag试剂,除去沉淀中的蛋白质,提取物通过分子量为1 400 Da透析袋进行透析,冷冻干燥后得到边麻菇粗多糖,用公式(1)计算多糖得率:

1.2.2 液固比、酶解时间、复合酶质量分数、pH值对多糖提取的单因素影响试验
试验设计了4个多糖的提取变量(液固比、酶解时间、复合酶用量、pH值),比较其对多糖得率的影响。液固比(A,去离子水/子实体粉末,mL/g)设置15、20、25、30、35这5个处理;酶解时间(B)设置30、60、90、120、150 min这5个处理;复合酶质量分数(C,复合酶与子实体粉末混合物的质量比)设置5个处理,分别为0.5%、1.0%、1.5%、2.0%和2.5%;pH值(D)设置3、4、5、6、7这5个处理。第1试验为液固比试验,在15~35范围内的单因素进行,其他3个参数,包括酶解时间、pH值和复合酶质量分数,分别设定为120 min、6和1.0%。此后,酶解时间、复合酶质量分数、pH值等3个单因素试验均按照后一个单因素试验根据前一个单因素试验的最佳结果进行的原则。
1.2.3 响应面优化试验(BBD)
在进行单因素设计试验后,采用Design-expert软件(8.0.6)进行四变量BBD试验。每个变量包含3个梯度(-1,0,1),以多糖得率作为响应值,总共29次试运行,构成了整个设计表1。
根据BBD试验的变量值和相应的边麻菇多糖提取得率,得出4个提取变量和提取得率之间的关系,以二次多项式方程(2)表示如下:
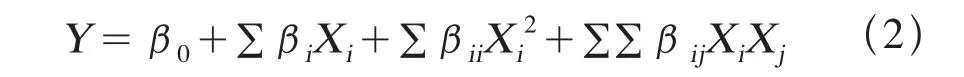
其中,Y是多糖得率预测值,β0是常数,βi是线性系数,βii是二次系数,βij是交互项系数,Xi和Xj代表4个自变量。
依据回归方程绘制等高线图,将多糖得率以等高线图的形式进行描述。每个等高线图中,2个变量在测试范围内,而其他变量固定在0水平。
对回归模型验证优化:根据回归方程计算出的理论最佳数据(液固比、酶解时间、复合酶质量分数、pH值),进行3次重复验证试验,实际获得的多糖平均得率与模型预测多糖得率进行对比,验证回归方程的准确性。
1.3 统计分析
采用SPSS 17.0对单因素方差分析进行比较。通过Duncan多范围试验进行平均值的多重比较,这些值显示为平均标准偏差。用曲线估计法评价多糖水平对抗氧化作用的影响。P<0.05被认为具有统计学意义。所有测定均测量3次。
2 结果与分析
2.1 单因素试验结果分析
2.1.1 不同液固比对边麻菇多糖提取效果的影响
液固比对边麻菇多糖得率的影响如图1A所示。边麻菇多糖得率随液固比变化呈先升高后下降的趋势,当液固比为20时,边麻菇多糖得率达到最大值(8.49%);这种现象的可能原因是,当液固比相对较低时,边麻菇粉末倾向于聚集在一起,水分子难以进入植物组织,导致多糖得率偏低[12]。随着液固比的增加,提取液的黏度降低,水中溶解的多糖分子增加,导致多糖得率显著增加,但当液固比高于20时,边麻菇多糖下降;这一结果可能是因为当提取溶剂的量过大时,植物组织中的多糖的扩散距离增加,这可能抑制了多糖的溶解[13];因此,最佳液固比选择为20。
2.1.2 酶解时间对边麻菇多糖提取效果的影响
酶解时间对边麻菇多糖得率的影响如图1B所示。随着酶解时间从30 min增加到60 min,边麻菇多糖得率显著增加。酶解时间为60 min时,多糖得率最高,为9.89%。酶解时间为90 min时,多糖得率略有下降。随着酶解时间进一步增加,到120、150 min时,多糖得率显著下降,这意味着过长的酶解时间可能导致多糖降解[14];因此,确定60 min的酶解时间作为响应面优化中心点。
2.1.3 复合酶质量分数对边麻菇多糖提取效果的影响
图1C显示了复合酶质量分数对边麻菇多糖提取效果的影响。随着酶质量分数的增加,多糖得率呈现先显著提高,随后略有下降,当复合酶质量分数为1.5%时,多糖得率最大,为10.18%。这可能是因为随着酶复合物剂量的增加,酶接触底物的机会增加,这有利于多糖的溶解,导致多糖产量的提高[15];然而,当酶的质量分数足以与底物反应时,进一步增加酶的用量不会提高多糖的产量;因此,选择1.5%的酶复合物质量分数用于随后的BBD试验。
2.1.4 pH值对边麻菇多糖提取效果的影响
pH值对边麻菇多糖提取效果如图1D所示,当pH值从3增加到5时,边麻菇多糖的得率从9.15%显著增加到10.48%,当pH值增加到6和7时,边麻菇多糖得率显著降低。原因可能是:酶的空间结构在不同的pH值下发生了变化,从而改变了酶的构象和活性[16-17];因此,最适pH值为5。
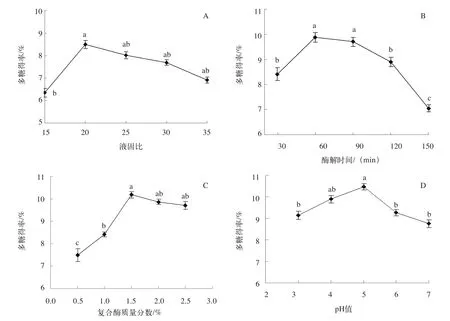
图1 液固比(A)、酶解时间(B)、复合酶质量分数(C)和pH值(D)对多糖提取效果的影响
2.2 边麻菇多糖提取的BBD试验结果分析
2.2.1 边麻菇多糖提取得率的预测模型和方差分析
表1显示了BBD试验的变量值和相应的边麻菇多糖提取得率。4个提取变量(A、B、C和D)和提取得率(Y)之间的关系以二次多项式方程(3)表示如下:

表1 边麻菇多糖提取的Box-Behnken试验设计及响应值

BBD试验的方差分析结果如表2所示。失拟项P值(0.053 5)>0.05,表明回归模型具有良好的可靠性。模型的P值<0.05,表明得到的回归模型是显著的。测定系数(R2)为0.872 6。此外,调整后的决定系数(adjR2)为0.745 3。高R2值和adjR2值表明4个变量之间的高度相关性,在BBD试验中获得了边麻菇多糖优化条件。变异系数(C.V.,3.95%)较低,表明预测值与实际值一致。如表2所示,交叉积系数(BD)、线性系数(A、C)和所有二次系数(A2、B2、C2和D2)达到显著水平;取变量的F值,其对多糖得率的影响顺序为:复合酶质量分数>液固比>pH值>酶解时间。

表2 Box-Behnken设计试验的单向方差分析
2.2.2 预测模型的等高线图
等高线图是回归方程的图形显示模式。如图2所示,从等高线图中看出,只有固液比和复合酶质量分数、酶解时间和复合酶质量分数这2个指标是圆形的,其他都为椭圆形的,说明二者之间相互作用较强。

图2 边麻菇多糖得率的等高线图
2.2.3 回归模型优化
根据预测回归方程计算得到的多糖提取的提取参数如下:液固比20.94,酶解时间61.63 min,pH值5.11,复合酶质量分数1.65%,多糖理论得率为10.83%。为便于实际操作,提取参数设定为:液固比21,酶解时间62 min,pH值5,酶复合剂质量分数1.65%,3次重复验证试验多糖平均得率为(10.96±0.12)%,与模型预测多糖得率一致;因此,回归模型可适用于边麻菇多糖的酶法提取。
3 结论与讨论
本研究采用酶辅助提取法制备边麻菇多糖。通过响应面法设计,当液固比21,酶解时间62 min,pH值5,酶复合剂质量分数1.65%,3次重复试验平均多糖得率为(10.96±0.12)%;因此,这种优化提取方法可以在生物活性物质提取研究中进一步推广。
此法优于传统热水浸提法,主要由于在复合酶作用下,细胞壁被破坏,更多的糖溶于水提液中,但2种方法制备多糖抗氧化是否有差异,有待后续试验进一步研究。

