孤儿核受体小异二聚体伴侣在胆汁酸及糖脂代谢中的作用研究进展
吕秋月,姜保平,肖培根
(中国医学科学院北京协和医学院药用植物研究所/国家教育部中草药物质基础与资源利用重点实验室,中国北京100193)
核受体是配体激活的转录因子,可在多种生理途径中调节靶基因的表达,在哺乳动物的生长发育以及生理功能和代谢中起着核心作用[1~2]。小异二聚体伴侣(small heterodimer partner,SHP)是核激素受体超家族的孤核成员,含有其他家族成员中已发现的二聚化和配体结构域,但缺乏保守的DNA结合域。自1996年在酵母双杂交系统中分离出SHP以来,SHP已被大量研究报道可与多种核受体及转录因子相互作用发挥转录共抑制因子功能,并参与调节胆固醇/胆汁酸、脂质和葡萄糖/能量代谢[3~5]。此外,SHP也参与调节胰岛素抵抗和β细胞功能障碍,研究报道SHP的遗传突变与肥胖和2型糖尿病相关[6~7]。因此,SHP作为一种转录抑制因子,在代谢中起着至关重要的作用。本文初步探讨了SHP在胆汁酸、葡萄糖和脂质代谢中的作用及其与2型糖尿病的相关性,可为未来进一步研发防治2型糖尿病的药物提供帮助。
1 SHP在胆汁酸代谢中的作用
胆汁酸是控制葡萄糖和脂质代谢的信号分子,调节胆汁酸合成相关酶的表达可影响胆汁酸池的大小及组成,这可能成为未来治疗2型糖尿病和肥胖等代谢性疾病的有效途径[8~10]。SHP在胆汁酸产生的负反馈调节中具有重要作用。研究报道,SHP可通过与肝脏X受体α(liver X receptor α,LXRα)[11]以及孤儿核激素受体肝受体同源蛋白1(liver receptor homologous protein-1,LRH-1)[12]相互作用并调节其转录活性,从而参与到胆汁酸代谢途径中。肝脏中的胆汁酸主要由胆固醇在肝细胞中通过一系列酶的协同作用产生。肝脏中胆固醇含量的升高会诱导氧固醇的形成,氧固醇与LXRα结合并激活胆固醇-7α-羟化酶(cholesterol 7α-hydroxylase,CYP7A1)的转录。CYP7A1 的表达上调可增加胆汁酸合成和随后的胆固醇排泄。随着胆汁酸水平的增加,法尼醇X受体(farnesoid X receptor,FXR)被激活,进而诱导SHP的转录[13~15]。SHP是FXR的直接作用靶点,其表达上调,一方面可通过和沉默信息调节因子1(silent information regulator 1,SIRT1;一种Ⅲ类组蛋白去乙酰化酶)相互作用来抑制LRH-1介导的基因转录(包括CYP7A1和SHP)[16],另一方面可通过抑制肝细胞核因子 4α (hepatocyte nuclear factor 4α,HNF-4α)的活性来抑制CYP7A1和甾醇-12α-羟化酶(cholesterol 12α-hydroxylase,CYP8B1)的表达,从而抑制胆汁酸合成[13~14,17~18]。相关研究显示,蛋白质精氨酸甲基转移酶5(protein arginine methyltransferase 5,PRMT5)可通过甲基化SHP增强SHP的抑制活性,包括HNF-4和LRH-1[19]。
有研究发现,当小鼠体内SHP缺失时,胆汁酸通过代偿性通路代谢,但与野生型小鼠相比,SHP缺失小鼠体内的胆汁酸和脂质稳态均有轻微缺陷[20~21]。另外,SHP的持续表达也会造成胆汁酸池的耗竭和肝脏中甘油三酯的积聚[22]。因此,肝脏中SHP的表达保持在正常水平对于维持胆汁酸稳态至关重要(图1)。
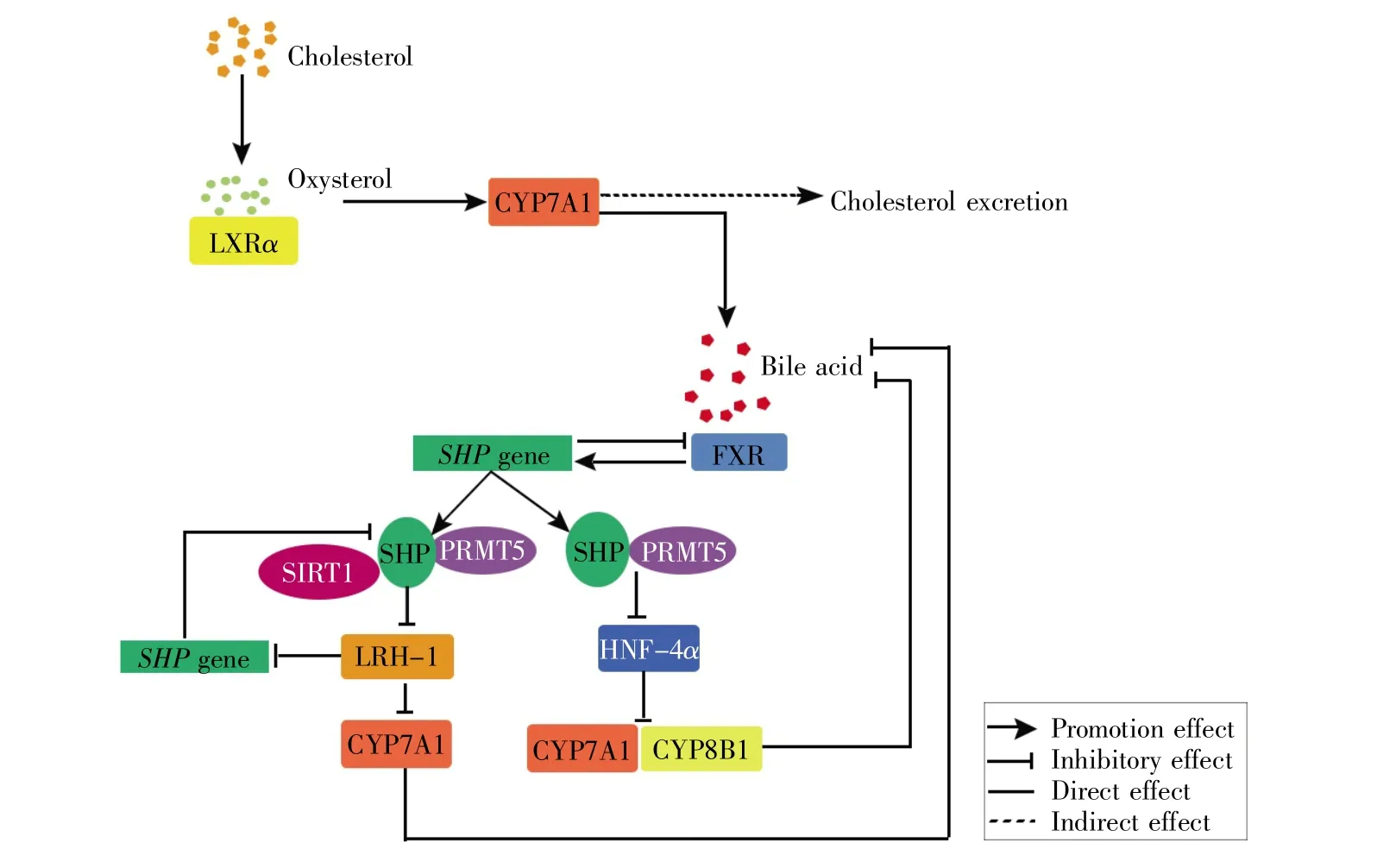
图1 SHP参与调节胆汁酸代谢(参照文献[16]和[17]修改)SHP与LRH-1和HNF-4α相互作用,抑制CYP7A1和CYP8B1表达,从而反馈抑制胆汁酸合成。Fig.1 SHP is involved in regulating bile acid metabolism(modified according to References[16]and[17])SHP interacts with LRH-1 and HNF-4α to inhibit the expression of CYP7A1 and CYP8B1,thereby leading to feedback inhibition of bile acid synthesis.
2 SHP在葡萄糖代谢和胰岛β细胞功能中的作用
2.1 SHP与2型糖尿病的关系及在葡萄糖代谢中的作用
SHP的遗传突变与2型糖尿病相关。Enya等[6]在研究中纳入了805位糖尿病受试者和752位非糖尿病受试者,通过对两组群体SHP的两个外显子和侧翼序列进行测序,在44位受试者中发现了15种不同的SHP突变;进一步对这些突变进行功能分析,结果显示,与儿童期轻度肥胖症相关的SHP突变会增加日本人晚年对2型糖尿病的易感性。
SHP参与调节机体葡萄糖代谢。研究表明,肝脏FXR-SHP信号通路在控制葡萄糖稳态方面起到重要作用[23]。胆汁酸经FXR-SHP通路以SHP依赖性的方式抑制糖异生过程关键酶磷酸烯醇丙酮酸羧化激酶(phosphoenolpyruvate carboxykinase,PEPCK)、葡萄糖-6-磷酸酶(glucose-6-phosphatase,G6Pase)和果糖1,6-双磷酸酶(fructose 1,6-bisphosphatase,FBP1)的表达,进而抑制糖异生,减少肝脏葡萄糖生成[24]。此外,SHP还可通过与多种核受体和转录因子相互作用降低糖异生过程中关键酶的表达,从而影响机体葡萄糖稳态。
糖皮质激素是一种类固醇激素,可促进肝脏糖异生,并在骨骼肌和白色脂肪组织(white adipose tissue,WAT)中通过对抗胰岛素反应来降低葡萄糖的摄取和利用,过多的糖皮质激素可导致高血糖和胰岛素抵抗[25]。糖皮质激素受体(glucocorticoid receptor,GR)和HNF-4的共激活剂——过氧化物酶体增殖物激活受体γ共激活剂1(peroxisome proliferator-activated receptor gamma coactivator 1,PGC-1)在肝脏糖异生中起重要作用[26]。研究发现,SHP可通过拮抗PGC-1介导的肝脏GR和HNF-4的共激活来降低PEPCK的表达,从而抑制肝脏糖异生[27]。SHP也可通过与HNF-3相互作用抑制其转录活性[28]。在HepG2细胞中,SHP通过抑制HNF-3的活性,进而抑制G6Pase和CYP7A1的表达;在大鼠原代肝细胞中,SHP通过抑制HNF-3的活性,从而抑制PEPCK的表达[28]。另外,SHP还可与HNF-6相互作用,并通过阻断HNF-6与目标DNA序列的结合来抑制其转录活性,从而抑制HNF-6介导的G6Pase和PEPCK的转录激活,最终抑制G6Pase和PEPCK的表达[29]。研究显示,SHP也可与FoxO1相互作用,并通过抑制FoxO1在G6Pase基因启动子上的转录活性,降低G6Pase基因表达[24]。进一步研究发现,SHP在SIRT1-FoxO1信号通路中起到反馈调节作用,在该通路中,SIRT1和FoxO1除了激活G6Pase与丙酮酸脱氢酶激酶4(pyruvate dehydrogenase kinase 4,PDK4)的表达之外,也调节SHP基因的表达,而SHP的表达上调可反馈抑制FoxO1和SIRT1激活的G6Pase与PDK4的表达,从而抑制肝脏糖异生,调控肝脏葡萄糖生成[30]。
AMP-激活蛋白激酶-SHP信号通路在调节肝脏葡萄糖稳态过程中也具有重要作用。AMP活化蛋白激酶(AMP-activated protein kinase,AMPK)是细胞内的能量传感器,参与调节葡萄糖代谢[31]。在B6-Lepob/ob小鼠中,二甲双胍通过AMPK依赖性途径增加肝脏SHP表达,从而抑制G6Pase和PEPCK的表达,抑制肝脏葡萄糖生成,进而降低小鼠餐后血糖水平[32]。进一步研究发现,二甲双胍可通过毛细血管扩张性共济失调突变基因(ataxia telangiectasia-mutated gene,ATM)-AMPK-SHP信号通路,抑制生长激素介导的肝脏糖异生过程,调节肝脏葡萄糖稳态[33]。与上述研究一致,在肝细胞中,肝细胞生长因子(hepatocyte growth factor,HGF)激活AMPK信号转导,进而激活E-box结合转录因子USF-1(upstream stimulatory factor-1),使其特异性结合SHP基因启动子,诱导SHP基因表达,随后SHP通过抑制转录因子HNF-4α来抑制糖异生基因G6Pase和PEPCK的表达,减少肝脏糖异生[34]。此外,还原剂亚砷酸钠也可通过激活AMPK信号通路诱导SHP表达,进而抑制肝脏糖异生[35]。这些结果表明,在肝脏中,SHP作为调节因子可通过多种途径影响G6Pase、PEPCK和PDK4等糖异生关键酶的表达,进而影响肝脏糖异生(图2);通过调节肝脏中SHP的表达来维持肝脏葡萄糖稳态,可能是未来控制2型糖尿病患者血糖的一种新途径。
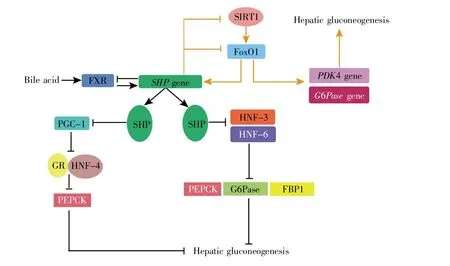
图2 SHP参与调节肝脏葡萄糖代谢(参照文献[29]修改)SHP与多种核受体和转录因子相互作用抑制糖异生相关酶PEPCK、G6Pase、FBP1和PDK4的表达,从而抑制肝脏糖异生。Fig.2 SHP is involved in regulating hepatic glucose metabolism(modified according to Reference[29])SHP interacts with a variety of nuclear receptors and transcription factors to inhibit the expression of gluconeogenesis-related enzymes PEPCK,G6Pase,FBP1 and PDK4,thereby inhibiting hepatic gluconeogenesis.
2.2 SHP在胰岛素抵抗和胰岛β细胞功能中的作用
外周组织(肝脏、肌肉和脂肪等)胰岛素抵抗和胰岛β细胞胰岛素分泌受损是2型糖尿病的主要特征。提高胰岛素敏感性、改善胰岛β细胞功能是治疗2型糖尿病的重要方向。核受体PPARγ(peroxisome proliferator-activated receptor)与胰岛素作用紧密相关,是胰岛素增敏剂噻唑烷二酮类(thiazolidinediones,TZDs)药物的靶点[36]。研究发现,PPARγ的转录活性在SHP与其特异性结合后得到显著增强[37]。为了进一步研究SHP对PPARγ的作用,研究者比较了TZDs药物在ob/ob小鼠和ob/ob;SHP-/-小鼠(SHP敲除的ob/ob小鼠)中的作用,结果发现,与ob/ob小鼠相比,ob/ob;SHP-/-小鼠肝脏和脂肪组织中PPARγ2的mRNA表达水平显著降低,高血糖和胰岛素抵抗症状明显加重,而且TZDs药物处理不能改善ob/ob;SHP-/-小鼠的糖尿病症状,对脂联素、抵抗素等脂肪细胞因子的表达也没有显著影响[38]。此研究表明,在ob/ob小鼠中,敲除SHP后,TZDs药物不能正常发挥作用,TZDs药物发挥其降血糖和降血脂的作用需要SHP的参与。
在肥胖相关的糖尿病患者中,β细胞中的线粒体解偶联蛋白UCP2(mitochondrial uncoupling protein)上调,导致葡萄糖刺激的胰岛素分泌受损。研究发现,在正常胰岛细胞内过表达SHP可增强胰岛素分泌,在UCP2过表达的胰岛细胞内增加SHP的表达也可恢复受损的胰岛素分泌,提示SHP可通过增强线粒体葡萄糖代谢正向调节β细胞内胰岛素分泌,并恢复UCP2过表达β细胞中的葡萄糖敏感性[39]。但是,Park等[40]的研究显示,在大鼠胰岛细胞瘤细胞系INS-1内利用腺病毒增加内源性SHP的表达后,胰岛素基因表达的阳性调节因子BETA2/NeuroD的转录活性降低,胰岛素基因表达被抑制,胰岛素分泌受损,而在利用干扰小RNA(small interfering RNA,siRNA)抑制SHP的表达后,高糖诱导的胰岛素基因抑制可部分恢复。研究人员在2型糖尿病模型OLETF大鼠胰岛内也发现了一致的结果,和野生型LETO大鼠相比,OLETF大鼠胰岛内SHP的表达显著上调,相应地,胰岛素基因的表达显著下降[40]。另一项研究也发现,与野生型小鼠相比,SHP的敲除可使小鼠免于链脲佐菌素诱导的胰岛β细胞凋亡,同时改善高血糖症并维持胰岛功能[41]。因此,SHP在维持胰岛β细胞葡萄糖敏感性,调节胰岛素基因表达中也起着至关重要的作用。深入研究显示,胰岛β细胞内高度发达的内质网结构是β细胞发挥其功能的关键因素。在INS-1细胞中,高葡萄糖刺激诱导细胞内质网应激,从而损害胰岛素基因表达,这一过程由激活转录因子6(activating transcription factor 6,ATF6)介导;当利用siRNA抑制内源性SHP的表达后,ATF6诱导的胰岛素基因表达抑制被阻断[42]。此外,SHP可与内质网应激关键调节因子XBP1(X-box-binding protein 1)相互作用,并抑制Cullin3-SPOP(speckle-type POZ protein)E3连接酶复合物对XBP1的多泛素化和降解,参与调节胰腺内质网稳态[7]。
综上可知,SHP是TZDs类药物发挥作用的关键因子,并参与调节胰岛素分泌,同时影响胰岛β细胞功能。在胰腺内特异性调节SHP的表达,一方面可通过影响胰岛素基因表达改善胰岛素分泌,另一方面可通过调节胰腺内质网稳态改善2型糖尿病患者胰岛β细胞功能紊乱。
3 SHP在肥胖和脂质代谢中的作用
一项在日本进行的研究发现,173位受试者(在15岁之前被诊断为2型糖尿病)中有6位受试者的SHP基因出现了5种不同的突变,而具有这些突变的所有受试者在糖尿病发病早期均伴随轻度或中度肥胖;在另外101位受试者(非糖尿病相关的早发性肥胖患者)中研究人员也发现了相关的SHP突变,而在116位健康受试者(非糖尿病患者且体重正常)中未发现SHP突变,以上结果表明SHP遗传突变可能与日本受试者的轻度肥胖相关[43]。另一项在白种人中进行的研究发现,SHP突变不是导致白种人严重早发性肥胖的常见原因,并且与日本的肥胖2型糖尿病患者相比,白种人中肥胖2型糖尿病患者的SHP突变比较少见,但SHP基因位点的遗传变异可能会影响出生体重,并可能通过影响胰岛素分泌对体重指数(body mass index,BMI)产生影响[44~45]。以上研究表明,SHP突变可能与早发性肥胖相关并可能影响出生体重,但SHP突变产生的影响在不同人群中有明显差异,需要进一步扩大研究范围以确定其具体作用。
棕色脂肪组织(brown adipose tissue,BAT)的活性与肥胖和代谢性疾病(如2型糖尿病和血脂异常)的预防有关。有研究发现,SHP作为负调节因子在BAT中调节PGC-1α的表达和能量生成,在小鼠(C57BL6/129sv混合系背景)体内敲除SHP可增加PGC-1α的表达和能量消耗,并可预防高脂饮食引起的肥胖,同时改善葡萄糖耐量,提高胰岛素敏感性[46]。与此一致,另一项研究发现,高脂饮食饲养10周后,与野生型小鼠相比,在白色脂肪组织(WAT)和BAT中特异性过表达SHP的TG小鼠(Swiss Webster品系)的体重和脂肪质量指数显著增加,并伴随严重的葡萄糖耐受不良[47]。另外,研究人员在db/db小鼠中分析SHP的表达时发现,与野生型小鼠相比,db/db小鼠WAT中SHP的表达显著增加[47]。这些结果表明,SHP在肥胖和2型糖尿病的发展中可能具有重要作用。此外,在高脂饮食饲养下,同类近交系SHP基因敲除小鼠(SHP-/-小鼠,C57BL6品系)的体重和肝脏脂质积累量显著低于野生型小鼠,同时肝脏β氧化显著增加,但SHP-/-小鼠表现出了严重的葡萄糖耐受不良[48]。与此类似,在ob/ob小鼠中,敲除SHP基因可减少小鼠肝脏中PPARγ2和脂肪生成基因的表达,降低肝脏甘油三酯水平,抑制脂肪肝的发展[38,49],并改善葡萄糖耐量和胰岛素敏感性[49]。而且,该课题组在后来的研究中发现,与ob/ob小鼠相比,敲除SHP后的ob/ob小鼠表现出更严重的高血糖和胰岛素抵抗,同时加剧葡萄糖耐受不良[38]。上述研究表明,抑制SHP的表达可能能够预防饮食引起的肥胖以及肝脏脂肪变性,但是敲除SHP是改善还是加重葡萄糖耐受不良却出现了不同的结果,这可能是小鼠培育方式以及遗传特点的不同造成的,不管如何,该方面还需要用更细化的实验手段来展开进一步研究。
肝脏FXR-SHP信号在控制脂质稳态方面具有重要作用[4]。Kim等[4]在研究中发现,FXR/SHP双敲除小鼠(DKO小鼠)在早期会出现胆汁淤积和肝脏损伤,但这种基因敲除对老龄小鼠血糖和胆汁酸代谢有益,与野生型小鼠相比,FXR/SHP双敲除可显著减轻老龄小鼠的体重和脂肪组织质量。肝脏FXR/SHP基因特异性双敲除小鼠显示出和DKO小鼠相似的表型,肝脏FXR/SHP基因的特异性双敲除可改善老年小鼠葡萄糖和胰岛素耐受,降低肝脏甘油三酯积聚,并增加脂肪酸利用率,对老年小鼠全身能量稳态具有显著影响[4]。另一项研究也发现,在高脂饮食饲养后,与野生型小鼠相比,DKO小鼠对高脂饮食诱导的肥胖具有抗性,同时对肝脏脂肪变性具有保护作用。此外,在高脂饮食饲养后,DKO小鼠的血糖水平显著低于野生型小鼠,并且相较于野生型小鼠在高脂饮食后出现的葡萄糖耐受不良,DKO小鼠葡萄糖耐受良好[5]。肝脏中SHP单敲除的小鼠也表现出和DKO小鼠相似的表型,在高脂饮食饲养后其体重明显降低,肝脏中甘油三酯含量显著减少,葡萄糖耐受明显改善[5]。另外也有研究发现,胆汁酸可通过FXR-SHP信号通路抑制SREBP-1c(sterol regulatory element-binding protein-1c)的表达,从而抑制小鼠(KK-Ay小鼠)肝脏甘油三酯积聚[50]。在FXR-SHP信号下游,LRH-1可增强LXR应答并激活脂肪酸合成酶(fatty acid synthase,FAS)的基因启动子,这一过程可被SHP阻断[51]。与此一致,在SHP基因敲除小鼠体内FAS基因的表达水平与野生型小鼠相比显著增加[51]。这些研究表明,SHP参与调控甘油三脂稳态和脂肪酸合成与利用(图3),通过调节SHP的表达调控机体脂质代谢可能改善2型糖尿病患者的脂质代谢紊乱。
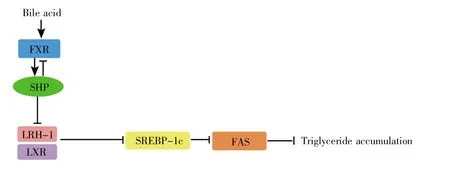
图3 SHP参与调节脂质代谢(参照文献[50]修改)肝脏FXR-SHP-SREBP1c信号通路在调节脂质稳态方面具有重要作用。Fig.3 SHP is involved in regulating lipid metabolism(modified according to Reference[50])Hepatic FXR-SHP-SREBP1c signaling pathway plays an important role in regulating lipid homeostasis.
4 结论与展望
SHP作为转录抑制因子通过靶向调节一系列基因参与多种通路,进而调控体内大量的代谢过程,包括胆固醇和胆汁酸代谢、脂肪生成、葡萄糖代谢、甾类激素生物合成及细胞周期等。同时,SHP还是TZDs类药物及二甲双胍发挥降血糖作用的关键因子。此外,SHP在丙型肝炎病毒引起的糖脂代谢异常中起到重要的调节作用[52],并可通过影响生物钟和营养吸收参与维持代谢稳态[53~54]。由此可见,SHP通过复杂的调节网络参与多种生物学过程,且是许多降糖药物发挥作用的必要条件。目前针对SHP的研究尚存在一些不一致甚至相反的结果,因此对其本身功能及潜在调节通路方面的研究仍需进一步深入。另外,SHP的真正配体还没有被确定,发现特定的SHP配体和合成激动剂,也将为利用SHP干预治疗代谢综合征的研究打下重要基础。

