三叶青组培快繁与试管苗光合特性分析
郑漫佳,韩素芳,程诗明,何文泽,樊佳宁,杨海芸
(1.浙江农林大学,浙江 临安 311300; 2.浙江省林科院,浙江 杭州 310023)
三叶青学名三叶崖爬藤(TetrastigmahemsleyanumDiels et Gilg),别名三叶扁藤、金线吊葫芦等,为葡萄科崖爬藤属植物,是我国特有中草药[1-6]。三叶青自然生长于气温在18 ℃左右、海拔300~1300 m的山坡灌丛、山谷、林下岩石缝等湿度较大的地方。三叶青具有抗肿瘤、抗病毒、镇痛与解热、保肝护肝等作用,且毒副作用小,越来越受到国内外学者的关注[1,7]。由于三叶青对生长环境极其严苛,加上自然环境的恶化以及人为的无序采挖,野生三叶青资源濒临灭绝[4-6,8]。三叶青种苗需求在逐年增加,通过组织培养技术繁殖,对母株破坏少,少量微型茎段作为外植体即可在短期内获得大量整齐一致的种苗。徐刚等[9]采用三叶青带芽的茎段分化出丛生芽,月增殖率可达3~5倍;钟毓倩[10]以茎段腋芽为外植体诱导不定芽。姜维梅等[11]以完整的腋芽为培养材料;吴浩等[6]以不带腋芽茎段为培养材料,通过诱导愈伤组织,再脱分化产生不定芽,这些研究外植体选择不同,外植体再生的方式也不尽相同,目前关于三叶青组织培养繁育技术体系尚需完善。徐琳煜等[12]研究发现,强光、高温、低湿等环境条件使三叶青光合活跃度下降,对其生长产生胁迫;并且三叶青的叶绿素荧光响应受到光照强度的影响[13],关于组培苗的光合特性的研究还尚未见报道。因此,本研究旨在找到三叶青组培苗的最适培养基和植物生长调节物质的最佳浓度配比,在兼顾经济成本的同时,建立三叶青组织培养高效快繁技术体系,以提高三叶青种苗的质量与繁殖效率,为大量种苗生产、进一步深入的科学研究等提供参考。
1 材料与方法
1.1 材料
以浙江省林科院和浙江农林大学温室内生长健壮的3年生三叶青盆栽苗为试材,截取枝条中部的茎段为外植体,每个茎段带1~3个节,75%酒精表面消毒30 s,0.5% NaClO浸泡8 min,再无菌水冲洗5次,后接种到MS培养基中,获得无菌无根苗作为试验材料。
1.2 方法
选取生长良好的无菌无根苗,切取侧芽茎段,每段1个节,竖直插入培养基中培养。培养基分别以MS为基本培养基(基本培养基实验除外),分别添加不同种类与组合的植物生长调节物质,每个处理15瓶,重复3次。培养条件为:光强2400 lx,光周期 16/8 h,温度(25±2) ℃。
1.2.1 BA与NAA组合对三叶青侧芽繁殖的影响 设2个因素,其中BA分别为0、0.01、0.05、0.1、0.5 mg·L-1,NAA分别为0、0.01、0.1 mg·L-1,完全随机试验设计,共15个处理。
1.2.2 不同KT与NAA组合对三叶青侧芽繁殖的影响 设2个因素,其中KT分别为0、0.01、0.05、0.1、0.5 mg·L-1,NAA分别为0、0.01 mg·L-1,完全随机设计,共10个处理。
1.2.3 不同凝固剂对三叶青无菌苗生长的影响 添加不同浓度的琼脂粉(4、6、8 g)和水晶洋菜(Gelrite,1、2、3 g)作为凝固剂,单因素试验设计,共6个处理。
1.2.4 不同基本培养基对三叶青生长的影响 设置MS、1/2MS、1/3MS、WPM 4种基本培养基,添加BA 0.05 mg·L-1+NAA 0.01 mg·L-1(有、无),完全随机试验设计,共8个处理。
1.2.5 快速叶绿素荧光诱导动力学曲线和820 nm光吸收曲线测定 无菌苗在试管内生根后(简称试管苗),经过7d的驯化后移栽到基质为泥炭、珍珠岩和蛭石(1∶1∶1)混合的营养钵中栽培,置于浙江农林大学智能温室中精细管理。为了鉴定无菌试管苗移栽后生长能力,无菌苗移栽的同时也采用传统的方法直接野外截取茎段扦插繁殖三叶青小苗。组培苗移栽到营养钵中生长90 d的小苗称为当年生组培苗(A);组培苗移栽至营养钵中生长450 d的称为翌年生组培苗(B);营养钵中生长90 d的扦插苗称为扦插苗(C);在温室苗床下遮荫生长的当年生组培苗称为遮荫组培苗(D)。详见表1。
分别选取A、B、C、D苗各6盆,按照任丽丽[14]的方法,利用植物效率分析仪M-PEA(Hansatech,英国)测定快速叶绿素荧光诱导动力学曲线(OJIP曲线)和820 nm光吸收曲线,测定前叶片需暗适应15 min。OJIP曲线由5000 μmol m-2s-1的红光诱导,测定时间为2 s,记录的初始速率为每秒105个数据。按照Schansker Gert[15]的方法,将OJIP曲线标准化。820 nm光吸收曲线由250 μmol·m-2·s-1的远红光光诱导,记录时间为1 s。

表1 试验材料分组情况
1.3 数据分析
各处理试管苗生长30 d后,调查统计芽增殖系数、平均芽长、平均根数、平均根长等。芽增殖系数=(芽总数-接种芽数)/每管接种芽数;平均芽长、根数、根长为平均每个外植体新生的芽的长度、主根的长度和总根数。
采用Excel 2019进行试验数据的整理、计算,然后采用Origin 8.5做图。运用SPSS 22进行数据分析,方差分析采用Duncan法。
2 结果与分析
2.1 BA与NAA对三叶青试管苗生长的影响

图1 不同BA浓度侧芽生长情况
由表2可知,单独添加BA时,随着浓度的增加,侧芽增殖系数逐渐增大,平均芽长变小,平均根数减少,根长增加,叶片颜色越来越黄(图1),当添加BA 0.5 mg·L-1时侧芽增殖系数最大,达8.47。添加NAA后,随着BA浓度增加,侧芽增殖系数依然逐渐增加,芽长和根长却无显著差异;添加NAA 0.01 mg·L-1时,根数逐渐减少,表明组合中低浓度的NAA对根分化与不添加趋势一致,而NAA 0.1 mg·L-1时,平均芽长、根数、根长,随着BA浓度变化,差异不显著。因此,BA浓度增高有利于侧芽增殖。在前期预实验中发现,当BA大于1 mg·L-1时,不定芽分化很多,成簇生状难以计数,且芽玻璃化严重。因此,随着BA浓度的增加,三叶青芽增殖系数相应增大,且当添加BA 0.5 mg·L-1时,三叶青侧芽增殖显著高于其它浓度组合。不添加NAA,试管苗也能生根,添加NAA 0~0.01 mg·L-1时,生根受BA影响;当NAA达0.1 mg·L-1时,生根情况受NAA影响。

表2 不同BA与NAA组合对三叶青侧芽繁殖的影响
2.2 不同浓度的KT与NAA组合对三叶青试管苗生长的影响
由表3可知,单独添加不同浓度的KT时,随着浓度的增加,芽增殖系数、平均根数、平均根长呈先上升后下降的趋势,但都低于对照(不添加任何植物生长调节剂),其中添加KT 0.05 mg·L-1时,与对照无显著差异;在芽长方面,单独添加KT、KT与NAA组合,随着KT浓度增加,平均芽长均越来越长;KT 0.1 mg·L-1与NAA 0.01 mg·L-1组合时,芽长达到最大值,为2.35 cm。另外,在不同浓度的KT与NAA组合培养过程中,KT 0.1 mg·L-1与NAA 0.01 mg·L-1组合时根长值最大,达4.24 cm;平均根长也达到最大值,为4.24 cm;平均根数在不同浓度KT间无显著差异。因此,在不添加NAA的情况下,不同浓度的KT显著影响三叶青的侧芽增殖;在KT与NAA组合生根中,NAA影响起主要作用。
表3 不同KT与NAA组合对三叶青侧芽繁殖的影响
2.3 不同凝固剂对三叶青试管苗生长的影响
由表4可知,添加不浓度的凝固剂琼脂粉和水晶洋菜对芽增殖系数和芽长生长有一定的影响,而对于生根影响差异不显著。添加高浓度的琼脂粉8 g·L-1,芽增殖系数和平均芽长均最低,而添加水晶洋菜3 g·L-1时,芽增殖系数最大,达5.68,显著高于其它处理。3个浓度的水晶洋菜平均芽长总和为11.31 cm,琼脂粉的芽长总和为8.19 cm,水晶洋菜各处理都显著高于琼脂粉的各个处理。研究中还发现,添加琼脂粉的试管苗生长容易出现玻璃化。

表4 不同浓度凝固剂对三叶青无菌苗生长的影响
2.4 不同基本培养基对三叶青试管苗生长的影响
由表5可知,在不添加植物生长调节剂的条件下,不同基本培养基的芽增殖系数无显著差异,平均芽长以1/3 MS和WPM显著高于MS和1/2 MS,平均根数与根长以WPM显著高于其它3个基本培养基。在添加植物生长调节剂的条件下,1/3 MS的芽增殖系数、平均芽长、平均根长显著低于其它基本培养基;MS与WPM基本培养基的芽增值系数、芽长没有显著差异;在MS和1/2 MS基本培养基中,添加植物生长调节剂的芽增殖系数和平均芽长都显著高于不添加植物生长调节剂的处理;而在1/3 MS和WPM培养基中,是否添加植物生长调节剂对芽生长和生根数均没有显著差异。综上所述,MS+BA 0.05 mg·L-1+NAA 0.01 mg·L-1更有利于芽生长,同时根系生长良好。
2.5 三叶青无菌苗大量繁殖与生产能力核算
综合各试验结果,以节约成本、高效生产高质量的三叶青组培苗为前提,三叶青组织培养过程中,增殖与生根培养一步完成,在程序上大大减少了繁育时间。前期以1/2 MS为基本培养基,同时添加BA 0.5 mg·L-1与NAA 0.5 mg·L-1组合培养,增殖系数最大,达8.47;当培养30 d后,转移到无植物生长调节剂的培养基中30 d,促进侧芽伸长生长;60 d后生长茂盛(图2)。此时,每株苗又可以切割3~5个茎段作为新的外植体,因此理论上月增殖最高可达11.293倍。以2500瓶组培苗母瓶为例,每瓶苗有10株,每年可增殖:2500×11.293×12=338790株。

表5 不同培养基对三叶青生长的影响
2.6 三叶青组培苗叶绿素荧光特性分析

图2 三叶青试管苗大量繁殖
叶绿素荧光诱导曲线是荧光随时间变化的曲线,荧光是在植物暗适应后突然曝光发出的。典型的叶绿素荧光诱导动力学曲线有O、J、I、P 4个点,O—P的变化通过不同参数反映了光系统Ⅱ的原初光化学反应以及光合作用元件的结构和状态等变化。叶绿素荧光产量上升出现K点,说明光系统Ⅱ异常。O点为荧光最小值对应的时刻,K点为300 μs,J点为2 ms,I点为30 ms,P点为荧光最大值对应的时刻[16]。如图3所示,不同类型三叶青的叶片叶绿素荧光动力学曲线差异不大。将K、J、I、P进行比较,具体为:K点荧光强度大小为翌年生>当年生,扦插≈组培,遮荫>不遮荫;J点荧光强度大小为翌年生>当年生,扦插>组培,遮荫>不遮荫;I点荧光强度大小为当年生>翌年生,组培>扦插,不遮荫>遮荫;P点荧光强度大小差异不明显。由图4可知,将荧光数据标准化以后,以当年生(A)为参考,不同类型的三叶青叶绿素荧光诱导曲线有明显差异。
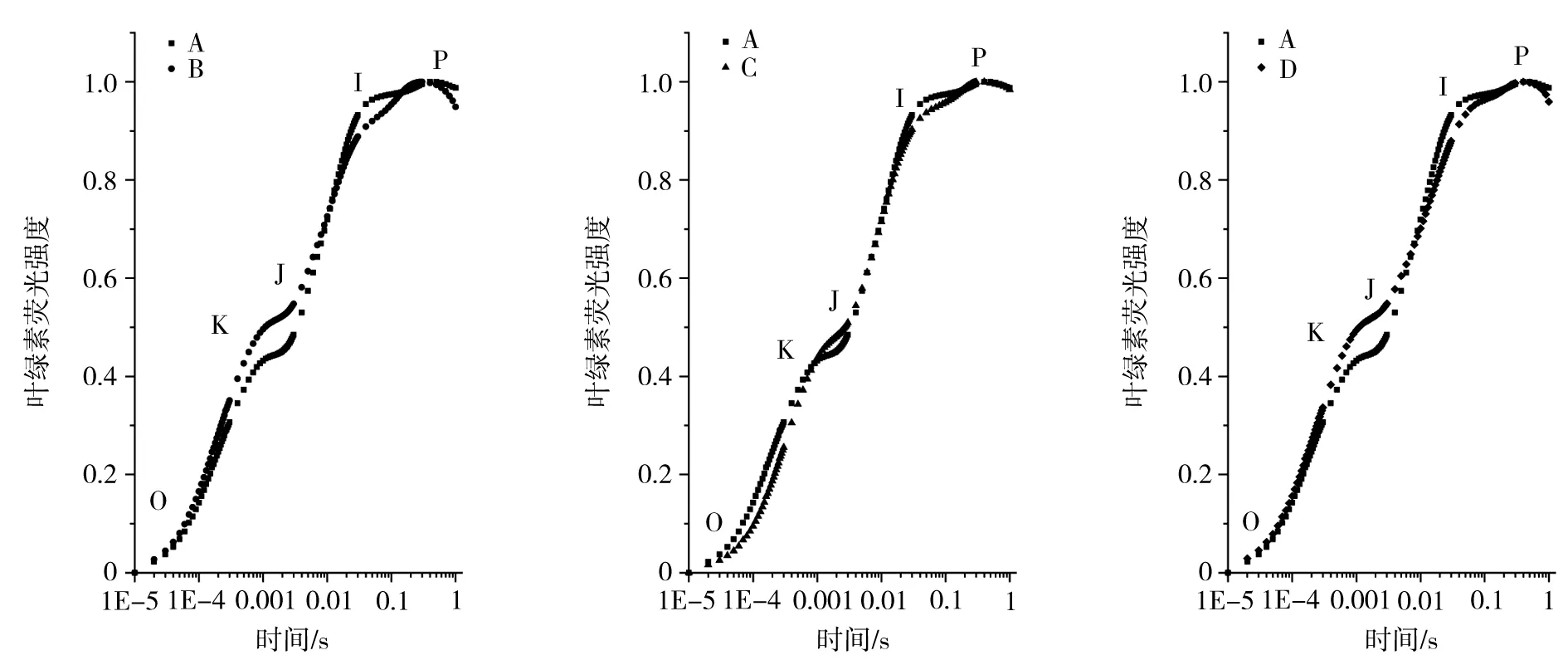
A为当年生苗;B为翌年生苗;C为扦插苗;D为遮荫苗;下同。图3 不同类型三叶青叶片叶绿素荧光诱导动力学曲线

图4 不同类型三叶青叶片光系统Ⅱ相对可变荧光强度差值
经过叶绿素荧光诱导曲线的JIP-test分析,WK和Vj分别代表光系统Ⅱ电子供体和受体侧的性能[17]。由图5可知,在WK方面,当年生苗、翌年生苗、遮荫苗三者间无显著差异,但均显著高于扦插苗,扦插苗WK值比当年生苗WK值低23.2%。由图6可知,翌年生苗、扦插苗、遮荫苗的Vj值都高于当年生苗,但三者间的差异未达到显著水平,其中遮荫苗显著高于当年生苗,高出18.1%。
2.7 光系统I(PSI)性能分析
光系统Ⅰ核心元件P700的氧化态P700+可以吸收820 nm波长的光,因此820 nm光吸收的变化可以反映P700的氧化还原状态。由图7可知,不同类型三叶青叶片820 nm相对光吸收曲线差异较大,820 nm光吸收量表现为A>B>D>C。ΔI/I0反映PSI的最大氧化还原能力[18],表示PSI的活性。由图8可知,最大氧化还原能力的强弱表现为C>D>B>A,4种三叶青苗的PSI活性间存在差异。以当年生组培苗(A)为对照,450 d组培苗(B)、扦插苗(C)、遮荫组培苗(D)PSI活性均逐渐增加,表明电子传递能力逐渐增强。因此,苗龄和光照会影响光系统性能,驯化出苗需要在90 d以上,最好提前遮荫处理。

不同小写字母为差异显著,下同。图5 叶绿素可变荧光FK占F0-Fj振幅的比例 图6 叶绿素可变荧光Fj占FM-F0振幅的比例
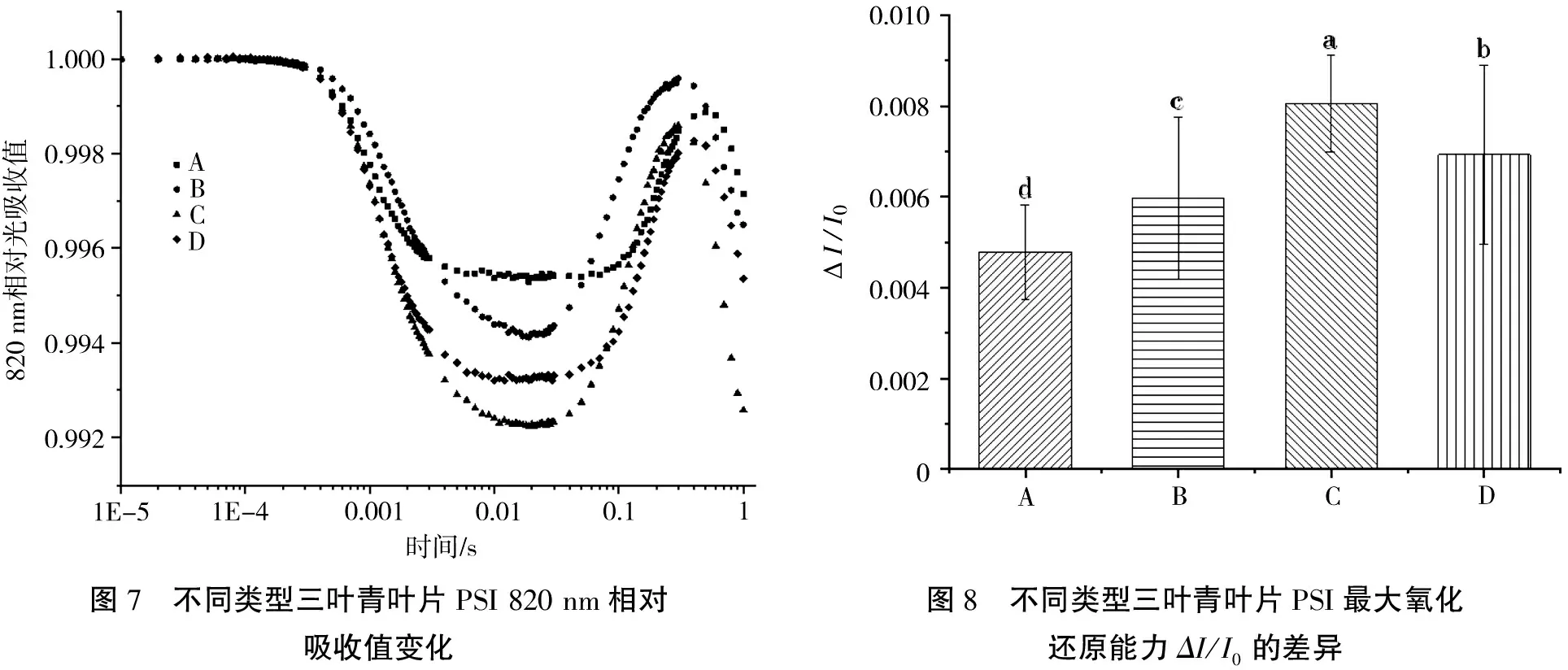
图7 不同类型三叶青叶片PSI 820 nm相对吸收值变化图8 不同类型三叶青叶片PSI最大氧化还原能力ΔI/I0的差异
3 讨论
3.1 低浓度的BA有利于试管苗生长,高浓度的BA有利于侧芽增殖
三叶青是中国特有的珍稀药用植物,在小儿发烧和抗肿瘤方面越来越多的应用,也吸引了越来越多的学者们对三叶青的生物学特性与繁育技术的研究。组织培养育苗可以在短期内获得大量整齐一致、生长健壮的三叶青无性系种苗,不仅可以为生产提供栽培种苗,还能为进一步科学研究提供理想的科研材料。本研究以盆栽苗茎段为外植体,建立了简便、高效组织培养繁育技术体系。钟毓倩[19]利用茎尖、带腋芽的茎段和叶片作为外植体,发现以茎尖为外植体,最佳诱导不定芽和生根培养基各不相同。而本研究中添加0.5 mg·L-1BA与NAA组合表现出较高的芽增殖系数,同时也能够生根,茎伸长生长较好,叶片较大而呈浓绿色,且无菌苗质量及生根效果都很好,这样大大节约了生产时间和成本。高浓度BA的植物生长调节剂容易诱导愈伤组织并分化苗细弱、黄化芽苗,而低浓度的BA和NAA组合可能是通过调节内外源植物生长调节剂的平衡,对三叶青组培苗增殖和健壮成长有促进效应。
3.2 试管苗与扦插苗光合系统特性存在差异
组培苗移栽后生长良好,在遮阴条件下叶片浓绿茂盛。用快速叶绿素荧光技术,可以方便、快速和无损伤的分析叶片PSII的功能的变化,包括反应中心、电子供体和受体侧的变化[20],而利用820 nm吸收可以分析PSI活性,以此来鉴定组培苗移栽后的生长能力。本研究中组培苗不同叶片K点出现和荧光强度的差异,表明PSII供体侧放养复合体损伤或者QA之前受体侧部分被抑制、相当于逆境胁迫,表明组培苗的PSII吸收能量强,叶片颜色也表现为组培苗深绿色、扦插苗黄绿色。三叶青为典型的阴生植物且遮阴70%时植株长势最佳,随着光照强度的减弱,三叶青生物量呈现先增高后降低的趋势[21-22]。根据最大氧化还原能力分析,组培苗移栽后苗龄过低也影响光系统的活性,扦插苗光合能力大于组培苗,但是组培苗移栽后光保护能力和抗逆能力都优于扦插苗;当移栽1年后光合能力大大增加,另外当年生苗遮阴后减少光系统损伤,光合能力与扦插苗无差异。
4 结论
综上所述,三叶青通过以带节茎段为外植体,在“1/2 MS+BA 0.5 mg·L-1+NAA 0.5 mg·L-1+蔗糖30 g·L-1+水晶洋菜3 g·L-1、pH 5.8”培养基上诱导不定芽再生,培养4周后根和芽同时生长良好,大大节约了培养时间,简单高效;遮荫后的当年生组培苗光合能力与翌年生组培苗相近,因此,建议林下栽培来源于组培苗的三叶青种苗,有利于提高生产效率,解决种苗短缺的问题。

