“探究:土壤微生物对淀粉的分解作用”实验的改进
张 妍 于 鹏王婧婧
(西北师范大学生命科学学院 甘肃兰州 730070)
1 实验改进设计分析
李志超等通过实验,得出在“土壤微生物对淀粉的分解作用”这一实验中在土壤pH为中性、淀粉糊、30℃等条件下,实验效果最好。所以,笔者选取了质量分数为4%的淀粉糊浓度,在约30℃进行实验。土壤浸出液(pH为中性)选取了甘肃省兰州市某花园处中层土(-5 cm以下)制作,探究土壤微生物对其分解作用(实验一)。
有研究表明,随着土层深度的增加,土壤含水量、有机质、全氮、碱解氮、有效磷和速效钾均显著降低,微生物生长需要营养物质,而营养物质主要是含有碳、氮的各种有机物质,在表层土壤中含量丰富,所以微生物主要分布在富含有机质的土壤表层。土壤细菌、真菌、放线菌及微生物总数含量均随着土层深度增加而显著降低。即可认为土层的选取对于土壤微生物的数量有很大影响,并且根系处是土壤和植物进行物质交换的重要区域,微生物和酶活性在根系土壤中十分活跃。所以,选取花园花草根系处表层土壤(-5 cm~0 cm),探究其与中层土(-5 cm以下)对比,对土壤微生物分解作用的影响(实验二)。
对土壤微生物研究中,有学者对采集回来的土壤放置培养皿中加水培养1~2 d,土壤中细菌、真菌、线虫等微生物都会慢慢浮于水中,并在水中繁殖,可使溶于水中微生物数量增多,分解能力更强。比起将土壤包在纱布里,用水浸润一段时间,即取用土壤浸出液进行实验,直接将土壤放水中培养一到两天,再取用土壤浸出液,水中溶解的微生物更多。所以,以培养土的培养天数为实验对象,探究该种处理方式对土壤微生物分解作用的影响(实验三)。
综上所述,“土壤微生物对淀粉的分解作用”的改进实验可以划分为2个对照实验,分别是:(1)探究表层与中层土壤浸出液对淀粉糊的分解能力;(2)探究培养土与未培养土对淀粉糊的分解能力。
2 实验设计
2.1 实验器材
实验器具:烧杯(250 mL、500 mL、100 mL)、离心管(4 mL)、移液枪(1 000 μL)、移液枪枪头(1 000 μL)、玻璃棒、纱布、灭菌锅、一次性滴管、显微镜、载玻片、盖玻片、培养皿(直径6~7 cm)、水浴锅。
实验材料:土壤、生淀粉、马铃薯块、斐林试剂、碘液、无菌水。
2.2 实验步骤
2.2.1 土壤微生物(中层土)对淀粉糊的分解作用
(1)土壤浸出液的制备:将取自花园中层处的土壤,称取20 g,分成两份。每份称取10 g,分别放入里面垫有厚纱布的a、b烧杯中,各加200 mL无菌水搅拌,浸润0.5 h,然后将纱布连同土壤一起取出。将留在a烧杯中的土壤浸出液静置一段时间备用。b烧杯的土壤浸出液放入灭菌锅中,灭菌30 min。
(2)淀粉糊的制作:称取20 g的淀粉,溶于500 mL的开水中,充分搅拌,制成糊状,得到质量分数为4%的淀粉糊,静置备用。
(3)灭菌:将b烧杯中的土壤浸出液、淀粉糊、实验所用的烧杯、离心管、移液枪枪头、玻璃棒、纱布、一次性滴管等器皿放入灭菌锅中灭菌。
(4)加样培养:另取两只烧杯(A、B),放入2份10 mL淀粉糊。在A烧杯中加入30 mL未灭菌的土壤浸出液;B烧杯中加入30 mL灭菌后的土壤浸出液。将淀粉与土壤浸出液充分搅拌,烧杯盖上纱布,并将A、B烧杯在室温(25℃左右)下放置7 d。
(5)显色反应:实验材料配成后,在A烧杯中取2份1 mL溶液,放入两个离心管中,分别编号A1、A2。在B烧杯中取2份1 mL溶液,放入2个离心管中,分别编号B1、B2。接着在A1、B1中加入2~3滴碘液。在A2、B2中加入2~3滴斐林试剂(A液:B液为2:1)60℃水浴,2 min。记录实验现象。之后,每天继续重复以上显色反应,观察实验变化,并记录实验结果。本实验组在以下研究报告中称作中层土淀粉组。
2.2.2 土壤微生物(表层土)对淀粉糊的分解作用
(1)土壤浸出液的制备:将取自花园表层处的土壤,称取20 g,分成两份。每份称取10 g,分别放入里面垫有厚纱布的a、b烧杯中,加200 mL无菌水搅拌,浸润0.5 h。然后,将纱布连同土壤一起取出。将留在a烧杯中的土壤浸出液静置一段时间备用。b烧杯的土壤浸出液放入灭菌锅中灭菌30 min。
(2)制作淀粉糊、灭菌、加样培养与显色反应同2.2.1。本实验组在以下研究报告中称作表层土淀粉组。
2.2.3 培养土微生物对淀粉糊的分解作用
(1)土壤微生物溶液的培养:将取自花园花草根系表层处的土壤,称取20 g。放入培养皿中,加入约200 mL已放置2或3d的自来水(除去或减少自来水中的有害气体),混匀制成土壤微生物培养溶液,平均分成3份,放置培养皿培养。标注分别为m0、m1、m2,0、1、2表示土壤微生物放置培养皿中的培养天数。按标注的天数来培养土壤微生物。静置出现澄清上清液时备用。
(2)淀粉糊的制作:称取10 g的淀粉,溶于250 mL的开水中,充分搅拌,制成糊状,得到质量分数为4%的淀粉糊,静置备用。
(3)灭菌:淀粉糊、实验所用的烧杯、离心管、移液枪枪头、玻璃棒、纱布、一次性滴管等器皿放入灭菌锅中灭菌。
(4)加样培养:取用m0(土壤微生物放置培养皿0天)中的土壤上清液,取10支4 mL离心管,10支离心管都标上当天的日期,各加入1 mL淀粉糊和1 mL土壤上清液,其中5支为A组,5支离心管分别标注加入碘液的日期。每天用碘液测一次淀粉含量的变化,即可推算土壤培养液与淀粉混合培养天数。另5支为B组,B组分别标注加入斐林试剂的日期,每天用斐林试剂测一次还原糖含量的变化,即可推算土壤培养液与淀粉混合培养天数,将已取过土壤上清液的培养皿m0丢弃。连续4 d如此进行。
(5)显色反应:按培养时间推算,每天取日期相同的A离心管和B离心管,A离心管分别用一次性滴管加入3滴碘液,B离心管分别用移液枪加入1 mL斐林试剂(A液∶B液为2∶1)。将加入斐林试剂的B管放入60℃的水浴锅中2 min,观察B离心管是否出现砖红色沉淀,观察A管颜色变化。以后,每天重复上述工作,直至离心管加色反应完。本实验组在以下研究报告中称作培养表层土淀粉组。
3 实验结果
3.1 土壤微生物对淀粉的分解作用
土壤微生物对土豆淀粉的分解作用结果见表1。
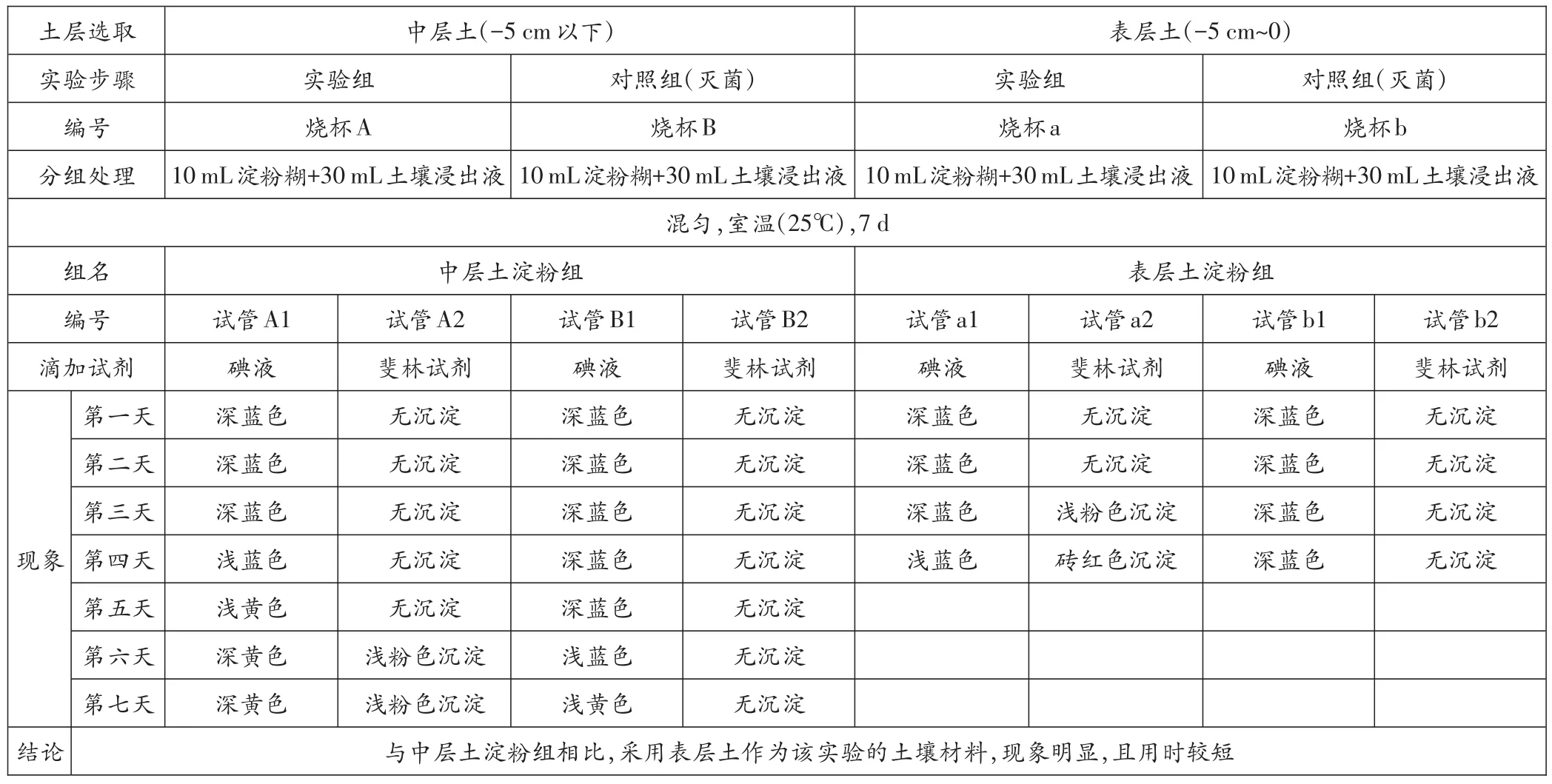
表1 中层土与表层土微生物对淀粉糊的分解作用对比
中层土淀粉组:结果显示,培养3 d天后,A1(土壤未灭菌,加碘液)呈深蓝色,说明淀粉分解量较少;B1(土壤灭菌,加碘液)呈深蓝色,说明淀粉分解量较少;A2(土壤未灭菌,加斐林试剂)未有砖红色沉淀,说明还原糖量较少;B2(土壤灭菌,加斐林试剂)未有砖红色沉淀,说明还原糖量较少。培养5 d后,鉴定结果与3 d无异。培养7 d后,A1(土壤未灭菌,加碘液显色)呈深黄色,说明淀粉已大量分解;B1(土壤灭菌,加碘液)蓝色稍变浅,说明淀粉分解较少;A2(土壤未灭菌,加斐林试剂)有较不明显的砖红色沉淀,说明还原糖量较少;B2(土壤灭菌,加斐林试剂)颜色无明显变化,说明还原糖量较少。A、B组现象对比不明显。结果表明,取用中层土(-5 cm以下),做淀粉分解实验历时较长,且现象不明显。
表层土淀粉组:实验结果显示,培养前3d,A、B组对比不明显。培养4 d后,A1(土壤未灭菌,加碘液)浅蓝色,说明存在大量微生物分解淀粉;B1(土壤灭菌,加碘液)呈深蓝色,说明无大量微生物分解淀粉;A2(土壤未灭菌,加斐林试剂)呈较深的砖红色沉淀,说明存在大量还原糖;B2(土壤灭菌,加斐林试剂)无砖红色沉淀,说明还原糖较少。A、B组对比现象明显,说明未灭菌的表层土中存在大量分解淀粉的微生物。实验结果表明,与中层土淀粉组相比,采用表层土作为该实验的土壤材料,现象明显,且用时较短。
3.2 培养土壤微生物对土豆淀粉的分解作用
培养土壤微生物对土豆淀粉的分解作用见表2。

表2 探究土壤微生物培养天数对分解淀粉的作用
培养表层土淀粉组:土壤培养1 d,土壤与淀粉混合0~4 d,加碘液,有明显蓝色变浅的梯度变化现象;土壤培养1 d,土壤与淀粉混合0~4 d,加斐林试剂,随着混合天数的增加,砖红色沉淀越来越明显。土壤液培养1 d,淀粉与土壤混合3 d,加斐林试剂,呈明显的砖红色沉淀,说明淀粉已大量分解,产生较多还原糖。
以上结果说明,表层土壤微生物培养1 d后,且与淀粉混合培养3 d,淀粉分解现象最明显,加碘蓝色变浅,加菲林试剂砖红色沉淀明显。且该实验与表层土淀粉组需4 d有实验现象对比,用时更短,且现象更明显。
4 结论
以上实验结果表明,制作土壤浸出液选用花园花草根系处的表层土(-5 cm~0)比中层土(-5 cm以下)实验现象较明显,且只需4 d即可观察到现象;将表层土加水浸湿培养1 d,再与淀粉糊等体积混合培养3 d,实验现象更明显,用时更短。
5 讨论
本实验在参照课本实验的基础上,又在土层选取以及土壤培养方面进行创新设计,取得了理想的结果,事实证明由此实验可衍生出多种实验设计,所以该实验有利于培养学生的科学素养,发散学生的创新思维。
因为条件限制,本实验只在室温下培养,未在无菌环境中,有可能空气中的微生物会影响实验,但是,从对照组与实验组的现象对比来看,差异显著,所以空气中的微生物分解淀粉可忽略。

