JAK-STAT信号通路JAK2、STAT3和SOCS1基因在鸭肠炎病毒感染中各组织的表达变化
张 飘,龙立书,洪 猛*,华 敏,杨 霞,曾茂芹,刘妍罕,张扬子,杨 颖,5,温贵兰,5,程振涛,5,李 涛,文 明,5*
(贵州大学 动物科学学院,贵州 贵阳 550025;2.铜仁市动物疫病预防控制中心,贵州 铜仁 554300;3.黔东南州农业科学院,贵州 凯里,556000;4.贵州省畜牧兽医研究所,贵州 贵阳 550005;5.贵州省动物生物制品工程技术研究中心,贵州 贵阳 550025;6.贵州省动物疫病预防控制中心,贵州 贵阳 550025)
Janus 蛋白酪氨酸激酶(Janus activated kinase,JAK)-信号传导及转录激活因子(signal transductionand activators of transcription,STAT)信号途径是DARNELL等[1]于1994年开展干扰素诱导细胞内信号传导研究时发现的;该信号通路可被多种配体激活,参与细胞增殖、分化、存活和凋亡,可引起机体免疫失调、肿瘤生成和炎症反应等过程[2]。当JAK通过受体二聚化或多聚化被激活后,引发STAT上特异性酪氨酸残基磷酸化,导致STAT 蛋白构象改变并转移到细胞核,与特定 DNA靶序列结合(如干扰素激活序列或干扰素激活反应元件位点),从而调控细胞核数千个基因的转录[3-4]。研究发现,单纯疱疹病毒(HSV)感染后,通过SOCS蛋白抑制JAK-STAT通路信号传导,降低机体产生抗病毒因子以促进病毒增殖[5];羊疱疹病毒(GTPV)感染后,激活机体细胞STAT3和SOCS1,抑制机体免疫应答反应,促进病毒复制[6];牛疱疹病毒(BoHV-5)感染后,通过外壳蛋白UL41通过结合AREs区和STAT1 mRNA,阻断JAK-STAT通路信号传导,促进病毒增殖[7-8]。这些结果说明,JAK-STAT信号通路在疱疹病毒感染过程中发挥重要的作用,但同属疱疹病毒科的鸭肠炎病毒(duck enteritis viral,DEV)与JAK-STAT信号途径存在何种关系,目前尚未见到有关文献报道。为此,本试验在前期研究的基础上,开展DEV感染对鸭机体组织JAK-STAT信号途径关键分子表达的影响,以期为阐明JAK-STAT信号通路对DEV感染过程的影响机制奠定基础。
1 材料与方法
1.1 雏鸭和毒株30日龄健康雏鸭100只,购自贵州省三穗县鸭场,经DEV核酸PCR和抗体ELISA检测均为阴性;鸭肠炎病毒DEV-GZ株,由贵州省动物生物制品工程技术研究中心提供。
1.2 主要试剂和仪器TRIzol RNA分离试剂、反转录试剂盒、SYBR Premix Ex TaqⅡ(Tli RNase H Plus),购自宝生物工程(大连)有限公司;JAK2、STAT3和SOCS1蛋白ELISA检测试剂盒,购自上海抚生生物有限公司;细胞膜蛋白与细胞浆蛋白提取试剂盒、SDS-PAGE凝胶配制试剂盒、PVDF膜(0.2 μm)、JAK2兔单克隆抗体、辣根过氧化物标记山羊抗兔抗体等,购自上海碧云天生物技术有限公司。
1.3 JAK2、STAT3和SOCS1基因荧光定量引物的合成根据本实验室前期开展的鸭源JAK2、STAT3和SOCS1基因克隆结果[9]和建立相应的实时荧光定量PCR方法。鸭源JAK2、STAT3和SOCS1基因实时荧光定量PCR引物详见表1。

表1 基因引物序列
1.4 DEV人工感染模型建立取雏鸭10只,随机分为2组,Ⅰ组(试验组)和Ⅱ组(对照组),5只/组,隔离饲养10日,Ⅰ组腿部肌肉接种DEV-GZ株病毒液0.2 mL(1 000LD50)/只,Ⅱ组接种无菌生理盐水0.2 mL,连续观察其临床症状并剖解观察病理变化和PCR检测病毒,验证感染模型成功与否。
1.5 DEV人工感染与鸭组织样本采集按照1.4感染模型的时间与方式,取雏鸭90只,Ⅰ组(45只)腿部肌肉接种DEV-GZ株病毒液,Ⅱ组(45只)接种无菌生理盐水,于接种后12,24,36,48,7,84,96 h时捕杀试验鸭,无菌采集组织样本(心脏、肝脏、脾脏、肺脏、肾脏、脑、胸腺、法氏囊、胸肌和十二指肠),每组每个时段各取6只(即6个重复),―80℃保存备用。
1.6 JAK2、STAT3和SOCS1基因表达量与蛋白含量检测
1.6.1感染鸭组织JAK2、STAT3和SOCS1基因检测 取1.5的组织样品,采用TRIzol法提取组织总RNA,按照PrimeScript RT Master Mix说明书步骤反转录成cDNA,以β-Actin基因为内参基因,采用JAK2、STAT3和SOCS1基因荧光定量PCR方法进行检测,反应体系为10 μL:SYBR premix Ex TagⅡ(Tli RNase H Plus)5.0 μL,F/R 0.5 μL,ddH2O 3.0 μL,cDNA 1.0 μL,每个样品3个重复。反应条件:95℃预变性30 s,95℃变性5 s,退火60℃ 30 s,39个循环。退火时采集荧光5 s,观察分析不同时段感染鸭JAK2、STAT3和SOCS1基因的转录水平。
1.6.2感染鸭组织JAK2、STAT3和SOCS1蛋白检测 取1.5的组织样品,研磨匀浆后按50 mg量加入PBS 1.0 mL,混匀,3 000 r/min离心30 min,收集上清,按照检测试剂盒说明书步骤测定上清JAK2、STAT3和SOCS1蛋白D450 nm值,代入按照标准品建立的标准曲线线性相关公式计算组织JAK2、STAT3和SOCS1蛋白表达水平。
1.7 感染鸭肠道组织JAK2、STAT3和SOCS1基因表达验证选取本实验室前期开展的DEV感染鸭十二指肠组织转录组测序结果[10]进行JAK2、STAT3和SOCS1基因mRNA转录水平的验证;取上述试验鸭十二指肠样本组织,采用细胞膜蛋白与细胞浆蛋白提取试剂盒提取组织总蛋白,SDS-PAGE凝胶电泳和Western blot,验证十二指肠组织JAK2蛋白表达水平。
2 结果
2.1 人工感染结果经DEV人工感染后,Ⅰ组鸭出现精神沉郁、呼吸急促、排白色或绿色稀粪等临床症状(图1A1,A2正常对照),剖解观察可见感染鸭有典型的肠道环状出血、脑膜充血出血、肾脏水肿出血等(图1B1、C1、D1;图1B2、C2、D2正常对照),以DEV NP基因对肝脏组织DNA提取样本进行PCR检测,可见特异性DNA条带(图1E1),而Ⅱ组鸭健康,剖解鸭内脏器官组织无明显病变,PCR检测为阴性(图1E2),说明本试验成功建立了DEV人工感染模型。
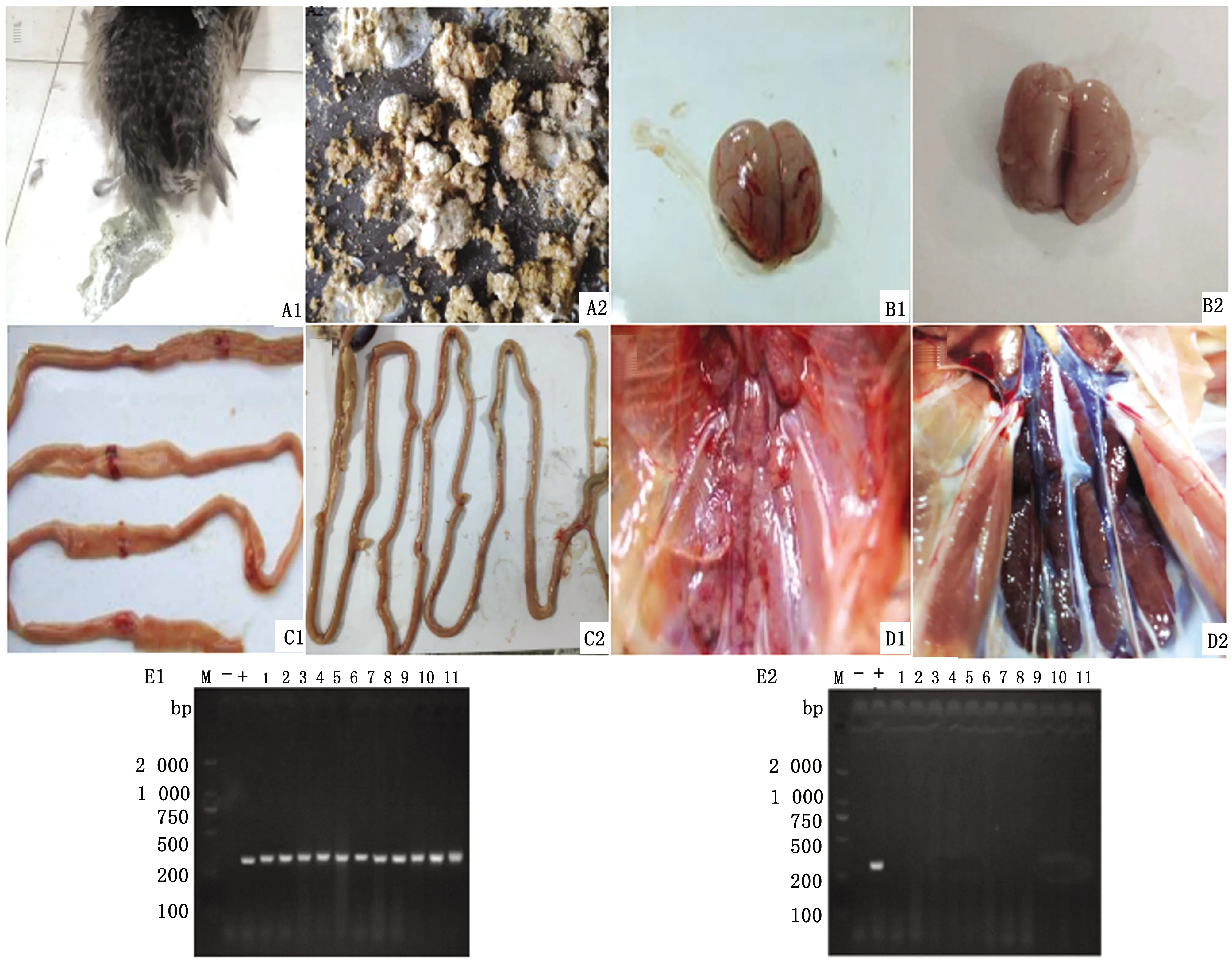
A1.绿色稀粪;A2.粪便正常对照;B1.肠组织环状出血带;B2.肠组织正常对照;C1.脑组织充血、出血;C2.脑组织正常对照;D1.肾脏组织肿大、出血;D2.肾组织正常对照;E1,E2.M.DL2000 DNA Maker,-为阴性对照,+为阳性对照,其余为抽样样品,1~11.抽样样品
2.2 DEV感染鸭组织JAK2、STAT3和SOCS1基因转录变化选取健康雏鸭,人工感染DEV,采集不同时间感染鸭组织样本,提取鸭组织器官总RNA,逆转录合成cDNA,以β-Actin为内参基因进行实时荧光定量PCR方法检测分析鸭机体组织器官JAK2、STAT3和SOCS1基因转录水平,结果显示DEV感染12~96 h时,JAK2基因在鸭心脏、脾脏、脑和肌肉中的转录水平总体呈现前期下调后期上调趋势,而在鸭肝脏、肺脏、肾脏、胸腺、十二指肠和法氏囊中的转录水平总体呈现前期上调后下调趋势(表2);STAT3基因在感染鸭心脏、肝脏、法氏囊和肌肉中的转录水平总体呈现前期下调后期上调趋势,而在感染鸭脾脏、肺脏、肾脏、脑组织、胸腺和十二指肠中的转录水平总体呈现前期上调后期下调趋势(表3);SOCS1基因在感染鸭心脏、肺脏、肾脏、脑组织、十二指肠、法氏囊和肌肉中的转录水平总体呈现上调趋势,在感染鸭肝脏和脑中的转录水平总体呈现前期上调后期下调趋势,而在感染鸭脾脏中的转录水平总体呈现前期下调后期上调趋势(表4)。结果表明,DEV感染对鸭机体组织器官JAK-STAT信号通路相关基因JAK2、STAT3和SOCS1基因的转录水平均有不同程度的影响。
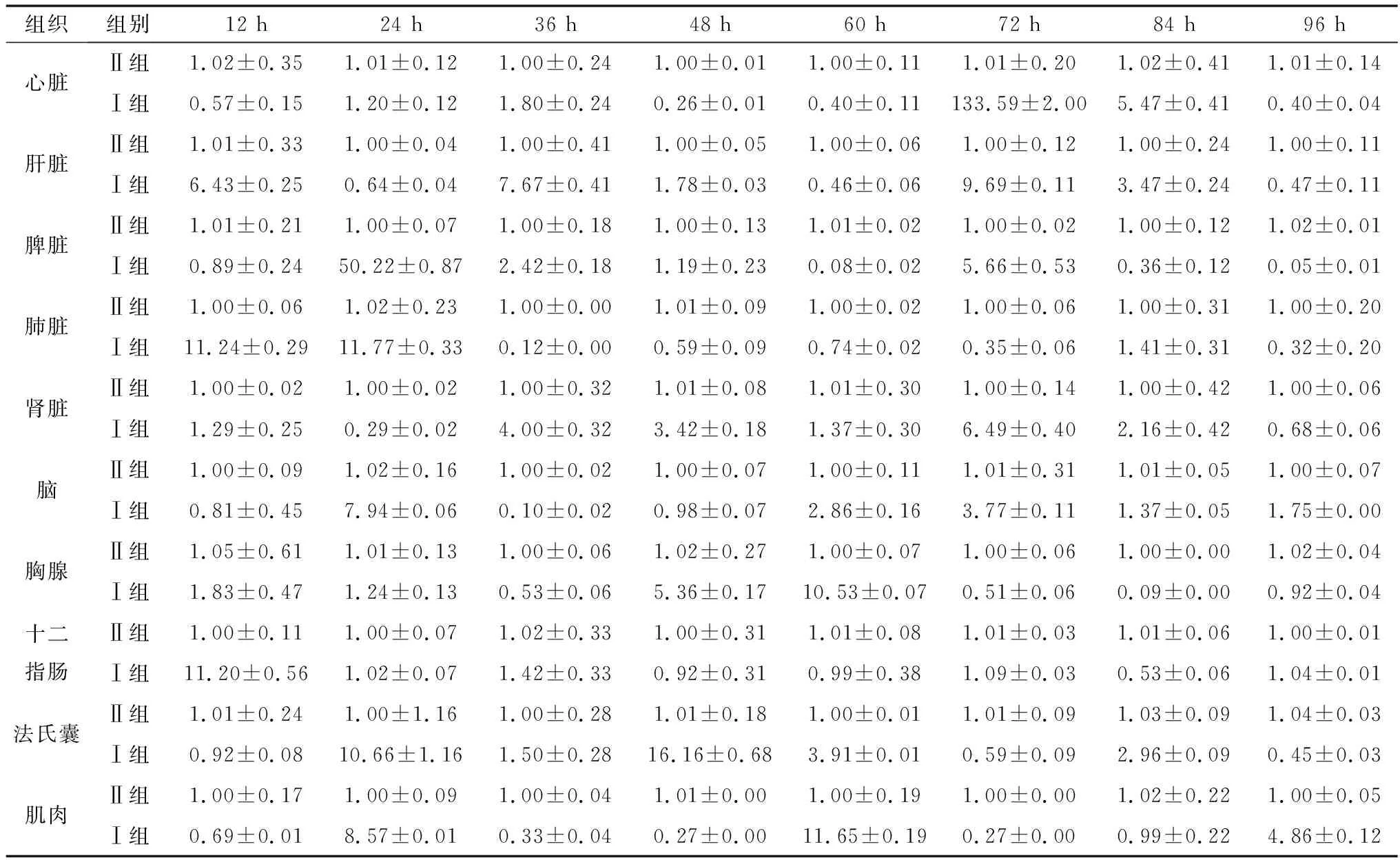
表2 未感染与DEV感染后不同时间各组织中JAK2基因的转录变化
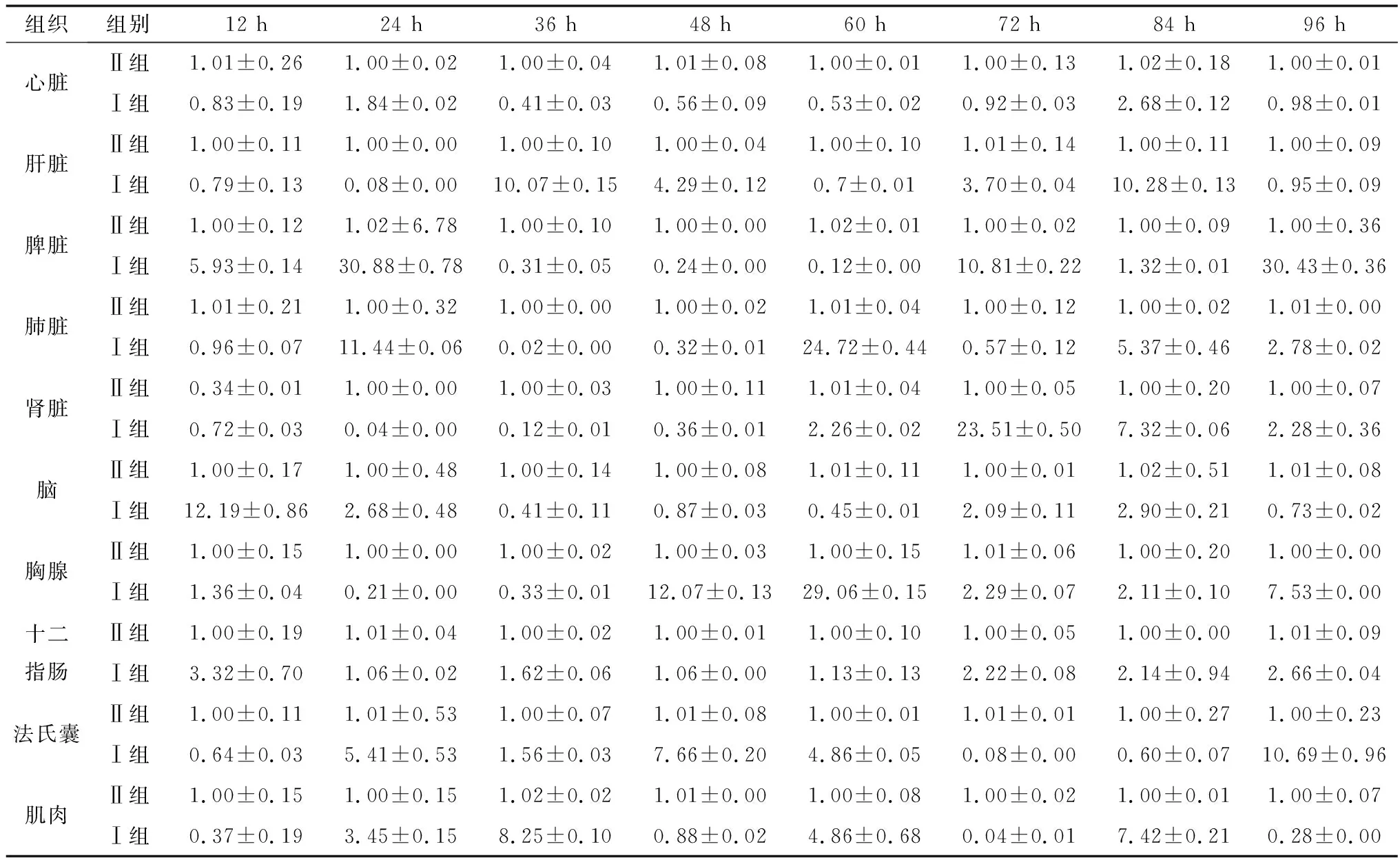
表3 未感染与DEV感染后不同时间各组织中STAT3基因的转录变化
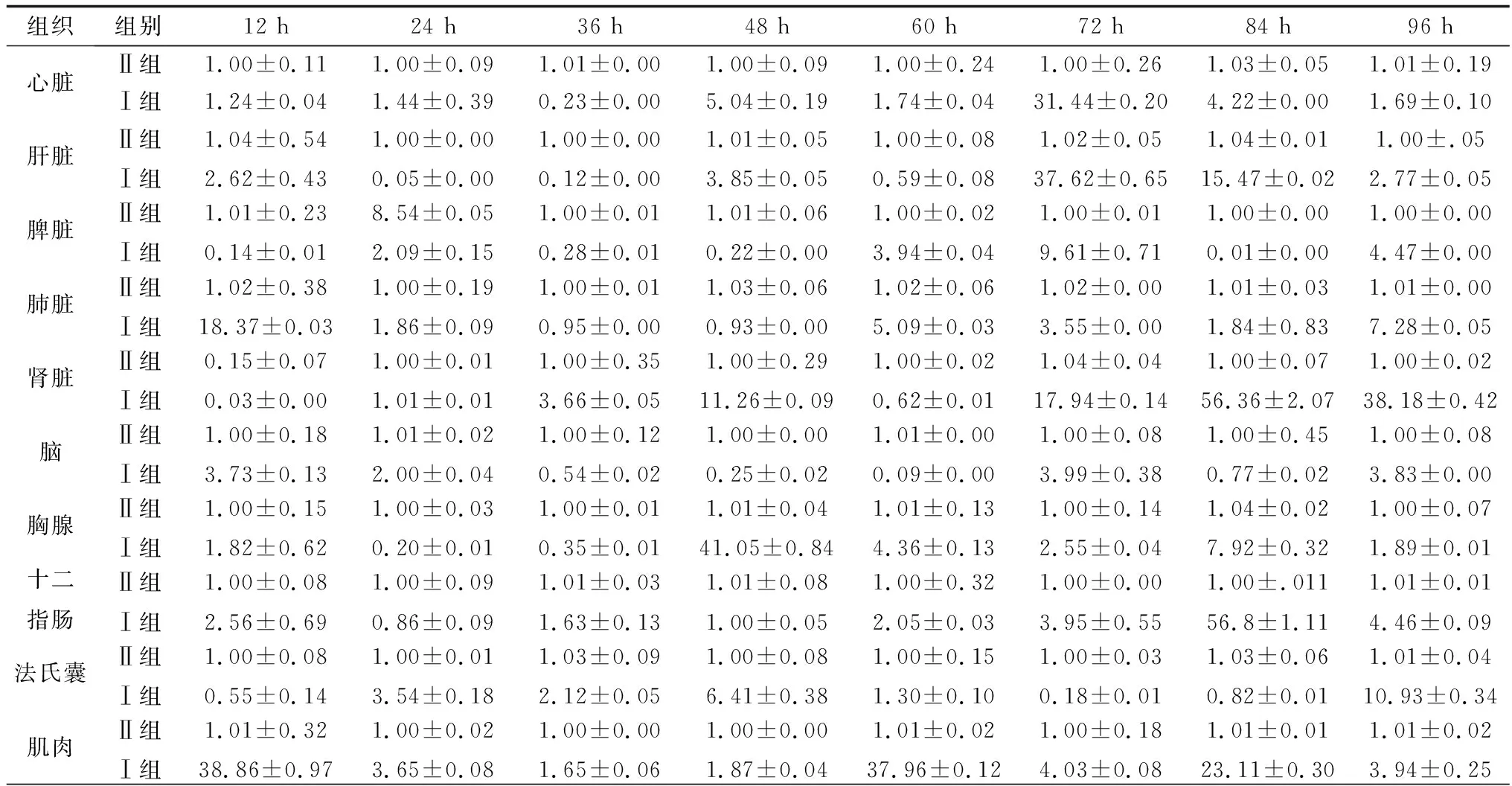
表4 未感染与DEV感染后不同时间各组织中SOCS1基因的转录变化
2.3 DEV感染鸭组织JAK2、STAT3和SOCS1蛋白表达变化采集如上人工感染DEV后不同时间的鸭组织器官样本,研磨匀浆离心取上清,采用相应ELISA检测试剂盒检测分析JAK2、STAT3和SOCS1蛋白的表达水平,结果显示DEV感染12~96 h,JAK2蛋白在感染鸭心脏、肝脏、脾脏、肾脏、肺脏、脑组织、胸腺、十二指肠、法氏囊和肌肉中的表达水平均低于Ⅱ组(表5);STAT3蛋白在感染鸭心脏、肝脏、脾脏、肾脏、肺脏、脑组织、胸腺、十二指肠、法氏囊和肌肉中的表达水平亦低于Ⅱ组(表6);而SOCS1蛋白在感染鸭心脏、肝脏、脾脏、肾脏、肺脏、脑组织、胸腺、十二指肠、法氏囊和肌肉中的表达水平高于Ⅱ组(表7)。结果表明,DEV感染可下调鸭机体组织器官JAK-STAT信号通路中JAK2蛋白和STAT3蛋白的表达水平,可上调SOCS1蛋白的表达水平。
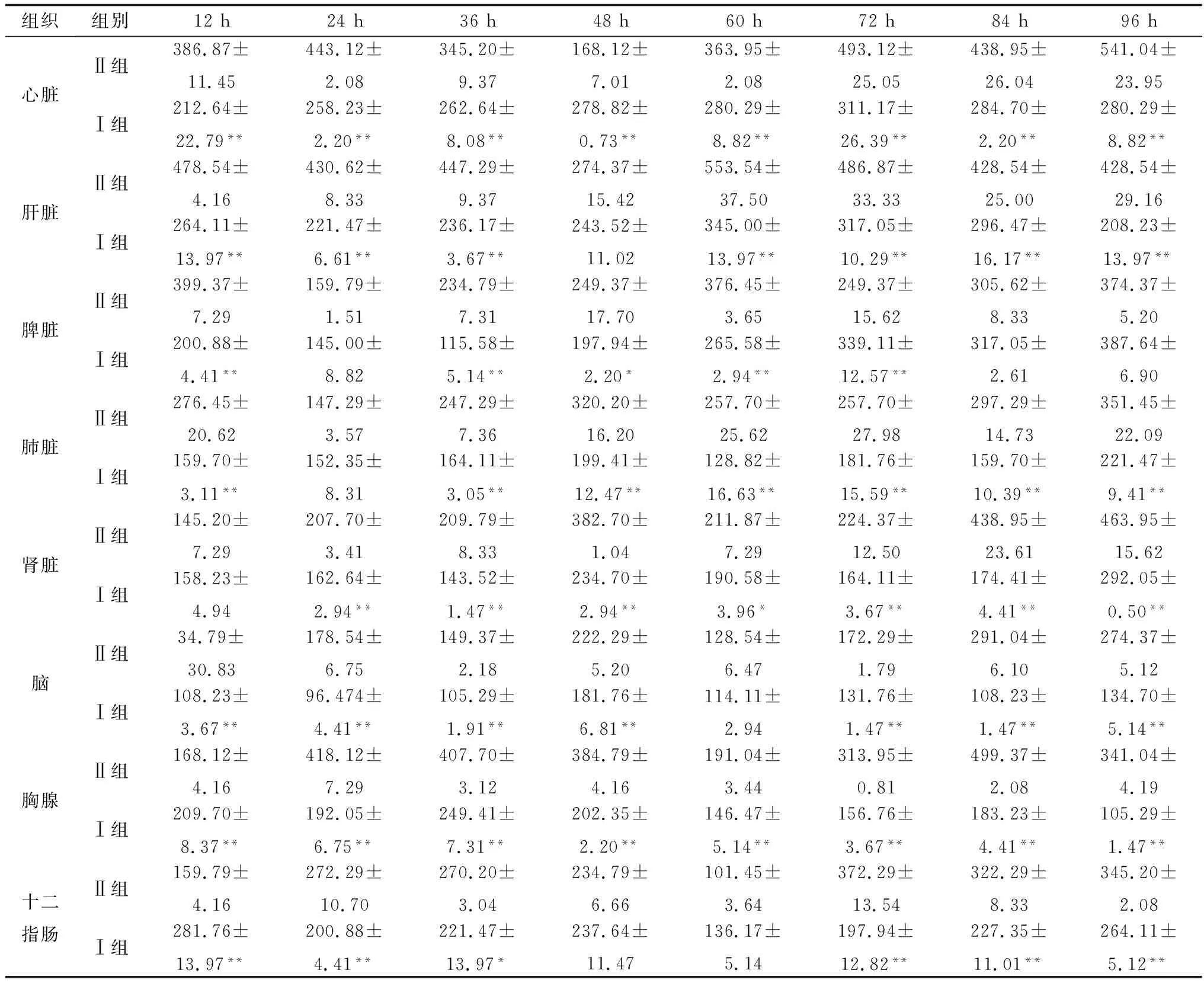
表5 未感染与DEV感染后不同时间不同组织中JAK2蛋白的表达变化
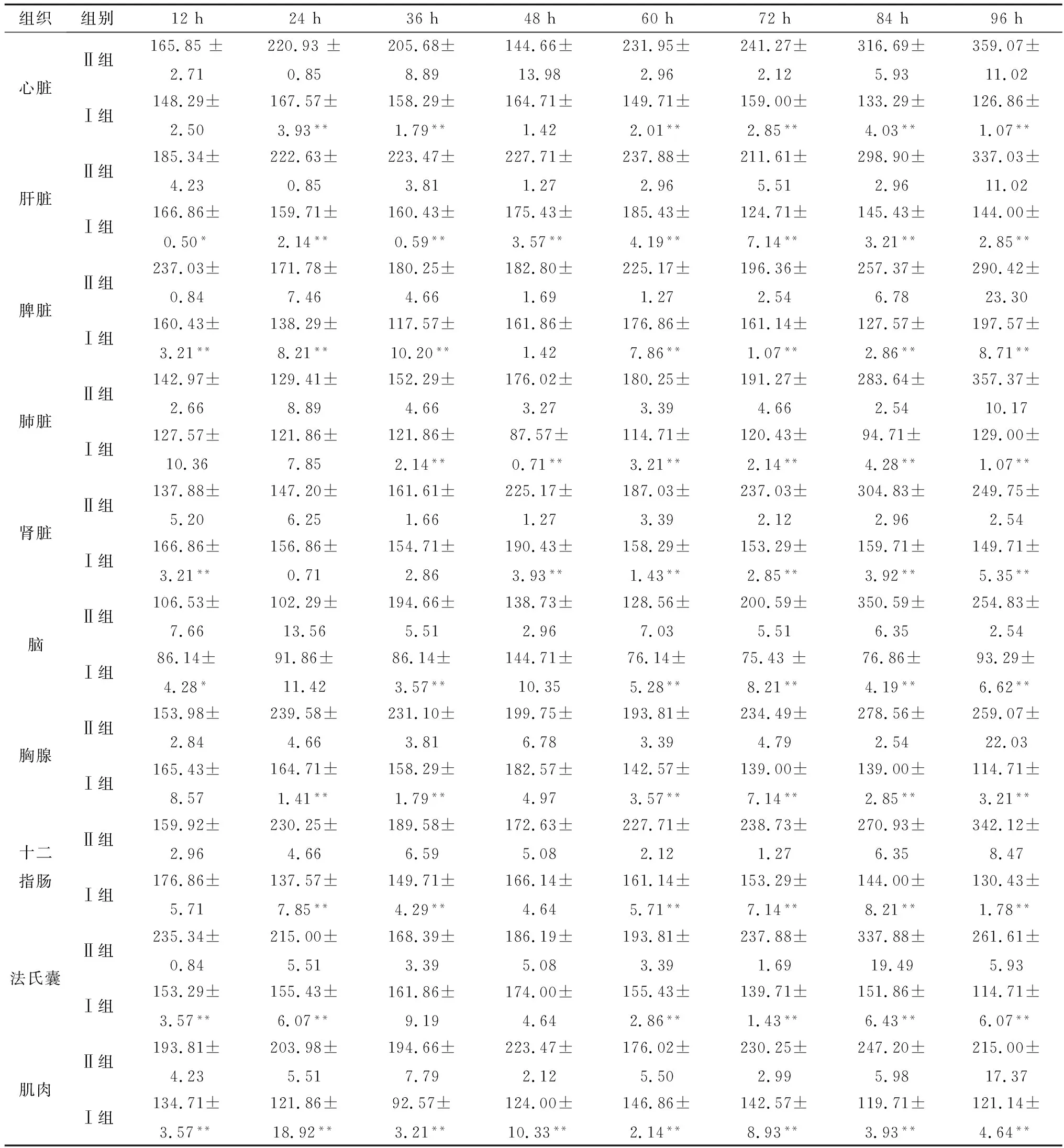
表6 未感染与DEV感染后不同时间不同组织中STAT3蛋白的表达变化
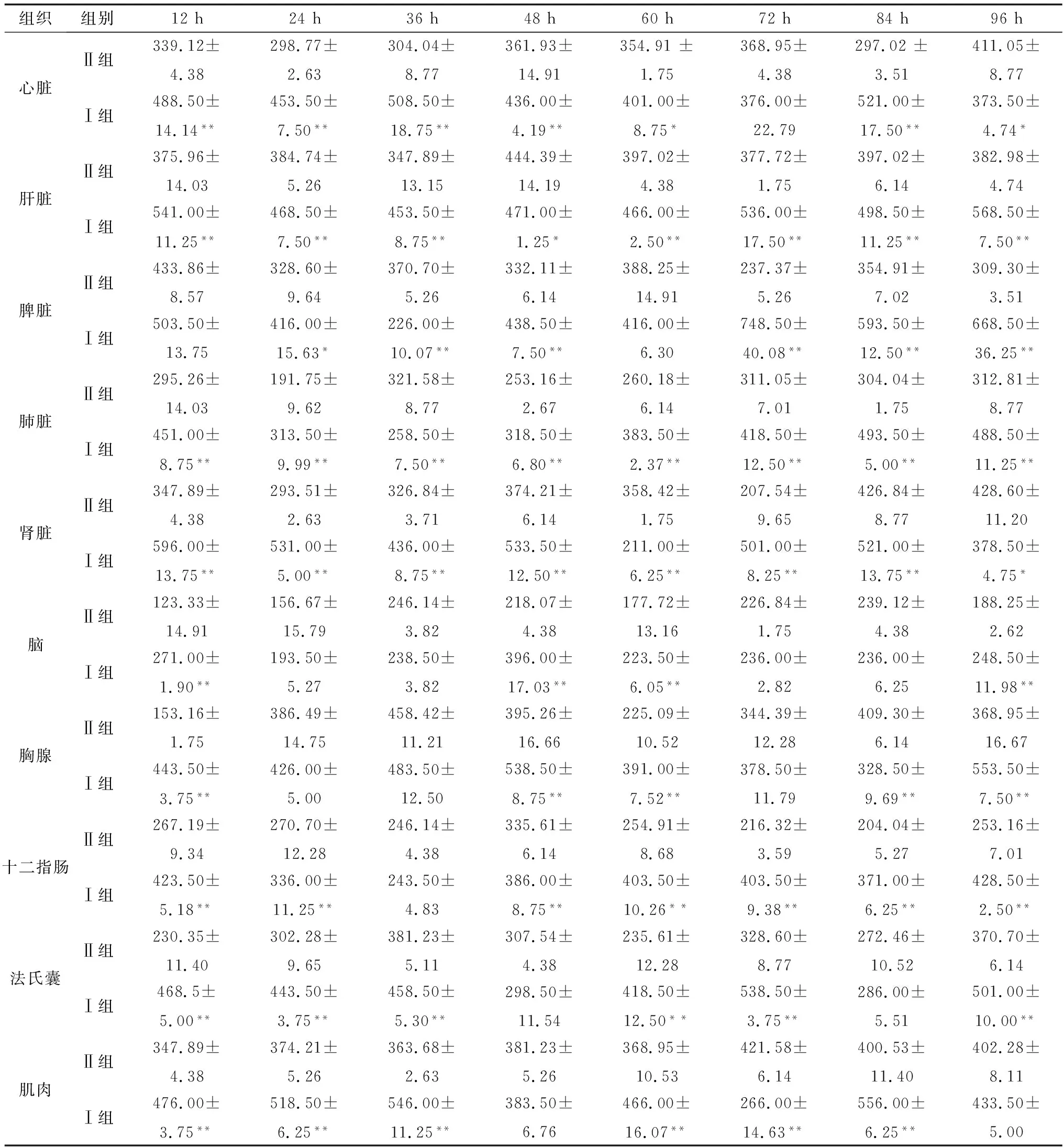
表7 未感染与DEV感染后不同时间不同组织中SOCS1蛋白的表达变化
2.4 JAK2、STAT3和SOCS1基因转录水平及蛋白表达变化验证经转录组测序分析显示,感染鸭十二指肠JAK-STAT信号通路被激活,DEV感染24 h时SOCS1基因转录水平下调,而JAK2和STAT3基因转录水平不变(图2);DEV感染48 h时SOCS1、JAK2和STAT3基因转录水平不变(图3);DEV感染72 h时SOCS1和STAT3基因转录水平上调,而JAK2基因转录水平不变(图4);DEV感染96 h时SOCS1和STAT3基因转录水平上调,而JAK2基因转录水平不变(图5)。经Western blot检测(图6)显示,感染鸭十二指肠JAK2蛋白在DEV感染24,48,72,96 h时表达水平与ELISA检测结果基本一致。
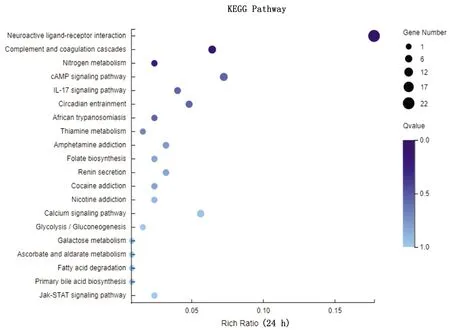
图2 24 h时十二指肠转录水平
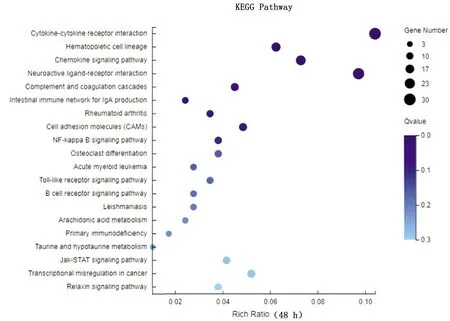
图3 48 h时十二指肠转录水平
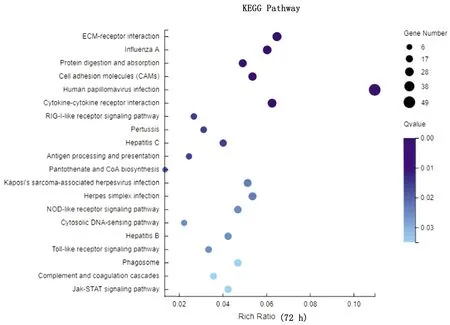
图4 72 h十二指肠转录水平
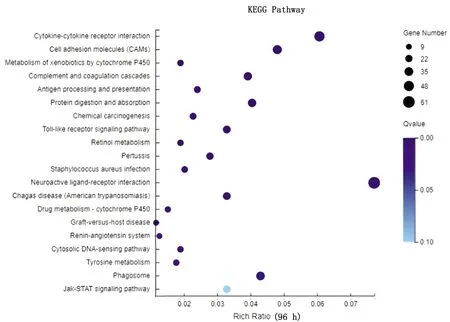
图5 96 h十二指肠转录水平
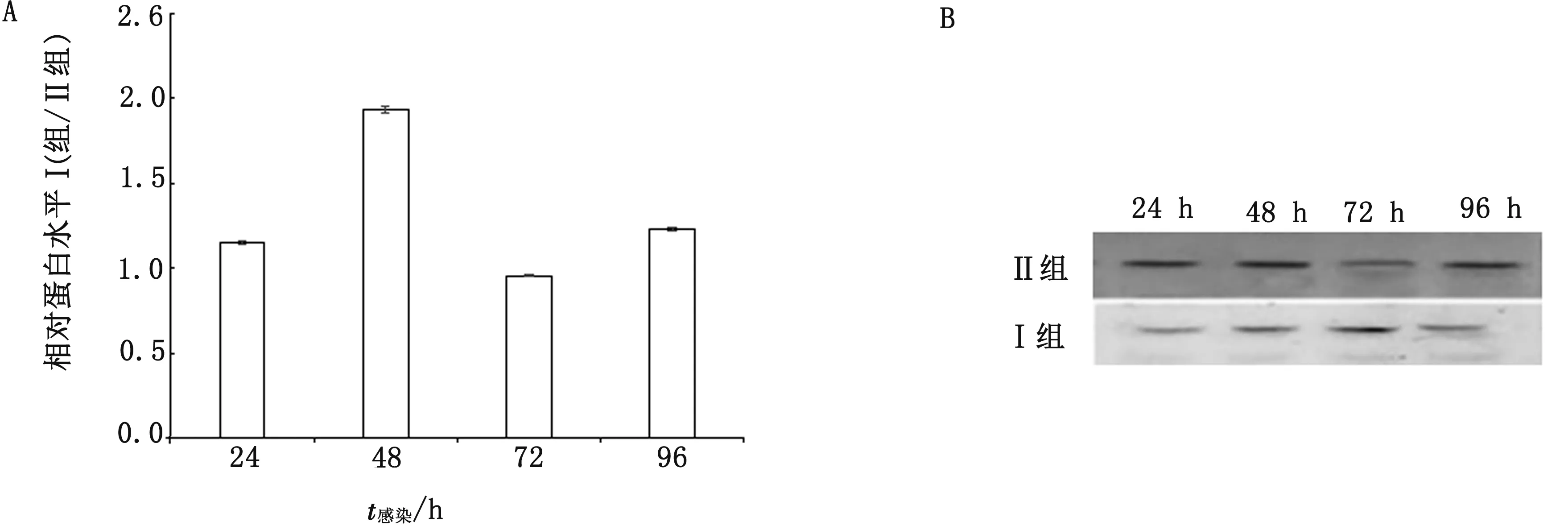
A.柱状图;B.印迹图
3 讨论
JAK-STAT信号通路是近年发现的一条由细胞因子刺激的信号转导通路,参与机体内多个化学信号传递过程,如细胞凋亡、增殖分化以及炎症发展等;该通路还能调节遗传物质转录表达,是细胞内蛋白质之间相互作用的主链[11],也是淋巴细胞发育的关键调节因子,维持T细胞活化和分化[12]。研究表明,在动物机体健康组织中JAK-STAT通路的信号传递受到良好的控制,可在细胞内不同水平上进行调节[13];当动物机体受到病毒感染时,SOCS蛋白被特异性诱导高表达,抑制JAK-STAT通路信号传导,从而促进病毒复制[14-15],如艾滋病病毒(HIV-1)、甲型流感病毒(IAV)、日本乙型脑炎病毒(JBV)和丙肝病毒(HCV)等;同时JAK-STAT信号通路在某些因子刺激下发挥抗病毒作用,如干扰素-α(IFN-α)激活JAK-STAT信号通路后,可抑制丙型肝炎病毒增殖[16]。但是,JAK-STAT信号通路被激活后也会带来一些不良反应,如:乙肝病毒(HBV)直接损伤肾组织机制可能与JAK-STAT信号通路被激活有关[17]、某些因子可通过JAK-STAT信号通路增强癌细胞增殖和侵袭能力[18]等。目前,国内有关鸭肠炎病毒(DEV)感染对鸭机体组织JAK-STAT信号通路的影响研究尚未见报道。因此,本研究开展DEV感染对鸭机体组织JAK-STAT信号途径关键分子表达的影响,以期为阐明JAK-STAT信号通路对DEV感染过程的影响机制奠定基础。
JAK-STAT信号通路进行信号转导,从而以简单而有效的方式激活细胞因子介导的细胞活化,其发出的信号在先天免疫反应和适应性免疫的起始和调节中起关键作用,而信号转导与STAT,可以在跨膜受体和细胞核之间的直接通信,这时候STAT既作为细胞质信号蛋白,又作为核转录因子,同时具有多种靶基因,而当细胞因子与细胞膜上其特异性受体结合时,细胞质受体相关JAK的激酶活性被激活,激活的JAK磷酸化细胞因子受体的胞质结构域中的酪氨酸残基以提供STAT的停靠位点,STAT通过SH2结构域结合细胞因子受体并且通过JAKs在酪氨酸残基上磷酸化,导致通过SH2磷酸盐相互作用形成同源或异源二聚体,二聚化的STAT随后从细胞质转移到细胞核中,在核中结合特定的DNA元件来调节细胞因子应答基因的表达[3-4]。同时,SOCS基因被诱导激活,从而抑制JAK-STAT信号传导,除此之外SOCS1还含有额外的激酶抑制区(KIR),来抑制JAKs的催化活性。本研究发现,感染DEV后,各组织中JAK2、STAT3和SOCS1基因的转录水平均有不同程度的变化,说明DEV感染有效激活了JAK-STAT信号通路中JAK2、STAT3和SOCS1基因转录,但在JAK2和STAT3基因转录后翻译却受到了抑制,这是否是SOCS基因激酶抑制区在发挥抑制作用,或者是SOCS1蛋白本身对JAK2和STAT3基因翻译具有抑制作用,都需要进一步的试验,但可以肯定的是SOCS1蛋白在JAK-STAT信号通路调控机制仍然为负调控。
研究发现,单纯疱疹病毒感染会导致细胞内JAK-STAT信号通路的磷酸化程度降低,这其中可能是通过抑制JAK-STAT信号通路,从而降低抗病毒因子的产生[5]。SOCS1蛋白作为JAK-STAT通路负反馈调节蛋白,在病毒感染过程中呈现特异性的升高,认为SOCS1含量升高可能是导致宿主在抗病毒过程中反应突然衰弱的原因。随后通过对SOCS1蛋白含量的上升调控,则可引起干扰素产生的减少,来促进病毒复制,这可能是通过SOCS1核转位功能来影响SOCS1抑制干扰素的产生[9],而HUO等[19]研究发现,维甲酸诱导基因1(RIG-1)可以促进干扰素的表达来防御DEV的感染,但RIG-1的表达又由STAT1介导,STAT1的表达和磷酸化直接影响RIG-1的抗病毒机制,STAT1与STAT3均为同一家族成员,是否SOCS1抑制STAT3的同时也抑制STAT1,从而导致STAT1表达或磷酸化被抑制,引起RIG-1的抗病毒机制和干扰素的表达减弱,从而表现出SOCS1抑制干扰素的产生,当然生物体进行防御是一个十分复杂的过程,这也许只是其中一部分。本试验中DEV感染后雏鸭组织JAK2蛋白和STAT3蛋白的表达水平均下调,但SOCS1蛋白的表达水平呈现上调,从而使DEV感染鸭症状加重,这是否也是通过SOCS1核转位功能来影响SOCS1抑制干扰素的产生,来促进DEV复制,需要进一步试验来证明。杨颖等[20]研究表明,通过雏鸭腿部肌肉注射感染DEV后10 h内即均可检测到肝脏、脾脏、脑、胸腺、肾脏和肺脏等组织中DEV的病毒含量,说明腿部肌肉注射DEV感染时间更短,而本试验开始对JAK2、STAT3、SOCS1基因或蛋白进行检测的时间为12 h,无法获取DEV开始感染时JAK2、STAT3、SOCS1基因或蛋白的变化情况,但可以知道的是SOCS1蛋白抑制JAK-STAT通路信号,从而促进DEV的增殖。
转录组包括特定组织或细胞在某一时期内表达的所有RNA的集合,包括small RNA、lncRNA及mRNA等[21],目前已经被广泛应用于动物、植物、细菌、病毒等领域[22-23]。一直以来实时荧光定量PCR(quantitative real-time PCR,q RT-PCR)都被作为是转录组测序结果验证的方法之一,去证明转录组测序结果的可靠性。本试验中JAK2、STAT3和SOCS1基因均可转录出成熟mRNA,并翻译成蛋白质,而研究发现十二指肠是DEV感染重要靶器官[24],基于这一点,本次选取十二指肠组织转录组测序和JAK2蛋白Western blot结果来对实时荧光定量PCR和JAK2蛋白ELISA检测结果进行验证,从而去验证实时荧光定量PCR结果和ELISA检测结果的可靠性。通过十二指肠转录组测序可以看出感染DEV后JAK-STAT信号通路会被激活,且JAK2、STAT3和SOCS1基因转录结果与实时荧光定量PCR结果一致,同样的Western blot与JAK2蛋白ELISA检测结果一致。
DEV感染可激活鸭机体组织JAK-STAT信号通路,且是从蛋白质水平上对JAK-STAT信号通路进行负调控;当JAK2和STAT3蛋白表达下调时,SOCS1蛋白表达水平上调,可能为SOCS1蛋白抑制JAK2和STAT3蛋白的表达,从而抑制JAK-STAT信号通路激活,来促进DEV的增殖。

