5-羟色胺对猪植入前胚胎发育的作用
韩 宇,张 蒙,段佳慧,张学明,李子义,唐 博*
(1.吉林大学 动物医学学院,吉林 长春 130062;2.吉林大学 第一医院 转化医学研究院 人类疾病动物模型国家地方联合工程实验室,吉林 长春 130062)
5-羟色胺(5-HT),又称血清素,是一种广泛分布于中枢神经系统和胃肠道的神经递质,也是一种激素和生长因子,在动物发育、生理和病理过程中发挥着至关重要的作用[1]。5-HT广泛分布在雌性生殖组织如人类卵巢、大鼠子宫、输卵管、卵巢和胎盘以及小鼠卵母细胞和颗粒细胞[2]中,并在整个胚胎发育的早期阶段起着至关重要的作用[3]。外源性添加5-HT,可抑制小鼠囊胚的形成,增加凋亡率[4];植入后胚胎中添加5-HT会影响胎儿发育,导致胚胎畸形如颅面缺陷和先天性心脏畸形[5]。
在哺乳动物胚胎发育过程中,父方和母方的基因组必须经历表观遗传重构和转录模式的改变才能实现全能性[6]。表观遗传修饰是调节细胞命运、分化和衰老等关键过程的决定性因素,主要包括DNA的共价修饰和组蛋白的翻译后修饰[7]。组蛋白修饰是组蛋白在相关酶的激活下进行甲基化、乙酰化、磷酸化、腺苷化等修饰过程,是一种广泛存在于真核生物中的表观遗传修饰模式,在调节基因活性和染色质状态中发挥着重要作用[8]。不同类型的组蛋白修饰具有不同的分布和功能[9],例如,H3K4me3可以标记基因启动子和转录的起始[10], H3K27me3可作为发育基因启动子的抑制标记[11]。此外,H3K27Ac是一种启动子和增强子的活性标记物[12]。因此,在哺乳动物胚胎发育过程中,组蛋白修饰可以调控基因表达,影响转录调控。
动物在生存过程中受到刺激后会产生应激反应,在应激状态下,下丘脑-垂体-肾上腺轴(HPA轴)失调,进而使5-HT的分泌紊乱[13]。在母猪饲养过程中,存在很多应激刺激,继而造成母体5-HT的分泌变化,这是否会对胎儿发育产生影响?猪胚胎中5-HT的变化是否会影响胎儿的表观遗传?为了探索这些未知问题,本研究用5-HT处理猪孤雌胚胎,探究了5-HT与胚胎发育及表观遗传修饰三者之间的关系。本研究对5-HT在猪胚胎上的作用机制提供了新的见解,并揭示了其在胚胎发育过程中发挥作用的潜在途径。
1 材料与方法
1.1 试剂RNA提取试剂盒(RNeasy Mini Kit),购自Qiagen公司(德国);反转录试剂盒(TransScript All-in-One First-Strand cDNA Synthesis SuperMix),购自全式金公司(中国);细胞凋亡试剂盒(InSituCell Death Detection Kit)、荧光定量试剂盒,购自Roche公司(德国);H3K4me2,H3K4me3一抗,购自Abcam 公司(英国);5mC、5hmC一抗,购自Active Motif公司(美国);荧光二抗购自武汉博士德公司;其他所使用的化学试剂除特殊指出之外,均购自Sigma公司(美国)。卵母细胞成熟及胚胎培养所用培养液配方参照文献[14]配制。
1.2 卵母细胞的收集和体外成熟(IVM)猪卵巢取自长春当地屠宰场,置于35.0~38.5℃的无菌生理盐水中并在4 h内将其运送到实验室。用10 mL注射器抽取3~6 mm直径的卵泡,在体式显微镜下挑选包裹着均匀颗粒细胞的卵丘-卵母细胞复合物(COCs)。在添加3%牛血清白蛋白(BSA)的TCM-199中洗涤3遍后,将COCs转移至体外成熟培养液中,在38.5℃、5% CO2及100%湿度的培养箱中培养42~44 h。
1.3 孤雌激活(PA)卵母细胞体外成熟后,利用透明质酸酶去除卵丘细胞,并挑选出卵周隙明显、卵黄膜完整且排出第一极体的成熟卵母细胞。将卵母细胞置于融合液(甘露醇0.3 mmol/L,CaCl21.0 mmol/L,MgCl20.1 mmol/L,Hepes 0.5 mmol/L)平衡1 min,转入铺满融合液的融合槽中,利用BTX2001细胞融合仪以1.2 kV/cm,30 μs,2次直流脉冲的条件进行激活。之后对照组转入胚胎培养液PZM-3中进行培养,试验组则置于添加了不同浓度的5-HT胚胎培养液PZM-3中,于38.5℃、5% CO2和100%湿度的条件下进行培养,48 h 后观察卵裂情况,7 d后观察并统计囊胚发育情况。
1.4 免疫荧光染色(IF)取出胚胎置于酸性台式液中反复吹打以去除透明带,在含0.1% PVA的PBS中清洗3次后转入4%多聚甲醛中固定30 min。在PBS-PVA中洗涤3次后,将胚胎转入0.1%Triton X-100中透化30 min(若一抗为5mC和5hmC,透化之后应先置于4 mol/L HCl中处理30 min后转入Tris-HCl中透化20 min);在PBS-PVA中洗涤3次后转入含有2%BSA的PBS中室温封闭1 h或4℃过夜,随后转入一抗中室温孵育1.5 h(一抗用含有2%BSA的PBS稀释,稀释比例见表1); 在PBS-PVA中洗涤3次后,将胚胎转移至Alexa Fluor 488山羊抗小鼠(1∶500稀释液,A-11001,Invitrogen,MA,美国)或Alexa Fluor 594山羊抗兔(1∶500 稀释液,A-11037,Invitrogen,MA,美国)中避光室温孵育1 h;在PBS-PVA中洗涤3次,置于DAPI中染色10~15 min; 最后将胚胎转移至载玻片上,并用抗荧光淬灭剂处理后在荧光显微镜下观察并拍照。

表1 免疫荧光染色所用抗体
1.5 RNA提取、反转录和RT-qPCR收集对照组及5-HT处理组中不同发育时期(2-细胞、 4-细胞和囊胚)的胚胎,利用RNeasy Mini Kit(Qiagen,Hilden,德国)及反转录试剂盒(TransScript All-in-One First-Strand cDNA Synthesis SuperMix),按照说明书进行微量RNA提取及反转录。将所得cDNA作为模板,进行荧光定量PCR。表2列出了荧光定量PCR所用的引物。荧光定量PCR反应体系为10 μL SYBR Green Master Mix,1 μL上游引物和1 μL下游引物,1 μL cDNA和7 μL RNase-free water。反应条件:95℃预变性1 min,之后40个循环扩增程序(95℃ 15 s,60℃ 30 s,72℃ 30 s),然后进行溶解曲线分析(95℃ 60 s,60℃ 60 s,95℃ 1 s),最后冷却至4℃。结果使用2-△△Ct方法进行计算。

表2 荧光定量PCR所用引物信息
1.6 TUNEL染色收集对照组及5-HT处理组的囊胚,置于酸性台式液中反复吹打以去除透明带,在含0.1%PVA的PBS中清洗3次后转入4%多聚甲醛中固定30 min。在PBS-PVA中洗涤3次后,利用TUNEL凋亡染色试剂盒(InSituCell Death Detection Kit)进行染色,之后在PBS-PVA中洗涤3次,将囊胚转移到DAPI染色液中孵育10 min。将胚胎转移至载玻片上,并用抗荧光淬灭剂处理后在荧光显微镜下观察并拍照。
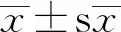
2 结果
2.1 5-HT对猪孤雌胚胎发育能力的影响与对照组相比,500,1 000 μmol/L 5-HT处理组的卵裂率和囊胚率极显著降低(P<0.01)(图1)。由于经过1 000 μmol/L 5-HT处理的胚胎无法发育到囊胚阶段,则选择500 μmol/L作为后续研究的最佳浓度。
A.对照组及处理组的卵裂率变化;B.对照组及处理组的囊胚率变化;C.24,48 h及6 d时胚胎的发育图像(40×)。*P<0.05;**P<0.01。下同
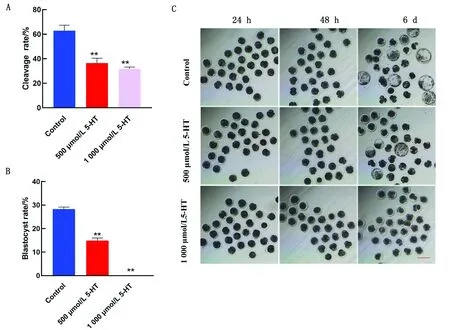
为了评估5-HT处理对胚胎质量的影响,收集对照组及处理组的囊胚利用TUNEL试剂盒进行凋亡分析,测量总细胞数和凋亡率。TUNEL染色结果如图2所示,5-HT处理组的凋亡细胞数明显高于对照组,而囊胚总细胞数显著降低(P<0.01)。
A.囊胚凋亡细胞染色(200×);Bright.明场;Merge.合并;B.囊胚总细胞数及凋亡细胞数的变化
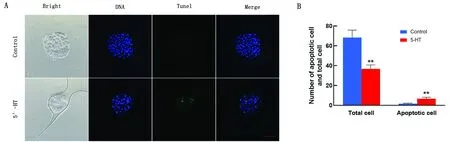
2.2 5-HT对猪孤雌胚胎组蛋白甲基化的影响免疫荧光染色结果表明,与对照组相比,5-HT组的H3K4me2及H3K4me3水平在2-细胞期显著降低(P<0.01),在4-细胞期H3K4me2的水平有所提高,在囊胚期逐渐减弱(P<0.05)(图3,4)。 荧光定量PCR结果显示,在添加500 μmol/L 5-HT处理的2-细胞期胚胎中,去甲基酶KDM1A和KDM5B的含量明显增加,而在4-细胞期显著下降,最后在囊胚期显著上升(图5)。
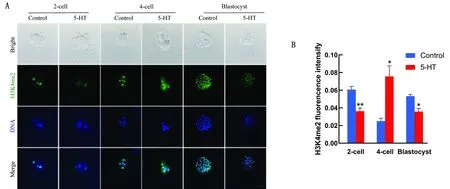
A.通过免疫荧光染色检测H3K4me2水平(200×);Bright.明场;Merge.合并;Blastocyst.囊胚;B.H3K4me2荧光强度分析
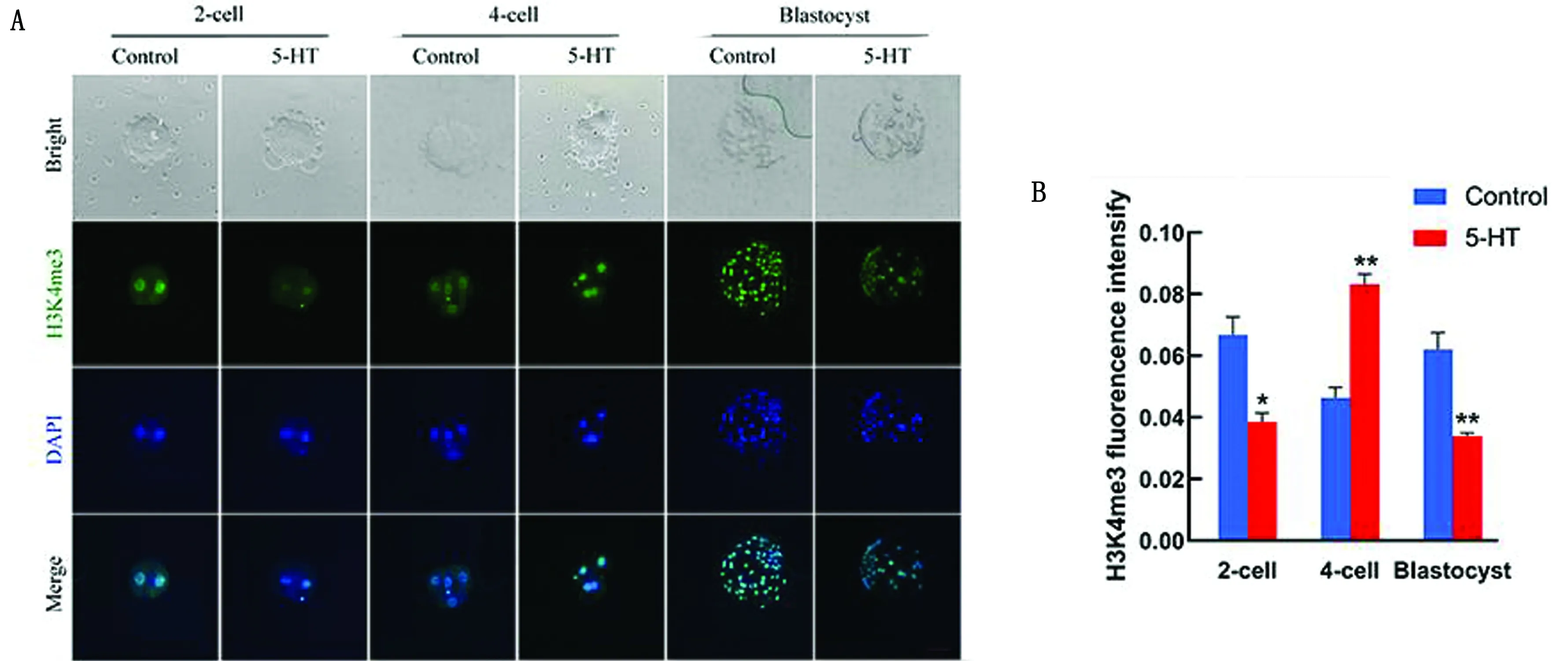
A.通过免疫荧光染色检测H3K4me3水平(200×);B.H3K4me3荧光强度分析
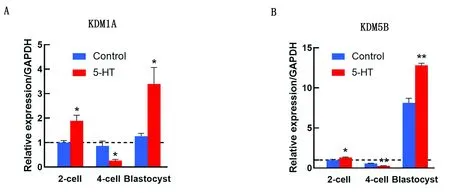
A.KDM1A的mRNA水平;B.KDM5B的mRNA水平
2.3 5-HT对猪孤雌胚胎DNA甲基化水平的影响根据免疫荧光染色和相对荧光强度的结果,对照组和5-HT组在2-细胞、4-细胞和囊胚期的5mC和5hmC信号水平均未观察到显著性差异(图6)。
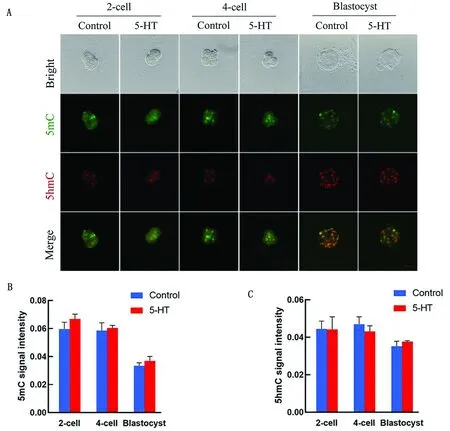
A.通过免疫荧光染色检测DNA甲基化水平(200×);5mC.5甲基胞嘧啶;5hmC.5羟甲基胞嘧啶;B.5mC荧光强度分析;C.5hmC荧光强度分析
2.4 5-HT对多能性基因及凋亡基因的影响荧光定量PCR结果如图7所示,5-HT处理组多能性基因SOX2的mRNA水平在2-细胞、4-细胞及囊胚期显著上升,NANOG的mRNA水平在2-细胞、4-细胞及囊胚期显著下降,促凋亡基因BAX在4-细胞及囊胚期显著上升(P<0.01),而抑凋亡基因BCL2则无显著性差异。
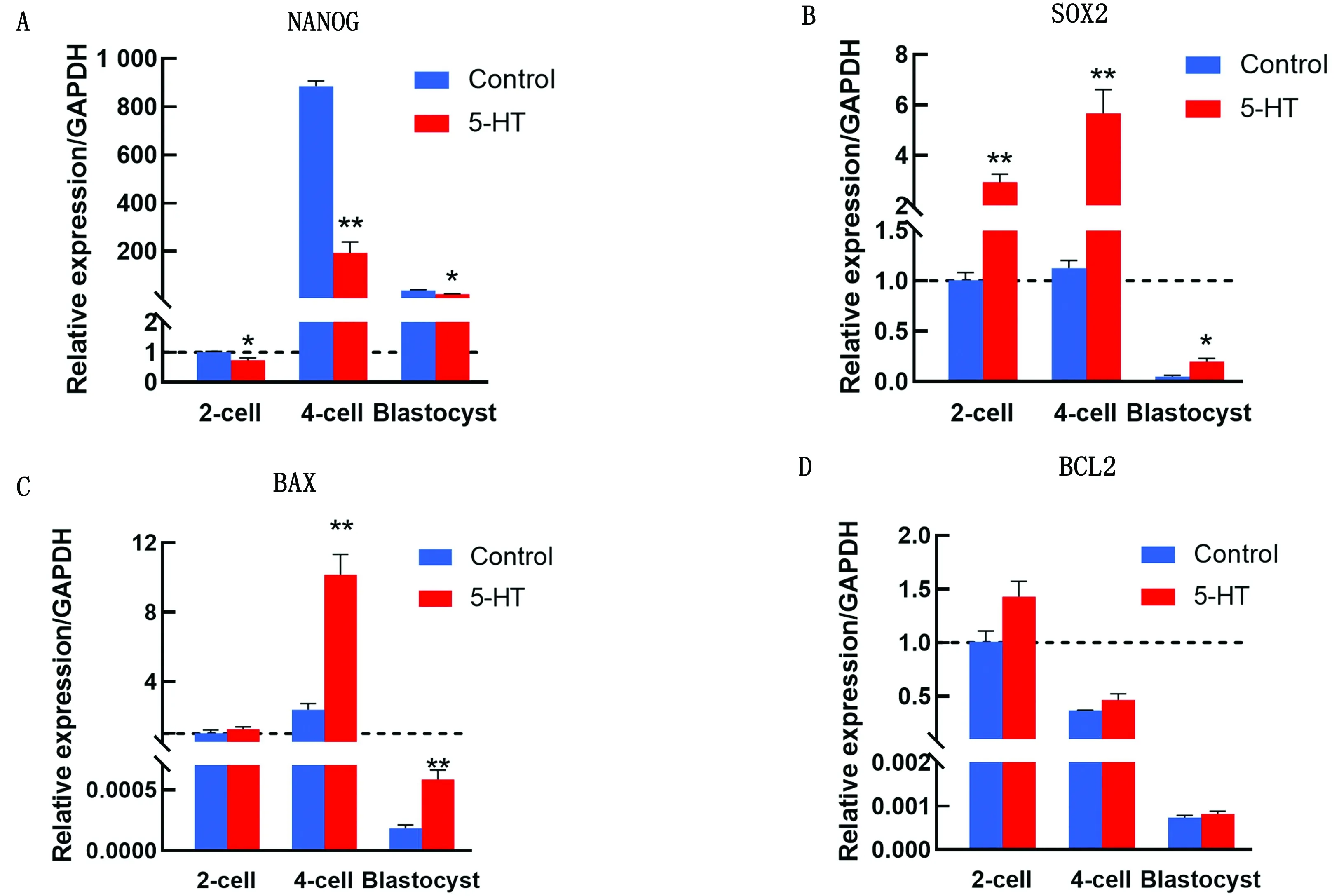
A.多能性基因NANOG的mRNA水平;B.多能性基因SOX2的mRNA水平;C.促凋亡基因BAX的mRNA水平;D.抑凋亡基因BCL2的mRNA水平
3 讨论
5-HT在不同的发育过程中起重要作用,包括细胞增殖、分化,卵母细胞成熟及胚胎发育。LEONOV等[15]首次发现1 g/L的5-HT会抑制胚胎的发育。SAKHAROVA等[16]发现利用5 μmol/L 5-HT预处理后在4-细胞阶段冷冻保存的胚胎活力明显增强。IL′KOV等[17]观察到1 μmol/L 5-HT显著抑制小鼠植入前胚胎发育,增加凋亡率。本试验采用500,1 000 μmol/L 5-HT对猪植入前胚胎进行处理,发现其显著降低卵裂率及囊胚率,增加凋亡细胞数,这与5-HT对小鼠胚胎的抑制作用是一致的。此外,5-HT处理增加了促凋亡基因BAX的转录水平,进一步证实5-HT对猪植入前胚胎发育具有抑制作用。
已有研究发现5-HT对哺乳动物植入前胚胎发育具有抑制作用,但其对胚胎表观遗传修饰的作用鲜有研究。本试验中5-HT处理后H3K4me2和H3K4me3水平在2-细胞阶段显著降低,然后在4-细胞阶段升高,而在囊胚阶段逐渐恢复。H3K4me2和H3K4me3的动态变化主要受组蛋白去甲基化酶KDM1A调控,而组蛋白去甲基化酶KDM5B可以调控早期胚胎中H3K4me3水平[18-19]。5-HT可以通过转谷氨酰胺酶2(TGM2)与胞质蛋白共价连接,进而附着到组蛋白上(组蛋白5-羟色胺化),而这一过程会破坏DNA与组蛋白的结合,并调控基因表达,这表明5-HT与组蛋白修饰之间存在密切的联系[20-21]。组蛋白甲基化在早期胚胎发育和细胞命运中起着至关重要的作用[22-23]。在真核细胞的染色质结构中,组蛋白H3赖氨酸4的甲基化与基因转录激活和转录沉默密切相关, 例如,H3K4me2可以募集HDAc以抑制转录起始,而H3K4me3主要吸引转录调节因子,标记活性基因的转录起始位点,并通过调节染色质来促进基因转录[24]。本试验结果显示KDM1A和KDM5B的表达变化与H3K4me2和H3K4me3的水平保持一致,表明5-HT处理可通过影响组蛋白甲基化来抑制胚胎发育。本研究发现5-HT处理可影响猪孤雌胚胎组蛋白甲基化水平,为猪雌配子在胚胎发育的表观遗传调控提供了新的见解。
在哺乳动物胚胎发育的早期,表观遗传的动态变化在全基因组转录中起着至关重要的作用,从而导致了对诸多基因如多潜能相关基因的研究[25]。本研究发现,5-HT处理显著提高了SOX2 mRNA表达水平,但降低了NANOG mRNA的表达水平。因此,可推测多能性基因启动子处组蛋白修饰的动态变化可能调节自身及其下游基因的表达,从而影响猪的早期胚胎发育。然而,在胚胎发育过程中父源基因组对5-HT的影响还有待于进一步的研究,需进一步探讨5-HT对猪体外受精胚胎发育的影响及组蛋白修饰的调控。
综上所述,5-HT对猪的植入前胚胎发育起着至关重要的作用,5-HT可能通过改变组蛋白修饰从而调节基因表达,进而抑制猪孤雌胚胎的发育。本研究为哺乳动物体内5-HT、组蛋白修饰及胚胎发育三者之间的关系提供了新的见解。

