苦丁茶皂苷D对ox-LDL 诱导的脂质积累和LPS诱导炎症的影响
白春艳,孟 达,张雅琼,顾 雯,张加余,周 倩,饶高雄,车彦云
(云南中医药大学 1. 云南省高校药食同源养生产品工程研究中心、2. 中药学院暨云南省南药可持续利用重点实验室, 云南 昆明 650500;3. 滨州医学院药学院,山东 烟台 264003)
动脉粥样硬化 (atherosclerosis, AS)是大多数心血管疾病的主要病理基础,是一种以内膜增厚、斑块形成为特征的局灶性血管疾病,主要发生在内皮细胞损伤和层流紊乱的部位[1]。巨噬细胞在AS的启动和发展中发挥着重要作用。在AS斑块形成过程中,单核细胞进入血管,在内皮下形成巨噬细胞,巨噬细胞吞噬氧化低密度脂蛋白(ox-LDL) 或其他修饰脂蛋白形成泡沫细胞[2]。泡沫细胞的形成是AS从初期病变到晚期斑块发展的关键因素[3]。泡沫细胞是由巨噬细胞脂质代谢失调引起的,胆固醇摄入依赖于清道夫受体CD36和SR-A1,它们占巨噬细胞吞噬ox-LDL量的90%;胆固醇排出与ATP结合转运蛋白A1/G1(ABCA1/ABCG1)、SR-B1有关[2,4]。因此,抑制巨噬细胞胆固醇吸收或促进巨噬细胞胆固醇外排对抑制泡沫细胞的形成至关重要,也是治疗AS的关键。
AS不仅是一种慢性代谢疾病,也是一种炎性疾病[5]。炎症参与AS的各个阶段,巨噬细胞可分泌细胞因子,进一步促进炎症病变,在巨噬细胞中,白介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)和干扰素-γ等促炎细胞因子和趋化因子的表达会干扰脂质代谢,促进血管斑块破裂[6]。因此抗炎也是抗AS的一个关键点。
苦丁茶为冬青科 Aquifoliaceae 冬青属苦丁茶冬青IlexkudingchaC.J.Tseng 的嫩叶或叶[7]。苦丁茶皂苷D是从苦丁茶分离纯化出来的主要成分。前期研究发现,在动物实验中,苦丁茶皂苷D能降低高脂饮食诱导的ApoE-/-小鼠高胆固醇水平,同时减少ApoE-/-小鼠动脉粥样斑块面积;在体外实验中,苦丁茶皂苷D抑制3T3-L1脂肪细胞的脂滴形成,减少脂质积累,这些结果揭示苦丁茶皂苷D具有降脂、抗AS的作用[7]。本研究从脂质代谢和炎症的角度出发,观察苦丁茶皂苷D对泡沫细胞形成和巨噬细胞炎症的影响,探讨苦丁茶皂苷D抑制泡沫细胞形成和抗炎的机制,进一步了解苦丁茶皂苷D抗AS的机制。
1 材料
1.1 细胞株小鼠腹腔巨噬细胞RAW 264.7购于广州华拓生物科技有限公司。
1.2 试剂与药物苦丁茶购自广西大新(批号:20160101),经云南中医药大学饶高雄教授鉴定为冬青科植物苦丁茶Ilexkudingcha的干燥叶,苦丁茶皂苷D是课题组从苦丁茶叶中制备得到,经HPLC归一化法检测,其纯度≥98%。辛伐他汀购于中国食品药品检定研究所。地塞米松(Sigma,美国,SD9530);雷帕霉素(Sigma,美国,R0395-1MG);脂多糖(lipopolysaccharide,LPS)(Sigma,美国,L6529);人氧化低密度脂蛋白(ox-LDL)(广东奕源生物科技有限公司,YB-002);总胆固醇(TC)试剂盒(北京索莱宝生物有限公司,BC1985);游离胆固醇(FC)试剂盒(北京索莱宝生物有限公司,BC1895);油红O染料(Sigma-Aldrich,美国,00625);胎牛血清(浙江天航生物科技股份有限公司,11011-8611);DMEM高糖培养基(Gibco,美国,11965092);白介素-1β(IL-1β)(杭州联科生物有限公司,EK201BHS-96);白介素-6(IL-6)(杭州联科生物有限公司,EK206/3-96);肿瘤坏死因子-α(TNF-α)(杭州联科生物有限公司,EK282/3-96),单核细胞趋化蛋白-1(MCP-1)(杭州联科生物有限公司,EK287/2-96);RNA提取试剂盒(TaKaRa,日本,9767);逆转录试剂盒(Promega,美国,A5001);荧光定量试剂盒(Promega,美国,LS2068);CD36抗体(武汉三鹰生物技术有限公司,18836-1-AP);SR-A1抗体(武汉三鹰生物技术有限公司,24655-1-AP);ABCG1抗体(武汉三鹰生物技术有限公司,13578-1-AP);ABCA1抗体(Cell Signaling Technology,美国,96292S);β-actin抗体(北京中杉金桥,ZB-2301);mTOR抗体(Cell Signaling Technology,美国,2983S);p-mTOR抗体(Cell Signaling Technology,美国,5536S);GAPDH抗体(Cell Signaling Technology,美国,5174S)山羊抗兔二抗免疫球蛋白(Ig)G(武汉三鹰生物技术有限公司,SA00001-2);BCA蛋白浓度测定试剂盒(碧云天生物技术公司,P0010)。
1.3 仪器AC2-6S1型生物安全柜(新加坡ESCO公司);MCO-18AC 型CO2培养箱(松下健康医疗器械株式会社);Axio Vert.A1倒置显微镜(德国Carl Zeiss公司);SPARK 10M型多功能酶标仪(瑞士Tecan公司);LightCycle 96型荧光定量PCR仪(瑞士Roche公司)。
2 方法
2.1 细胞培养[8]RAW 264.7细胞接种于含有10%胎牛血清,1%青链霉素的DMEM高糖培养基中,培养于温度为37 ℃,含5% CO2的培养箱,待细胞密度达到80%-90%时,胰酶消化传代。
2.2 MTT法筛选药物的最佳浓度及时间[9]将细胞浓度调为5×107个·L-1接种于96孔板,待细胞贴壁后分别加入0、15、30、60、120 μmol·L-1的苦丁茶皂苷D,每组设置5个复孔,分别培养24、48 h。在培养相应的时间后,每孔加入20 μL 5 g·L-1的MTT,将培养板放入培养箱,孵育4 h。4 h后,小心弃去上清液,每孔加入150 μL二甲基亚砜溶解紫色结晶,室温溶解15 min后,酶标仪测定570 nm处的吸光度值,计算细胞存活率。
2.3 油红O染色观察细胞内脂质积聚情况[10]收集状态良好的RAW 264.7细胞,调节浓度为1×108个·L-1,均匀接种到12孔板,待细胞贴壁后,进行分组,分为正常组、模型组、辛伐他汀组、苦丁茶皂苷D低剂量组和苦丁茶皂苷D高剂量组。正常组:正常培养基,模型组:80 mg·L-1ox-LDL,辛伐他汀组:80 mg·L-1ox-LDL+5 μmol·L-1辛伐他汀,苦丁茶皂苷D低剂量组:80 mg·L-1ox-LDL+15 μmol·L-1苦丁茶皂苷D,苦丁茶皂苷D高剂量组:80 mg·L-1ox-LDL+30 μmol·L-1苦丁茶皂苷D,共同培养48 h。48 h后,弃培养基,PBS清洗2次,4%多聚甲醛固定30 min,PBS清洗2次,油红染色30 min,弃油红染液,60% 异丙醇脱色,PBS清洗2次,苏木素染色30 s,PBS清洗返蓝,倒置显微镜下拍照。
2.4 细胞内TC、FC的测定收集状态良好的RAW 264.7细胞,调节浓度为1×109个·L-1,均匀接种至6孔板。待细胞生长融合至80%左右,参照“2.3”中的方法分组给药,培养48 h。48 h后,按照TC和FC试剂盒说明书处理细胞,使用酶标仪在500 nm下测定吸光度,按照BCA试剂盒说明书测定蛋白浓度。
2.5 RT-qPCR检测SR-A1、CD36、ABCA1和ABCG1 mRNA表达收集状态良好的RAW 264.7细胞,调节浓度为1×109个·L-1,均匀接种至6孔板,待细胞生长融合至80%左右,按“2.3”中的方法分组给药。48 h后,收集细胞,按照总RNA提取试剂盒说明书提取RNA,按照逆转录试剂盒说明书进行逆转录,使用SYBR-Green扩增cDNA。反应条件:95 ℃预变性15 s,55 ℃退火30 s,72 ℃延伸30 s,共45个循环。SR-A1上游引物:5′-TTAAAGGTGATCGGGGACAAA-3′,下游引物:5′-CAACCAGT CGAACTGTCTTAAG-3′;CD36上游引物:5′-CAA GCTCCTTGGCATGGTAGA-3′,下游引物:5′-TGG ATTTGCAAGCACAATATGAA-3′;ABCA1上游引物:5′-TTAAAAACCTGGATCGGAACCAA-3′,下游引物:5′-GCATTAGCTTCAGATTTACGGGT-3′; ABCG1上游引物5′-CAAGACCCTTTTGAAAGGGATCTC-3′,下游引物:5′- GCCAGAATATTCATGAGTGTGGAC-3′;GAPDH上游引物:5′-GAAGATGGTGATGGGATTTC-3′,下游引物:5′-GAAGGTGAAGGTCGGAGT-3′。循环基线设定值(Ct值)为检测器软件默认值。每个样品设 3 个复孔,以GAPDH为内参基因,2-ΔΔCt法计算目的基因的相对表达量。
2.6 Western blot 检测SR-A1、CD36、ABCA1、ABCG1蛋白表达收集状态良好的RAW 264.7细胞,调节浓度为1×109个·L-1,均匀接种至直径6 cm的培养皿中,待细胞生长融合至80%左右,按“2.3”中的方法分组给药。收集细胞,提取细胞总蛋白,BCA测定蛋白浓度。取总蛋白20 μg在10% SDS- PAGE中电泳分离,转至PVDF膜上,置于5%脱脂奶粉中室温封闭1 h,加入1 ∶1 000稀释的SR-A1抗体、CD36抗体、ABCA1抗体和ABCG1抗体,4 ℃孵育过夜,TBST洗膜10 min 3次,1 ∶5 000稀释二抗,室温孵育1 h,TBST洗膜 5 min 3次,荧光试剂化学曝光,显影成像,ImageJ软件分析,进行半定量分析。
2.7 ELISA检测细胞炎性因子收集状态良好的RAW 264.7细胞,调节浓度为5×108个·L-1,均匀接种至24孔板。待细胞生长融合至80%左右,进行分组,分别为正常组、模型组,地塞米松组、苦丁茶皂苷D低剂量组和苦丁茶皂苷D高剂量组。实验前预给药2 h,地塞米松组:10 μmol·L-1,苦丁茶皂苷D低剂量组:15 μmol·L-1,苦丁茶皂苷D高剂量组:30 μmol·L-1。2 h后,加入LPS使其终浓度为1 mg·L-1,刺激24 h。24 h后,收集上清液,ELISA测定细胞上清液中IL-6、IL-1β、TNF-α和MCP-1的含量。
2.8 RT-qPCR检测细胞炎性因子基因表达收集状态良好的RAW 264.7细胞,调节浓度为1×109个·L-1,均匀接种至6孔板,待细胞生长融合至80%左右,按“2.7”中的方法分组给药,按“2.5”项的方法和条件进行定量和计算。IL-6上游引物:5′-CCTTCACTCCATTCGCTGTCT-3′,下游引物:5′-TCC TGATTTCCCTCATACTCG-3′;IL-1β上游引物:5′-FGGCAACCGTACCTGAACCCA-3′,下游引物:5′-CCACGATGACCGACACCACC-3′;MCP-1上游引物:5′-TTAAAAACCTGGATCGGAACCAA-3′,下游引物:5′-GCATTAGCTTCAGATTTACGGGT-3′;TNF-α上游引物:5′-ACGGGCTTTACCTCATCTACTCAG-3′;下游引物:5′-GGCTCTTGATGGCAGACAGG-3′。
2.9 Western blot 检测mTOR和p-mTOR 蛋白表达收集状态良好的RAW 264.7细胞,调节浓度为2×109个·L-1,均匀接种至直径6 cm的培养皿中,待细胞生长融合至80%左右,进行分组,分别为正常组、模型组、雷帕霉素组、苦丁茶皂苷D低剂量组和苦丁茶皂苷D高剂量组。实验前预给药2 h,雷帕霉素组:1 μmol·L-1,苦丁茶皂苷D低剂量组:15 μmol·L-1,苦丁茶皂苷D高剂量组:30 μmol·L-1。2 h后,加入LPS使其终浓度为1 mg·L-1,刺激24 h。24 h后,提取细胞总蛋白,检测mTOR和p-mTOR的表达。
3 结果
3.1 苦丁茶皂苷D对细胞活性的影响通过MTT法检测不同剂量的苦丁茶皂苷D对细胞增值抑制作用的影响,如Tab 1所示,在0-120 μmol·L-1范围内,随着苦丁茶皂苷D浓度的增加,细胞存活率逐渐下降;同一剂量的苦丁茶皂苷D培养细胞,随着培养时间的延长,细胞活性亦有所下降。与0 μmol·L-1相比,15 μmol·L-1和30 μmol·L-1浓度的苦丁茶皂苷D在刺激24或48 h后,细胞存活率没有差异,因此苦丁茶皂苷D选择15 μmol·L-1和30 μmol·L-1浓度进行后续实验。
Tab 1 Effect of different concentrations of Kudinoside D
3.2 苦丁茶皂苷D对巨噬细胞内脂滴积聚的影响如Fig 1所示,采用油红O染色,80 mg·L-1ox-LDL诱导RAW 264.7细胞48 h后,与正常组相比细胞内大量脂滴积聚,辛伐他汀和苦丁茶皂苷D干预后,改善了巨噬细胞内脂质沉积情况。

Fig 1 Effects of Kudinoside D on lipid droplets in macrophages(400×)

Fig 2 Effect of Kudinoside D on protein expression level of CD36, SR-A1, ABCA1 and ABCG1 in RAW264.7 cells
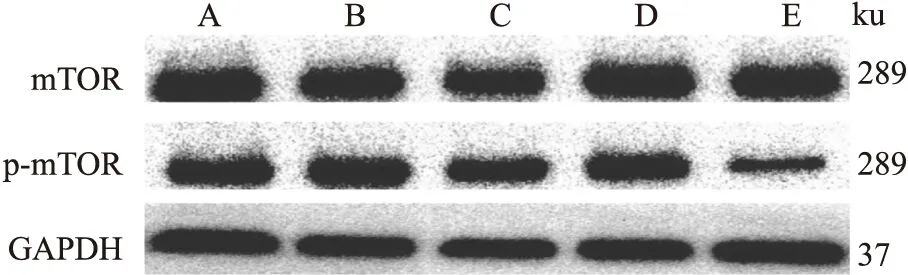
Fig 3 Effect of Kudinoside D on protein expression levels of mTOR and p-mTOR in LPS-induced RAW264.7 cells
3.3 苦丁茶皂苷D对巨噬细胞内TC、FC的影响如Tab 2所示,80 mg·L-1ox-LDL诱导RAW 264.7细胞48 h后,细胞内TC含量明显升高,且CE/TC>50%,说明泡沫细胞模型建立成功[11]。在辛伐他汀、苦丁茶皂苷D高剂量干预后,与模型组相比,细胞内TC含量皆明显下降,且CE/TC<50%,提示辛伐他汀和苦丁茶皂苷D高剂量皆可降低巨噬细胞内的脂质沉积,抑制巨噬细胞泡沫化。

Tab 2 Effect of Kudinoside D on contents of TC and FC
3.4 苦丁茶皂苷D对SR-A1、CD36、ABCA1、ABCG1 mRNA表达的影响利用RT-qPCR检测苦丁茶皂苷D干预后对RAW264.7细胞上SR-A1、CD36、ABCA1和ABCG1 mRNA表达的影响。如Tab 3所示,与正常组相比,ox-LDL诱导后,SR-A1的mRNA表达显著升高,CD36的mRNA表达略有升高,而ABCA1和ABCG1的mRNA表达略有降低。辛伐他汀干预后,明显下调了SR-A1 mRNA的表达,稍下调了CD36 mRNA的表达,而对ABCA1和ABCG1 mRNA的表达调节不明显。苦丁茶皂苷D高剂量也明显下调了SR-A1 mRNA的表达,但对CD36、ABCA1和ABCG1 mRNA的 表达调节不明显。
3.5 苦丁茶皂苷D对巨噬细胞SR-A1、CD36、ABCA1、ABCG1 蛋白表达的影响如Tab 4 Western blot检测结果显示,ox-LDL上调了SR-A1、CD36和ABCA1的蛋白表达,略微下调了ABCG1的蛋白表达。苦丁茶皂苷D干预后,明显下调了SR-A1的蛋白表达,但对CD36、ABCA1和ABCG1的蛋白表达调节不明显。
3.6 苦丁茶皂苷D对LPS诱导的炎症因子的影响如Tab 5显示,LPS(1 mg·L-1)刺激RAW 264.7 细胞24 h后,细胞上清液中IL-1β、IL-6、MCP-1和TNF-α 的含量较正常组显著升高。与模型组相比,阳性药地塞米松和苦丁茶皂苷D高剂量显著降低
Tab 3 Effect of Kudinoside D on mRNA expression of CD36, SR-A1, ABCA1 and ABCG1 in
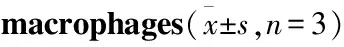
Tab 4 Effect of Kudinoside D on protein expression of CD36, SR-A1, ABCA1 and ABCG1 in

Tab 5 Effect of Kudinoside D on LPS-induced levels of IL-1β, IL-6, MCP-1 and

Tab 6 Effect of Kudinoside D on LPS-induced mRNA expressions of IL-1β, IL-6, MCP-1 and
了IL-1β、IL-6和MCP-1的含量,但是地塞米松对TNF-α的影响不明显,苦丁茶皂苷D高剂量可略降低TNF-α含量,但差异无统计学意义。
3.7 苦丁茶皂苷D对LPS诱导的炎症因子基因表达的影响如Tab 6显示,LPS(1 mg·L-1)刺激 RAW 264.7细胞24 h后,IL-1β、IL-6、MCP-1和TNF-α 的mRNA表达较正常组明显升高。与模型组相比,阳性药地塞米松和苦丁茶皂苷D高剂量显著降低了IL-1β、IL-6和MCP-1的mRNA表达,但是对TNF-α的mRNA表达调节不明显,与“3.6”项的结果趋势一致,结果提示苦丁茶皂苷D有一定抗炎作用。
3.8 苦丁茶皂苷D对LPS诱导的mTOR和p-mTOR蛋白表达的影响如Tab 7所示,1 mg·L-1的LPS刺激RAW 264.7细胞24 h后,与正常组相比,磷酸化mTOR 的表达水平有所上调;与模型组相比,mTOR抑制剂雷帕霉素和苦丁茶皂苷D高剂量明显下调了磷酸化mTOR 的表达。
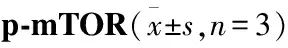
Tab 7 Effect of Kudinoside D on LPS-induced protein expressions of mTOR and
4 讨论
AS 是心血管疾病发展过程中的特征性病理改变,其机制非常复杂,脂质过量积聚和炎症异常激活在AS的发生发展中起着重要的作用[12]。Ox-LDL已被证实在AS的发病机制中起关键作用,ox-LDL诱导内皮细胞或巨噬细胞形成泡沫细胞被认为是AS体外的一个简单模型[12]。本研究以80 mg·L-1ox-LDL诱导RAW 264.7细胞48 h后,细胞内大量脂质沉积,形成泡沫细胞,经苦丁茶皂苷D高剂量治疗后,巨噬细胞内TC含量降低,泡沫化降低。
胆固醇稳态是泡沫细胞形成的关键调节因子,抑制胆固醇吸收和促进胆固醇外排是抑制泡沫细胞形成的两个有效途径[13]。巨噬细胞上清道夫受体CD36和SR-A1控制胆固醇的吸收,而ABCA1和ABCG1调节巨噬细胞胆固醇的排出。早期研究表明,巨噬细胞上表达的清道夫受体,尤其是A型清道夫受体SR-A和B家族成员CD36是巨噬细胞转化为泡沫细胞的主要标志物[1]。SR-A1参与了巨噬细胞对修饰LDL的吸收,在ApoE-/-小鼠中,SR-A1下调可减少泡沫细胞的形成,减缓AS的进程;在LDL受体缺陷的小鼠中,单独抑制CD36或SR-A1均具有AS保护的作用[14]。苦丁茶皂苷D干预后,SR-A1的基因和蛋白表达明显下调,说明苦丁茶皂苷D通过调节SR-A1的基因和蛋白表达,抑制巨噬细胞对胆固醇的吸收。
巨噬来源的泡沫细胞大量堆积,促进AS斑块的形成,也会释放大量的炎性因子,加重炎症,加快AS进程,导致心血管疾病的发生[15]。巨噬细胞也是炎症反应的关键介质,影响AS的进展[3]。本研究利用LPS诱导巨噬细胞炎症,苦丁茶皂苷D干预后,高剂量明显降低了IL-6、IL-1β和MCP-1等炎性因子的表达。有研究表明,LPS可诱导磷酸化mTOR的上调,激活mTOR通路。mTOR是一种丝/苏氨酸蛋白激酶,它参与了细胞的增殖和分化,并且参与了免疫炎症和氧化应激的调节,mTOR的激活在炎症级联的启动中发挥作用[16-18]。苦丁茶皂苷D干预后,下调了磷酸化mTOR的表达,提示苦丁茶皂苷D的抗炎作用可能与mTOR通路有关。
综上所述,苦丁茶皂苷D降低巨噬源性泡沫细胞内TC含量与其下调SR-A1的表达,抑制胆固醇的吸收有关,其抗炎机制可能与mTOR通路有关。

