白细胞介素-34在原发性胆汁性胆管炎中的表达及其意义*
程苕莼 李 晗 李 民 罗蕾蕾 顾春燕 卞兆连&
南通大学医学院1(226001) 南通大学附属第三医院消化内科2 病理科3
背景:白细胞介素-34(IL-34)是一种重要的免疫调节因子,在多种自身免疫性疾病中发挥重要作用。目的:探讨IL-34在原发性胆汁性胆管炎(PBC)中的表达及其对肝内炎症和胆管损伤的影响。方法:收集26例PBC患者和10例非PBC肝血管瘤患者的肝组织标本,以免疫组化法检测IL-34表达和定位。采用聚肌胞苷酸腹腔注射在野生型和IL-34基因敲除C57BL/6小鼠中构建PBC模型,评价小鼠肝内炎症和胆管损伤情况,以real-time PCR和蛋白质印迹法检测肝组织IL-34以及相关细胞因子表达。结果:PBC患者和PBC小鼠模型肝组织IL-34表达均显著高于相应对照组(P均<0.05)。未造模IL-34基因敲除小鼠肝脏病理学组织形态无明显变化,造模IL-34基因敲除小鼠的门管区炎症和胆管上皮损伤均明显重于野生型PBC模型小鼠(P均<0.05),肝组织促炎细胞因子白细胞介素-1β(IL-1β)、单核细胞趋化蛋白-1(MCP-1)表达较野生型PBC模型小鼠显著增高,抗炎细胞因子IL-10和M2型巨噬细胞标志物CD163表达则较野生型PBC模型小鼠显著降低(P均<0.05)。结论:PBC时IL-34表达增高可能通过调节细胞因子表达、诱导巨噬细胞向M2型分化缓解门管区炎症和胆管损伤,实现肝内免疫微环境的负反馈调控,从而延缓疾病进程。
原发性胆汁性胆管炎(primary biliary cholan-gitis, PBC)是一种以肝内小叶间胆管非化脓性炎症为主要病理特征的自身免疫性肝病[1-2]。白细胞介素(interleukins, ILs)是体内产生最为广泛的炎症细胞因子,在免疫调节以及多种疾病的发生过程中发挥重要作用。目前研究显示,PBC系由环境因素作用于遗传易感个体所引发,其发病机制复杂,炎症介质与免疫功能紊乱在其中发挥重要作用[1-3]。研究表明,IL-17、IL-23、IL-33等多种促炎细胞因子水平在PBC患者中显著升高并与疾病严重程度呈正相关[4-6]。
IL-34广泛存在于人体组织器官中,通过与相应受体结合,在多种自身免疫性疾病中发挥重要作用[7-8]。研究发现IL-34可促进CD4+单核细胞增殖,并可诱导巨噬细胞向M2型分化,抑制炎症反应,发挥免疫调节作用[9-10]。作为一种典型的肝脏特异性自身免疫性疾病,肝内免疫失衡是PBC的主要发病机制[1-3,11],IL-34作为重要的免疫调节因子,其在PBC中的表达变化是否会对PBC病程产生影响,目前尚无相关研究报道。本研究通过分析IL-34在PBC患者和模型小鼠肝脏中的表达情况,以及IL-34基因敲除对PBC模型小鼠肝内炎症和胆管损伤的影响,以期阐明IL-34在PBC中的作用和意义。
材料与方法
一、临床样本收集
2019年9月—2020年9月南通大学附属第三医院收治并确诊为PBC的住院患者26例纳入研究,其中男性6例,女性20例,年龄(48.5±10.5)岁。入选病例肝脏组织病理学符合PBC,同时满足反映胆汁淤积的血清生化指标如碱性磷酸酶(ALP)升高,或血清抗线粒体抗体(AMA)或AMA-M2阳性[12]。同期10例在南通大学附属第三医院行肝血管瘤切除术的非PBC患者作为对照组,其中男性2例,女性8例,年龄(46.0±9.2)岁。所有研究对象均排除病毒性、酒精性、药物性、脂肪性和遗传性肝损伤。收集PBC患者的肝穿刺活检标本和对照组患者的手术切除标本边缘正常肝组织,用于IL-34表达检测。临床样本收集和动物实验均经南通大学附属第三医院医学伦理委员会审核批准。
二、实验动物
委托北京华夏凯奇生物技术有限公司构建IL-34基因敲除(IL-34KO)C57BL/6小鼠,经饲养繁殖获得纯合子小鼠。野生型C57BL/6小鼠购自上海斯莱克实验动物有限责任公司。选用6~8周龄、体质量22~25 g的雌性小鼠进行实验,实验动物饲养于南通大学医学院SPF级动物房。所有动物实验均依从《实验动物饲养管理和使用指南》。
三、方法
1. PBC动物模型制备:首先选取野生型和IL-34KO小鼠各10只,观察肝脏组织病理学改变,以明确IL-34基因敲除对肝脏病理学组织形态的影响。随后选取野生型和IL-34KO小鼠各12只,予腹腔注射5 mg/kg聚肌胞苷酸(Sigma-Aldrich®, Merck KGaA)构建PBC模型,每周注射2次,分别于第8周、第12周腹腔注射后2 d脱颈椎处死小鼠,每一时间点两组小鼠各6只。另选取6只野生型小鼠每周腹腔注射2次0.9% NaCl溶液作为对照组,于第8周脱颈椎处死。各组小鼠处死后取肝组织,用于后续实验。
2. 肝组织HE染色和病理学评分:各组小鼠肝组织石蜡包埋、切片,常规HE染色,光学显微镜下观察并行病理学评分。门管区炎症评分:无改变,0分;轻度,1分;中度,2分;重度,3分;极重度,4分。胆管上皮损伤评分:无改变,0分;上皮损伤(仅细胞质改变),1分;上皮损伤伴细胞质和细胞核改变,2分;非化脓性破坏性胆管炎,3分;胆管消失,4分。
3. 免疫组化检测:临床肝组织标本石蜡包埋、切片,二甲苯、乙醇梯度脱水,微波抗原修复;加入IL-34抗体(Abcam plc.; 1∶200),4 ℃冰箱过夜;加入HRP耦联二抗,室温孵育30 min;DAB显色,光学显微镜下观察。细胞质内出现棕黄色颗粒为IL-34表达阳性。每张切片随机观察5个具有代表性的高倍视野,根据阳性细胞百分比将IL-34表达强度分为0(<25%)、1(25%~50%)、2(50%~75%)、3(>75%)四个等级。
4. 蛋白质印迹法:收集各组小鼠肝组织,以RIPA裂解液裂解后收集总蛋白,离心、取上清液,上样、电泳、PVDF转膜、封闭,一抗孵育过夜[IL-34抗体(Santa Cruz Biotechnology, Inc.; 1∶200);内参β-actin抗体(1∶5 000)],TBST洗膜3次,二抗孵育,显影、定影,使用ImageJ 1.8.0软件进行图像分析。
5. Real-time PCR:制备各组小鼠肝组织匀浆,TRIzol试剂(Thermo Fisher Scientific)提取总RNA,检测RNA浓度和纯度;参照逆转录试剂盒和real-time PCR试剂盒(Takara Bio Inc.)说明书进行操作,将RNA逆转录成cDNA,以之为模板行PCR扩增,检测IL-34、IL-1β、单核细胞趋化蛋白-1(mono-cyte chemotactic protein-1, MCP-1)、IL-10、CD163 mRNA表达。PCR引物序列见表1,PCR反应条件:95 ℃ 10 s;62 ℃ 5 s,42个循环。采用2-ΔΔCt法计算目的基因mRNA相对表达量。

表1 Real-time PCR引物序列
四、统计学分析
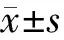
结 果
一、PBC患者肝组织IL-34表达增强
免疫组化检测显示,PBC患者肝组织IL-34表达明显增强,表达主要定位于门管区炎症周围肝细胞(图1A),在门管区炎症细胞中亦有少量表达,相对表达量与对照组肝组织相比差异有统计学意义(P<0.05;图1B)。
两组间比较,***P<0.001
二、PBC模型小鼠肝组织IL-34表达增高
Real-time PCR和蛋白质印迹法检测显示,与未造模野生型小鼠相比,PBC模型小鼠肝组织 IL-34 mRNA和蛋白表达均明显增高,差异有统计学意义(P<0.05;图2)。
三、IL-34基因敲除对小鼠肝脏病理学无影响
对野生型小鼠和IL-34KO小鼠肝组织切片行HE染色,光学显微镜下观察发现两组肝脏小叶结构和门管区形态相似(图3),表明IL-34基因敲除对小鼠肝脏病理学组织形态无影响。
四、 IL-34基因敲除加重PBC模型小鼠肝内炎症和胆管损伤
分别建立野生型小鼠和IL-34KO小鼠PBC模型,HE染色观察两组小鼠肝内炎症和胆管损伤情况。野生型小鼠造模8周后肝内出现轻度门管区炎症和轻度胆管上皮损伤;造模时间延长至12周,病理学进展至中度门管区炎症和胆管上皮损伤。IL-34KO小鼠造模8周后门管区炎症和胆管上皮损伤已达到中度,病理学评分均明显高于同时间点野生型PBC模型小鼠,差异有统计学意义(P均<0.05);造模12周后,IL-34KO小鼠表现为重度门管区炎症和胆管上皮损伤,病理学评分均明显高于同时间点野生型PBC模型小鼠,差异有统计学意义(P均<0.05;图4)。

**两组间比较,P<0.01
五、IL-34基因敲除促进PBC模型小鼠肝内促炎细胞因子表达
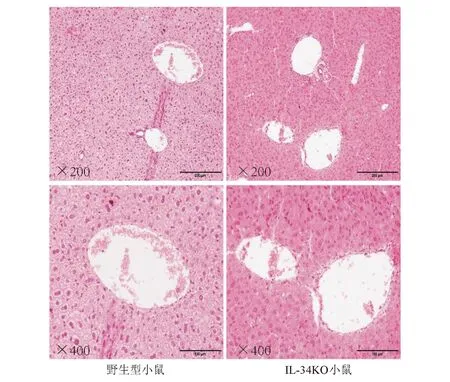
图3 IL-34基因敲除对小鼠肝脏病理学无影响(HE染色)
Real-time PCR检测显示,造模8周后,IL-34KO PBC模型小鼠肝组织IL-1β、MCP-1 mRNA相对表达量较野生型PBC模型小鼠明显升高,IL-10 mRNA相对表达量较野生型PBC模型小鼠明显降低,差异均有统计学意义(P均<0.05;图5A);造模12周后,两组间IL-1β、MCP-1、IL-10表达变化趋势与造模8周后一致,IL-34KO PBC模型小鼠CD163 mRNA相对表达量亦较野生型PBC模型小鼠明显降低,差异均有统计学意义(P均<0.05;图5 B)。
两组间比较,*P<0.05,**P<0.01

两组间比较,*P<0.05,**P<0.01,***P<0.001,****P<0.000 1; ns, P>0.05
讨 论
PBC是一种自身免疫性肝病, 病理学表现为免疫介导的胆管上皮细胞损伤、胆汁淤积和进行性肝纤维化,如未得到有效治疗,最终会进展至胆汁性肝硬化。尽管PBC的主要治疗药物熊去氧胆酸被证明具有一定的免疫调节作用,但仍缺乏针对其发病关键因素——肝内免疫功能异常的有效治疗手段[13]。作为暴露于病原体的免疫器官,肝脏中存在多种免疫细胞,形成独特的免疫微环境,在炎症情况下可合成各种急性期蛋白,参与机体免疫反应。研究显示肝内免疫耐受破坏是PBC最重要的发病机制,患者肝内门管区大量淋巴细胞浸润,形成胆管周围炎,导致胆管上皮细胞凋亡增加,同时巨噬细胞吞噬凋亡小体的能力下降,进一步放大肝内炎症反应,导致胆管周围炎进行性加重,最终引起进行性肝损害。多种细胞因子参与了PBC肝内炎症的调控,探究这些细胞因子调控肝内免疫微环境的方式和作用机制是目前PBC肝内免疫微环境研究的重点。
IL-34 是近年新发现的细胞因子,主要生物学功能为诱导单核巨噬细胞增殖和分化、参与炎症反应,具有诱导机体免疫耐受的潜能,与多种自身免疫性疾病的发生、发展有关。本实验采用real-time PCR、蛋白质印迹法和免疫组化技术研究了IL-34在肝组织中的表达情况,发现PBC患者和模型小鼠肝组织中的IL-34表达均显著增高,其表达主要定位于门管区周围肝细胞和门管区内炎症细胞中,提示IL-34可能对门管区炎症具有一定调控作用。进一步通过构建IL-34基因敲除小鼠研究IL-34对PBC肝内炎症和胆管损伤的影响,结果显示IL-34基因敲除在生理状态下对肝脏病理学组织形态无影响,但在PBC模型小鼠中,IL-34基因敲除可加重门管区炎症和胆管上皮细胞损伤,提示IL-34可能仅在PBC发病时的特定肝内免疫微环境下发挥免疫调节作用。
MCP-1作为C-C趋化因子家族成员,对单核细胞、巨噬细胞和淋巴细胞具有强趋化活性[14],其与促炎细胞因子IL-1β能激活多种免疫细胞,通过核因子-κB(NF-κB)通路调节炎症细胞因子、黏附分子以及其他炎症介质表达,参与诱导炎症反应[15-16],在肝内炎症反应的启动和维持中发挥重要作用。CD163是M2型巨噬细胞标志物,表达于M2型巨噬细胞的细胞膜[17]。IL-10是一种重要的抗炎细胞因子,主要生理功能为抑制巨噬细胞的抗原呈递作用以及抑制多种促炎细胞因子产生[18]。为验证IL-34调控PBC肝内免疫的可能性,本研究检测了上述因子在野生型和IL-34基因敲除PBC模型小鼠肝组织中的表达水平,结果显示IL-34基因敲除在PBC模型小鼠中能显著上调IL-1β、MCP-1表达,同时下调IL-10和CD163表达,证实在PBC特定的肝内免疫微环境下,IL-34能抑制肝内炎症反应,诱导巨噬细胞向M2型分化。根据既往文献报道,IL-34在不同自身免疫性疾病中的作用并不相同。王娟[19]的研究显示IL-34可能在过敏性紫癜的免疫应答中发挥促炎作用,是参与过敏性紫癜血管炎发生的关键因子之一。Zwicker等[20]的研究则发现结肠炎小鼠肠上皮细胞产生的IL-34可下调单核细胞肿瘤坏死因子-α(TNF-α)和IL-1β表达,提示IL-34在炎症性肠病中可能作为免疫调节因子减轻肠道炎症。本研究也发现IL-34可能通过调控肝内免疫微环境缓解PBC的肝内炎症和胆管损伤。
综上所述,本研究发现PBC发病过程中肝内IL-34表达明显增高;IL-34基因敲除可上调促炎细胞因子表达、下调抗炎细胞因子和M2型巨噬细胞标志物表达,加重PBC模型小鼠的门管区炎症和胆管损伤。上述结果提示,IL-34在PBC特定的免疫微环境下可能通过调节肝内细胞因子表达、诱导巨噬细胞向M2型分化缓解PBC相关门管区炎症和胆管损伤。因此,IL-34或可成为PBC的治疗靶点,有望通过调控IL-34基因表达影响肝内免疫微环境,实现PBC肝内免疫的负反馈调控,从而延缓疾病进程。

