MarR家族蛋白Orf17在自溶链霉菌格尔德霉素生物合成中的调控作用
纪开燕,杨 玲,吴姣姣,蒋明星,韩秀林,鲁 涛
(云南大学 生命科学学院,云南省微生物研究所,云南 昆明 650091)
格尔德霉素(geldanamycin,GM)是由放线菌产生的苯醌安莎类抗生素,因其具有极强的抗肿瘤活性,自发现以来就引起了研究者广泛关注,是有很好开发应用前景的药物.GM 的作用靶点是Hsp90,其能够特异性地抑制Hsp90 氨基端ATP 酶活性[1-2],多种肿瘤相关蛋白皆需依赖Hsp90 ATP 酶来行使其功能.Hsp90 ATP 酶活性受到抑制导致该类蛋白降解,最终引起肿瘤细胞死亡[3-5].但是,此类化合物有肝毒性较强、水溶性差等缺点,阻碍了临床的开发应用,因此有必要研究其生物合成途径,以期对其进行基因改造或寻找其类似物[6-7].对GM 及其类似物生物合成的深入研究有助于对此类化合物的进一步研发.
关于GM 的生物合成途径已经有了一些研究[8-12],这些研究表明LuxR 家族调控子GdmRⅠ和GdmRⅡ及TetR 家族调控子GdmRⅢ在格尔德霉素的生物合成中都起到正调控作用.我们克隆并测序了自溶链霉菌(Streptomyces autolyticus)CGMCC 0516 中格尔德霉素生物合成基因簇[13-14],并证明了其中GdmRⅠ、GdmRⅡ及GdmRⅢ同样在格尔德霉素的生物合成中都起到正调控作用[15].但是,此类化合物生物合成的一些调控细节尚未完全解析.
在自溶链霉菌GM 生物合成基因簇中存在一个功能未知的基因orf17.该基因编码的蛋白属于MarR(multiple antibiotic resistance regulator)多重耐药调控蛋白.MarR 蛋白家族是原核生物的一个多效性转录调控子,通过与靶标DNA 结合从而阻遏转录[16],参与细菌多种生命进程的调控,如抗药性和毒力因子相关基因的表达调控等,在致病菌适应外界压力的过程中也起到关键作用[17-19].在本工作中,我们对自溶链霉菌中Orf17 的功能进行了研究,成功构建了orf17突变株,并对突变株不同阶段的发酵产物进行了HPLC 分析;同时,采用RT-PCR对格尔德霉素生物合成相关基因在orf17突变株中的表达进行了分析;此外,分离纯化了突变株中产量提高的3 个化合物,并对其进行了结构鉴定.研究结果初步表明Orf17 正调控自溶链霉菌中格尔德霉素的生物合成,可能负调控自溶链霉菌中洋橄榄 叶素的生物合成.
1 材料与方法
1.1 菌株、质粒和培养条件所用的菌株及质粒见表1.质粒pHY773 和pSA267 分别由中国科学院上海植物生理与生态研究所覃重军老师和云南大学尹敏老师惠赠.链霉菌产孢使用ISP4(BD Difco,USA)培养基,于28 ℃平板培养;种子液培养基为TSB(BD Difco,USA)培养基,在28 ℃下振荡培养;发酵所用培养基为61﹟培养基(酵母粉2 g,鱼蛋白胨2 g,可溶性淀粉5 g,大豆粉5 g,葡萄糖20 g,CaCO32 g,NaCl 4 g,MgSO4·7H2O 0.5 g,K2HPO40.5 g,pH=7.8,双蒸水定容至1 000 mL),在28 ℃下振荡培养.大肠杆菌(Escherichia coli)培养使用Luria-Bertani(LB)液体/固体培养基(酵母提取物5 g,NaCl 10 g,胰蛋白胨10 g,pH=7.0,去离子水定容至1 000 mL,配制固体培养基时加入10 g/L 琼脂).若无 特别说明,大肠杆菌培养条件均为37 ℃.

表1 菌株和质粒Tab.1 Strains and plasmids
1.2 引物PCR 引物见表2,使用Primer Premier 5 .0 软件设计,由上海生工生物工程有限公司合成.

表2 本研究使用的引物Tab.2 Primers used in this study
1.3 化学试剂及酶所用的抗生素质量浓度分别为:阿伯拉霉素(Apra)25 μg/mL,卡那霉素(Kan)25 μg/mL,氨苄青霉素(Amp)50 μg/mL,硫链丝菌素(Thio)10 μg/mL,萘啶酸(Nal)15 μg/mL,氯霉素(Cm)20 μg/mL.所用抗生素均先配制成母液,其中氯霉素和硫链丝菌素分别用乙醇和DMSO 配制,萘啶酸用0.1 mol/L 的NaOH 溶解,其它抗生素均用无菌水配制,储存于-20 ℃备用.LATaq和ExTaqDNA 聚合酶、T4 DNA 连接酶、限制性内切酶Hind Ⅲ、XhoⅠ、BamH Ⅰ、PstⅠ和EcoR Ⅰ,以及试剂盒Universal RNA Extraction Kit 和PrimeScriptTMRT Reagent Kit(Perfect Real Time)等均购自大连宝生物公司.TransTaqDNA Polymerase High Fidelity(HiFi)购自北京全式金生物公司.细菌基因组、高纯质粒小量制备和琼脂糖凝胶回收试剂盒均购自北京百泰 克公司.
1.4orf17突变株构建及产物检测以自溶链霉菌CGMCC 0516 为出发菌株,采用PCR-targeting 方法敲除orf17基因构建其突变株,方法参照文献[22].对野生型菌株和orf17突变株进行液体发酵,先将菌株于ISP4 平板上划线,28 ℃下培养36~48 h 后,再挑取单菌落划线于ISP4 固体培养基继续培养3~4 d,待其产孢后用已灭菌的10%甘油将孢子洗出备用;然后按1%的接种量将新鲜孢子液接入50 mL TSB 液体培养基中,28 ℃,200 r/min 摇瓶培养36~48 h 获得种子液;以1%的接种量将种子液接入50 mL 61#发酵培养基中,28 ℃,200 r/min 摇瓶培养3~13 d 获得发酵液.离心收集发酵液的上清和菌体,上清用等体积乙酸乙酯萃取2 遍,菌体用丙酮浸泡过夜,萃取液分别于40 ℃旋转蒸干,甲醇溶解后合并待测.使用Agilent 1 200 高效液相(Luna XBD-C18Φ4.60×250 mm 5-Micron)分析样品,梯度洗脱流动相为水和甲醇,流速为1 mL/min,柱温为30 ℃,检测波长为254 nm.洗脱过程分3 步:第1 步,30%~100%甲醇,洗脱0~25 min;第2 步,100%甲醇,洗脱25~30 min;第3 步,30%甲醇,洗脱 30~35 min.
1.5 RT-PCR自溶链霉菌总RNA 的提取、cDNA的合成及RT-PCR 检测均参照试剂盒说明书进行操 作.
1.6 化合物的分离纯化将orf17突变株进行液体发酵,取第5、7、9 天的发酵液,按前述方法获得粗提液.然后将粗提液进行TLC 层析(展开剂:V(石油醚)∶V(丙酮)=7∶3;V(石油醚)∶V(乙酸乙酯)=7∶3;V(氯 仿)∶V(甲 醇)=95∶5;V(氯 仿)∶V(丙酮)=95∶5;V(氯仿)∶V(丙酮)=9∶1;V(氯仿)∶V(甲醇)=9∶1).根据TLC 层析结果,选择正向硅胶进行梯度洗脱划段,流动相分别为纯氯仿、氯仿/甲醇(V(氯仿)∶V(甲醇)=40∶1;20∶1;15∶1;9∶1)及纯甲醇.采用凝胶柱对收集到的40∶1 段和20∶1段进行进一步分离.之后用反向硅胶C18 对其进行梯度洗脱,流动相分别为乙腈-水(V(乙腈)∶V(水)=7∶3,8∶2,9∶1)及纯乙腈.最后用半制备LC3000 liquid chromatograph system进行制备,流动相为70%~100%乙腈-水,获得化合物纯品.之后通过质谱检测确定这3 个化合物的相对分子质量,再根据1H NMR、13C-DEPT NMR、HSQC、HMBC、1H-1H COSY 和ROESY 对其进行结构解析.
2 结果与分析
2.1orf17基因在格尔德霉素生物合成中的作用为了了解自溶链霉菌CGMCC 0516 格尔德霉素生物合成基因簇中orf17基因的功能,我们采用一步PCR 法构建了其orf17敲除突变株,经PCR 扩增(图1)和序列测定验证,此突变株构建正确.

图1 orf17 突变株的PCR 验证Fig.1 Verification of the orf17 mutant by PCR amplification
HPLC 检测野生型菌株和orf17突变株的发酵产物,结果显示:在整个发酵期间,突变株中格尔德霉素的产量相较野生型菌株明显降低(图2(a)~(i)),其中第5 天格尔德霉素的产量比野生型减少了53.7%;第7 天产量减少了52.8%;第9 天产量减少了44.1%;第11 天产量减少了56.7%(图2(j)).说明Orf17 可能参与了格尔德霉素生物合成中相关基因的表达调控,并且起到了正调控作用.
虽然在orf17突变株中格尔德霉素的产量明显降低,但仍可以在发酵产物中检测到该化合物,表明其合成途径并没有被完全阻断,并且在整个发酵过程中,格尔德霉素的产量变化趋势与野生型是一致的,这说明格尔德霉素的生物合成是一个复杂的代谢过程,众多细胞因子都参与了该合成途径的基因调控,Orf17 只是其中一个调控蛋白.此外,有3 个化合物(化合物1、化合物2 和化合物3)在突变株中的产量与野生型相比大大提高,在发酵第9天 时最为明显(图2(g)).
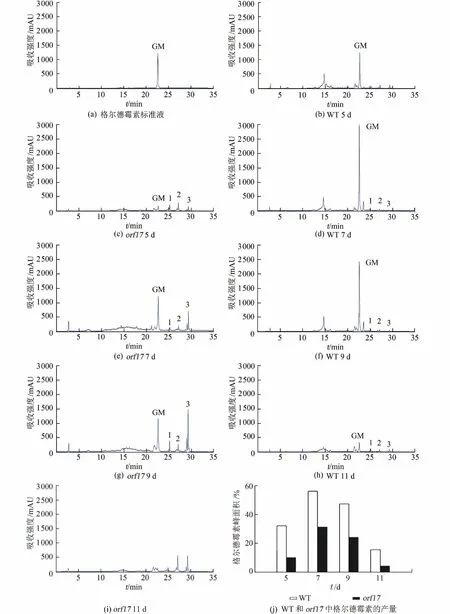
图2 野生型和orf17 突变株中化合物的HPLC 分析Fig.2 Analysis of the production of compounds in the wide-type strain and the orf17 mutant
2.2 格尔德霉素生物合成相关基因在orf17突变株中的表达为了寻找Orf17 可能调控的靶基因,我们根据生物信息学分析选取了10 个与格尔德霉素生物合成相关的基因,分析了其在野生型和orf17突变株中的转录表达差异.这些基因分别为:前体合成基因almK和almH(与almI、almJ和almG共同参与甲氧基丙二酸-ACP 生物合成);聚酮链骨架合成基因almAⅠ(编码聚酮合酶);调控基因almRⅠ、almRⅡ和almRⅢ(编码转录调控蛋白AlmRⅠ、AlmRⅡ和AlmRⅢ);后修饰基因almN(编码氨甲酰转移酶)、almM(编码黄素依赖的单加氧酶)、almP(编码P450 加氧酶)和almF(编码氨基合酶).我们分别收集培养3、5、7d 的野生型和orf17突变株菌体,提取菌体总RNA,对其进行初步定量后将其反转录合成cDNA,并以特异性引物(表2)对其进行扩增.结果显示(图3),在发酵的第3、5、7 天almAI、almN、almK和almP4 个基因在野生型和orf17突变株中均有表达,但突变株中almAⅠ表达量逐渐降低;突变株中almM、almH、almRⅠ基因第3 和5 天有表达,第7 天没有表达,而这3 个基因在野生型中均有表达;突变株中almF、almRⅡ和almRⅢ基因只在第3 天有表达,而这3 个基因在野生型中均有表达.因此,orf17基因的突变均不同程度的影响了almAI、almF、almRⅡ、almRⅢ、almM、almRⅠ和almH这7 个基因的表达,表明Orf17 可能调控了等7 个基因的表达.Orf17 对这些基因的调 控作用可能是直接的,也可能是间接的.

图3 RT-PCR 分析格尔德霉素生物合成相关基因在野生型和突变株中的转录表达Fig.3 RT-PCR analysis of the transcriptional levels of genes in the geldanamycin gene cluster in the wild-type strain and the orf17 mutant
2.3orf17突变株中产量升高的化合物分析在对orf17突变株进行发酵产物检测时,我们发现orf17突变株中出峰时间在25.2、27.1 min 和29.3 min的化合物(分别命名为化合物1,2 和3)与野生型相比产量明显提高,并且与格尔德霉素的产量变化相反,说明Orf17 可能对这3 个化合物的生物合成起到负调控作用(图4).

图4 野生型和orf17 突变株中不同发酵阶段化合物1,2,3 的产量Fig.4 The production of compound 1,2,3 in the wide-type strain and the orf17 mutant at different fermentation stage
通过对orf17突变株发酵产物的分离和纯化,我们获得了这3 个化合物的纯品.ESI-MS 分析表明化合物1、1 和3 的相对分子质量分别为1 024、1 038 和1 052(分别基于m/z1 023 [M– H]-、1 061[M+Na]+和1 051 [M– H]-).1H NMR、13C-DEPT NMR、HSQC、HMBC、1H-1H COSY 和ROESY 分析表明化合物1为洋橄榄叶素(elaiophylin),分子式为C54H88O18;化合物2为11′-o-甲基洋橄榄叶素(11′-o-methylelaiophylin)分子式为C55H90O18,化合物3为11,11′-o-二甲基洋橄榄叶素(11,11′-odimethylelaiophylin),分子式为C56H92O18.3 个化合物 都为洋橄榄叶素及其衍生物.
3 结论和讨论
本研究以自溶链霉菌为材料,探究其次生代谢产物格尔德霉素生物合成过程中的关键基因orf17的功能和调控作用.我们首先构建了orf17突变株,通过HPLC 检测了野生型和orf17突变株在不同发酵阶段产物的变化.相较野生型而言,orf17突变株中格尔德霉素的产量大幅减少,说明Orf17 在格尔德霉素的生物合成中起正调控作用.为了寻找Orf17 可能调控的靶基因,选取了10 个与格尔德霉素生物合成相关基因almAI、almF、almM、almN、almH、almK、almP、almRⅠ、almRⅡ和almRⅢ,分析了它们在野生型和突变株中的转录表达差异.结果显示almAI、almF、almM、almH、almRⅠ、almRⅡ和almRⅢ这7 个基因的表达受到了orf17突变的影响,说明Orf17 可能对这些基因直接或间接地起到了调控作用.Orf17 蛋白对这些基因的具体调控作用还有待后续进一步研究.
有趣的是,HPLC 检测表明,出峰时间在25.2,27.1 min 和29.3 min 的化合物在orf17突变株中产量提高,最终我们分离得到这3 个化合物并进行了结构解析,它们是洋橄榄叶素及其衍生物.这说明Orf17 在正调控格尔德霉素的生物合成的同时,对洋橄榄叶素的生物合成也有负调控作用.这是格尔德霉素生物合成基因簇内的Orf17 能够调控洋橄榄叶素的生物合成的首次报道.在链霉菌中次级代谢物的生物合成往往是被高度调节的,如果不同的代谢产物生物合成途径使用共同的前体,那么前体物质的供应可能会对这些途径产生影响.格尔德霉素生物合成的起始单元为3-氨基-5-羟基苯甲酸(AHBA),其合成起始于葡萄糖.而在洋橄榄叶素的合成过程中,葡萄糖通过磷酸化、dTDP 化、脱水、还原、差向异构化等反应生成2-脱氧-L-岩藻糖,再经糖基转移酶催化加入到洋橄榄叶素分子中[23].同时,在格尔德霉素和洋橄榄叶素的生物合成中,均以丙二酰辅酶A 和甲基丙二酰辅酶A 为延伸单元.因此,这两条生物合成途径之间存在竞争关系.以拮抗模式对它们的生物合成进行调节,可以在营养物质匮乏期间选择性合成所需的次级代谢产物来适应性周围的环境.Orf17 虽然是一个在特定基因簇内的调控子,但却是一个多效性调控子,这种不同生物合成途径的交叉调控,进一步表明链霉菌中次生代谢产物生物合成调节的复杂性和灵活性,也是链霉菌能够更好适应环境变化的调控机制.本研究让我们更加深入地了解格尔德霉素的生物合成机制,也为今后通过遗传手段改造苯醌安莎类抗生素提供了理论依据.

