妊娠期糖尿病患者外周血25-羟基维生素D、脂蛋白相关磷脂酶A2表达及相关性
程 锦 严 宇 朱守斌 钱立军 操炎庆
淮南新华医疗集团新华医院(232052)
妊娠期糖尿病(GDM)加大各种不良产科事件发生风险,增加产后糖尿病发病率[1]。有研究表示[2],维生素D的缺乏将降低机体胰岛素敏感性,增加胰岛素抵抗。此外,糖尿病的发生与炎症反应关系密切[3]。25-羟基维生素D[25(OH)D]是反应机体维生素D浓度的有效指标,脂蛋白相关磷脂酶A2(Lp-PLA2)是新型炎症标志物,与心血管事件及动脉粥样硬化(AS)间密切相关[4-5]。为探索GDM发病机制,本研究对两物质与GDM的相关性展开研究。
1 资料与方法
1.1 一般资料
将本院2017年1月-2019年1月收治的GDM患者63例纳为研究对象。患者孕周(26.1±1.9)周(24~28周),年龄(27.5±3.3)岁(21~35岁);将同期收治的正常妊娠孕妇纳为对照组,年龄及孕周与GDM组相匹配。GDM患者符合GDM诊断指南[6]。对照组孕妇75g葡萄糖耐量试验空腹血糖(FPG)<5.1mmol/L,1h血糖(1hBPG)<10mmol/L,2hBPG<8.5mmol/L,糖耐量正常。排除孕前糖尿病者、甲状腺疾病者、高血压、多囊卵巢综合征、肝肾功能异常者及合并其他慢性疾病及感染性疾病者。本研究经本院伦理委员会审批。
1.2 方法
1.2.1产前标本采集与检测入组后次日清晨采集空腹静脉血抗凝:采用ADVIA 1650全自动生化分析仪检测总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL)、高密度脂蛋白胆固醇(HDL)、FPG、糖化血红蛋白(HbA1c)水平,胰岛素抵抗指数(HOMA-IR)=(FPG×空腹胰岛素/22.5),胰岛素分泌指数(HOMA-β)=20×空腹胰岛素(FINS)/(FPG -3.5)。外周血25(OH)D检测采用25(OH)D定量测定试剂盒;外周血Lp-PLA2活性采用酶联免疫分析法检测,试剂盒购于Bio-Swamp公司。
1.2.2产后随访产后随访,统计产妇产后健康情况,若产妇产后被诊断为2型糖尿病或糖尿病前期,则判断其产后出现糖代谢异常。
1.3 观察指标
比较GDM组与对照组临床特征及血脂代谢指标、外周血25(OH)D水平及Lp-PLA2活性、孕产妇及围产儿并发症。分析GDM患者外周血25(OH)D水平与Lp-PLA2活性间相关性,及与患者临床特征及血脂代谢指标相关性,分析影响GDM产后糖尿病代谢异常的独立危险因素。
1.4 统计学方法
2 结果
2.1 临床特征及血生化指标比较
两组孕前BMI、TG、LDL、HDL、FPG、HbA1c、HMOA-IR、HMOA-β水平均存在差异(P<0.05),年龄、孕周及TC水平无差异(P>0.05)。见表1。
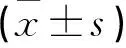
表1 两组临床特征及血生化指标比较
2.2 外周血25(OH)D水平及Lp-PLA2活性
GDM组外周血25(OH)D(10.17±2.02 ng/ml)低于对照组(22.16±3.15 ng/ml),Lp-PLA2活性(33.49±6.32 nmol/min/ml)高于对照组(23.15±4.16 nmol/min/ml)(t=22.174、8.148,均P=0.000)。
2.3 妊娠及分娩并发症
GDM组孕产妇胎膜早破、妊娠期高血压发生率及早产发生率均高于对照组(P<0.05)。见表2。

表2 两组并发症比较[例(%)]
2.4 GDM孕妇外周血25(OH)D水平与临床特征及生化指标关系
Pearson相关性分析提示,GDM组患者外周血25(OH)D水平与FPG及HMOA-IR呈负相关(r=-0.123、-0.653,P=0.041、0.000);Lp-PLA2活性与孕前BMI、TG、LDL、FPG、HMOA-IR均呈正相关(r=0.541、0.623、0.501、0.472、0.614,P=0.014、0.001、0.020、0.022、0.000),与HMOA-β呈负相关(r=-0.551,P=0.000)。25(OH)D水平与Lp-PLA2活性呈负相关(r=-0.211,P<0.05)。
2.5 GDM产后糖代谢异常的影响因素分析
产后随访(2.6±0.5)年(0.6~5年)。GDM产后共5例被诊断为T2DM,20例诊断为糖尿病前期,产后糖代谢异常发生率为39.7%。logistic回归分析提示,Lp-PLA2是影响GDM产后糖代谢异常的独立危险因素(P<0.05),25(OH)D是产后糖代谢异常的保护因素(P<0.05)。见表3。

表3 GDM产后糖代谢异常的影响因素logistic回归分析
3 讨论
临床统计数据显示,我国妊娠期糖尿病(GDM)发病率在1%~5%,GDM可能导致不良产科事件,是临床关注重点[7]。探讨GDM致病机制,积极防治GDM,在预防孕产妇及胎儿不良健康事件中具有指导性意义。本研究发现,与同龄同孕周正常孕妇相比,GDM患者妊娠期高血压、胎膜早破、早产等不良产科事件发生率更高,对母体及胎儿均有不良影响[8]。此外,GDM患者外周血25(OH)D水平更低,Lp-PLA2活性更高,两者与患者临床特征及糖脂代谢指标间均存在一定相关性,提示两物质可能参与了GDM的发生发展。
维生素D是维持机体正常代谢的重要物质,不仅参与钙磷代谢,作用于内分泌、血液及免疫系统,还可抑制炎症反应[9]。近年有研究表示[10-11],维生素D缺乏可能导致糖代谢紊乱并促进糖尿病发生。本研究发现,GDM组患者孕前BMI、TG、LDL、FPG、HbA1c、HMOA-IR水平均高于对照组,HDL及HMOA-β水平低于对照组,提示GDM患者机体糖脂代谢发生紊乱。与正常孕妇相比,GDM患者25(OH)D水平偏低。有研究表明[12],维生素D在生理条件下可刺激胰岛B细胞分泌,减少胰岛B细胞凋亡,减轻胰岛素抵抗;而维生素D的缺乏将减弱这种调节,增强胰岛素抵抗。本文相关性分析提示,GDM患者外周血25(OH)D水平与其FPG及HMOA-IR呈负相关,提示外周血25(OH)D下降可能加重胰岛素抵抗,降低胰岛素敏感性进而促进GDM发生。
慢性炎症被认为与糖尿病的发生发展密切相关,可能作为胰岛素抵抗的启动因子[13]。Lp-PLA2是心血管代谢性疾病中的新型炎症因子,参与动脉粥样硬化(AS)进程[14]。正常状态下仅存在于低密度脂蛋白中,当脂蛋白脂肪酶解作用受损时血浆含量升高。本文中,GDM患者外周血Lp-PLA2活性升高,且与患者孕前BMI、TG、LDL、FPG、HMOA-IR均呈正相关,与HMOA-β呈负相关,提示Lp-PLA2活性能在一定程度上反映GDM进程。有研究表示,Lp-PLA2可水解脂蛋白与细胞膜蛋白,产生大量溶血卵磷脂与游离氧化脂肪酸,启动炎症反应信号通路,诱导单核细胞趋化、内皮功能障碍,加重胰岛素抵抗及炎症发生[15]。
本文相关性分析提示,GDM患者外周血25(OH)D与Lp-PLA2活性呈负相关,推测维生素D缺乏还可能通过加重患者机体炎症反应加速糖尿病病情进展,但具体作用机制尚不清楚。
本文随访发现,63例GDM患者产后5例被诊断为T2DM,20例诊断为糖尿病前期,产后糖代谢异常发生率为39.7%。因素分析,Lp-PLA2升高是影响GDM产后糖代谢异常的独立危险因素,25(OH)D降低是产后糖代谢异常的保护因素。提示降低外周血Lp-PLA2浓度,孕期补充维生素D,对降低产后糖代谢异常发生有益。
综上所述,GDM患者机体存在严重的糖脂代谢紊乱,其外周血25(OH)D含量下降,Lp-PLA2活性上升,两物质水平呈负相关,可能通过相互作用促进GDM的发展。

